Redox Biol 南京医科大学第一附属医院心脏科邹建刚教授团队揭示Bmal1调控糖尿病心肌病的作用机制
时间:2023-07-16 15:18:10 热度:37.1℃ 作者:网络
糖尿病(DM)是日益严重的全球健康问题,心血管并发症是DM患者住院和死亡的主要原因。糖尿病心脏损伤表现为心脏肥大、心肌僵硬度增加、心肌纤维化和舒张功能障碍等,而收缩功能通常正常,称为糖尿病心肌病(DCM)。尽管已经发现DCM的发生发展与多种机制有关,包括氧化应激、能量代谢、炎症反应和凋亡增加等,但目前尚未完全清楚。
机体内几乎所有组织器官都存在生物钟,调控许多关键生物反应以适应内外环境变化。Bmal1是生物钟的核心基因之一,通过调节线粒体分裂融合、能量代谢和活性氧(ROS)产生等在高脂血症、动脉粥样硬化等疾病中发挥重要作用。然而在DCM中,Bmal1基因如何变化、其是否与DCM发生发展有关、以及可能的分子机制是什么,目前尚无报道。
2023年6月23日,南京医科大学第一附属医院心脏科邹建刚教授团队在Redox biology上发表了题为“Bmal1 downregulation leads to diabetic cardiomyopathy by promoting Bcl2/IP3R-mediated mitochondrial Ca2+ overload”的研究论文,揭示了心脏生物钟基因Bmal1调控线粒体Ca2+超载在DCM中的作用和分子机制,为DCM的治疗提供了新的思路和靶点。

首先,研究者发现,在T2D小鼠心脏中,Bmal1基因表达明显下降,节律消失。接着,研究者构建了心脏Bmal1基因特异性敲除小鼠(CKB),并使用AAV在T2D小鼠心脏中过表达Bmal1,以明确Bmal1变化在DCM发生发展中的作用。结果发现,CKB组及T2D+AAV-Ctrl组小鼠心肌细胞肥大,伴有明显纤维化,舒张功能下降,而在T2D小鼠心脏中过表达Bmal1可以明显缓解上述病理变化。此外,在CKB组及T2D+AAV-Ctrl组,Bmal1下降明显增加线粒体损伤及内源性细胞凋亡,而在T2D+AAV-Bmal1组,过表达Bmal1明显抑制内源性细胞凋亡,改善了线粒体状态。
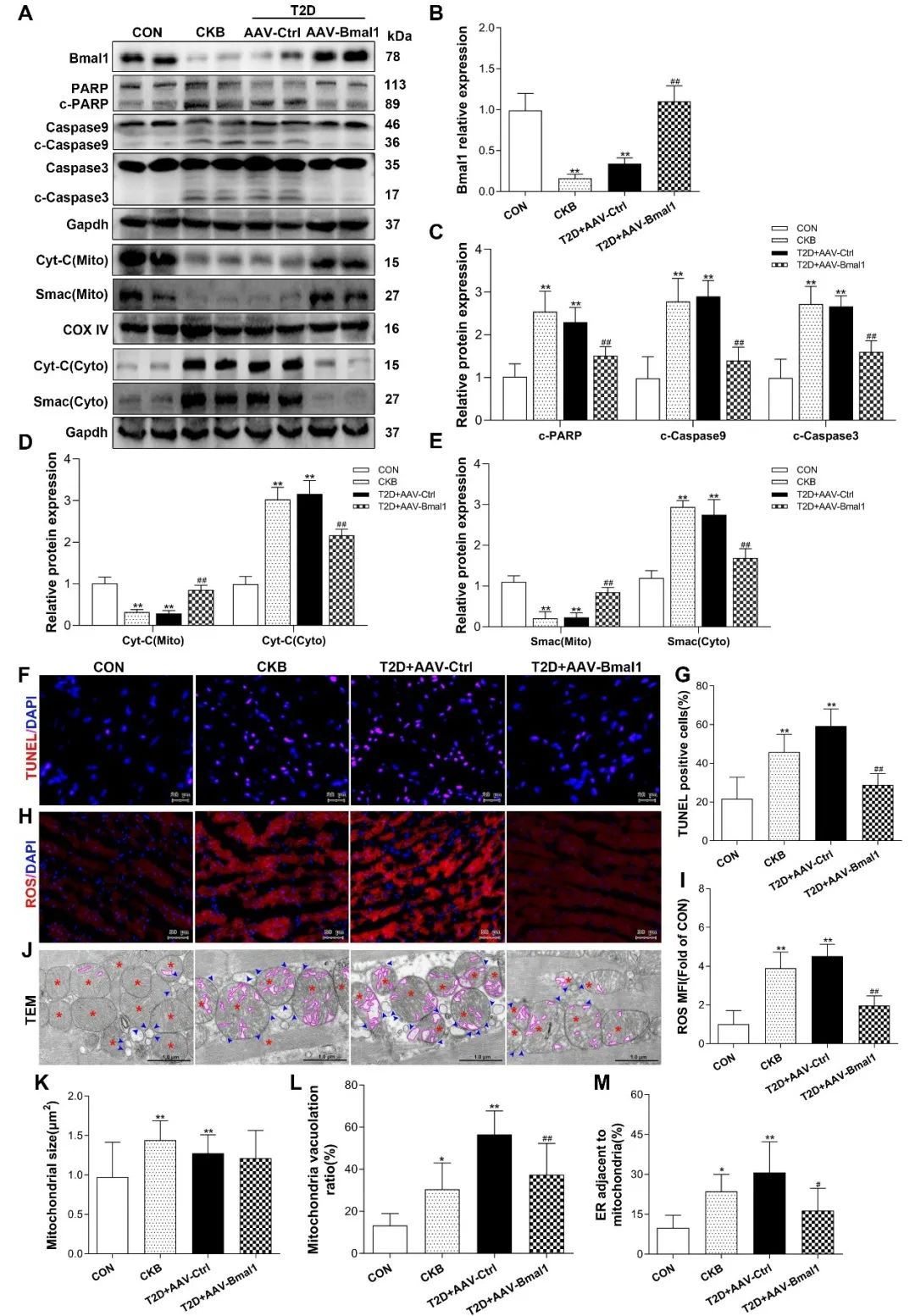
接下来,细胞实验结果显示,Bmal1下降导致细胞内线粒体介导的内源性细胞凋亡明显增加,线粒体肿胀空泡化,线粒体ROS生成增多,膜电势显著下降,在高糖高脂(HGHP)条件下过表达Bmal1可改善上述线粒体损伤及细胞凋亡情况。通过体外实验研究者进一步发现,Bmal1降低明显增加H9c2细胞内线粒体Ca2+浓度及线粒体内质网偶联结构(MAMs)的形成,过表达Bmal1可降低线粒体Ca2+浓度,抑制MAMs的形成。

为了进一步探索机制,研究者检测了MAMs区域内与钙离子转运密切相关的蛋白及调控蛋白。通过Co-IP及ChIP等一系列分子实验证明,Bcl2可通过直接与IP3R结合抑制其通道活性,且Bmal1可以直接结合于Bcl2启动子区域的E-box元件,调控其转录。在T2D情况下,Bmal1明显下降,受调控的Bcl2基因转录减少,导致Bcl2对IP3R通道活性的抑制作用减低,过多的钙离子通过MAMs释放至线粒体导致钙超载。接下来,研究者进一步使用BIRD-2(一种特异性的Bcl2/IP3R结合阻断剂)明确了Bmal1通过Bcl2/IP3R在DCM发生发展中的调控作用。

综上所述,该研究发现在T2D情况下,心脏中Bmal1基因表达明显下降,受调控的Bcl2基因转录减少,导致Bcl2对IP3R通道活性的抑制作用减低,过多的Ca2+通过MAMs释放至线粒体。线粒体Ca2+超载导致线粒体ROS生成、形态损伤和膜电位崩解,Cyt-C和Smac等促凋亡因子通过线粒体通透性转换孔漏至胞质,激活细胞凋亡,最终导致DCM。这些发现阐明了心脏生物钟基因Bmal1在糖尿病心肌病发生发展中的作用及机制,为该疾病的防治提供新的思路和潜在靶点。

南京医科大学第一附属医院张南南博士、俞灏硕士(现均为苏州市立医院北区医师)为该研究的共同第一作者,南京医科大学附属第一医院邹建刚教授为该研究的通讯作者。该工作得到国家自然科学基金、苏州市科技计划项目的资助。
原文链接:
https://doi.org/10.1016/j.redox.2023.102788


