脑穿支动脉病变梗死类型
时间:2022-12-11 23:40:36 热度:37.1℃ 作者:网络
这篇文章,通过脑穿支动脉的解剖形态、常见病变、影像表现,详细综述了脑穿支动脉脑梗死的类型和临床特点。穿支动脉是末梢动脉,其急性缺血可导致腔隙性梗死,慢性缺血可导致脑白质疏松。
脑穿支动脉病变梗死类型
和神经影像学研究进展
神经病学医学网 中国卒中杂志
作者:王一轻 刘平国 沈佳慧 蔡增林
穿支动脉通常是以大动脉为载体,发出后穿行进入脑实质内的小动脉,包括两大类分支:浅表穿支(或软脑膜支)和深穿支,前者供应大脑半球和小脑半球的外周部分、部分间脑及脑干的浅表部分,后者供应大脑半球的中间区域、小脑顶核、部分间脑及脑干的中间部。
穿支动脉阻塞会导致脑深部缺血性病变,但关于穿支动脉供应区域与梗死区域之间是否存在直接关系尚不明确,因此理解穿通支的构造对于诊断深部卒中综合征和了解穿支动脉病变梗死类型具有重要意义。
近年来,新的影像学技术如高分辨率、高场强MRI等有助于深入研究穿支动脉的解剖结构及不同穿支动脉的梗死类型。
本文主要综述前循环血管及后循环血管的穿支动脉,如Heubner返动脉、豆纹动脉、脉络膜前动脉(anterior choroidal artery,AChA)和髓质动脉等,供血区域与相邻血管之间的关系、穿支动脉病变的梗死类型及其影像学进展。
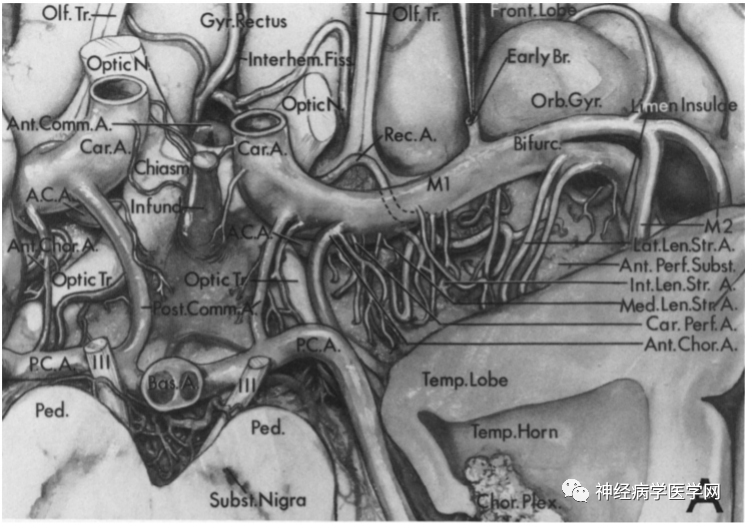 01不同穿支动脉供血区域和梗死类型
01不同穿支动脉供血区域和梗死类型
1.1 浅表穿支灌注区域和梗死类型
大脑中动脉浅表分支向侧脑室上部下行并供应半卵圆中心。半卵圆中心为大脑半球中心呈半卵圆形的白质区,主要有胼胝体的辐射纤维及经内囊的投射纤维等组成。
大部分学者在影像学上界定浅表穿支动脉区梗死(super ficial perforator infarction,SPI)为大脑皮质带以内、深穿支水平放射冠以外区域的梗死。与位于侧脑室旁内侧分水岭区梗死(internal border-zone infarction,IBI)不同的是,SPI多位于外侧且广泛分散(如下图1 图2)。
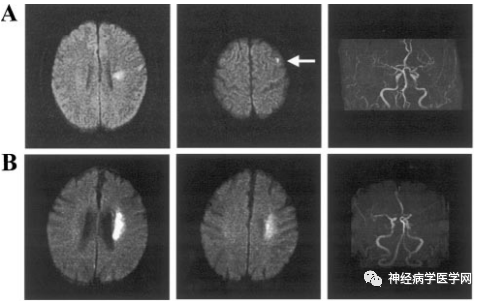 图1 A:一名72岁男性SPI患者的DWI梗死灶特点及MRA情况; B:一名64岁男性IBI患者的DWI梗死灶特点及MRA情况.
图1 A:一名72岁男性SPI患者的DWI梗死灶特点及MRA情况; B:一名64岁男性IBI患者的DWI梗死灶特点及MRA情况.
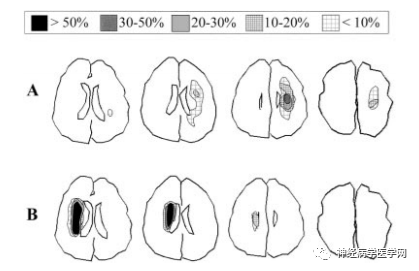 图2 分别是SPI(A)、IBI(B)的DWI上梗死灶分布特点示意图
图2 分别是SPI(A)、IBI(B)的DWI上梗死灶分布特点示意图
SPI的发病机制仍有争议,国内学者吴芳等[7]通过HR-MRI评估SPI和深穿支动脉区梗死(deep per forator infarction,DPI)患者颅内大动脉管壁及管腔狭窄特征,证实SPI患者颅内大动脉粥样硬化斑块的发生率高于DPI患者,且SPI患者管腔狭窄程度大于DPI患者(如下图3 4 5)。
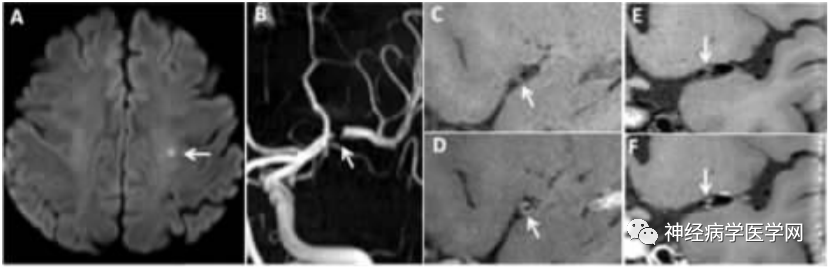 图3:SPI 病人。A DWI上显示左侧半卵圆中心点状高信号。B TOF-MRA显示左侧大脑中动脉(MCA)M1段局部血流信号中断。C、D 矢状面HR-MRI,增强前(C)和增强后(D)影像显示左侧MCA偏心性斑块伴强化(1 级),管腔狭窄程度为66.7%。E、F冠状面增强前后HR-MRI影像显示左侧MCA主干孤立性斑块。
图3:SPI 病人。A DWI上显示左侧半卵圆中心点状高信号。B TOF-MRA显示左侧大脑中动脉(MCA)M1段局部血流信号中断。C、D 矢状面HR-MRI,增强前(C)和增强后(D)影像显示左侧MCA偏心性斑块伴强化(1 级),管腔狭窄程度为66.7%。E、F冠状面增强前后HR-MRI影像显示左侧MCA主干孤立性斑块。
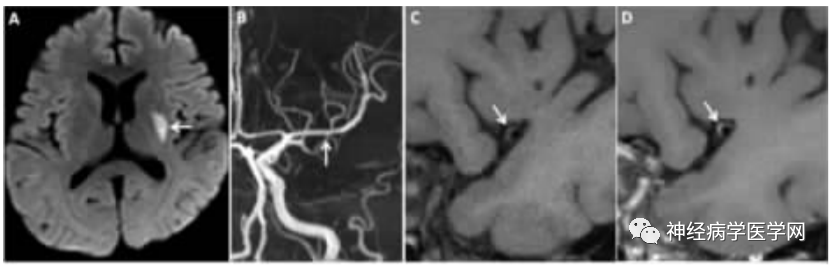 图4:DPI 病人。A DWI上显示左侧基底节区高信号病变。B TOF-MRA显示左侧MCA-M1段管腔轻度不规则。C、D血管横断面HR-MRI影像,增强前(C)和增强后(D)影像显示左侧MCA偏心性斑块伴强化(1 级),管腔狭窄程度为33.3%。
图4:DPI 病人。A DWI上显示左侧基底节区高信号病变。B TOF-MRA显示左侧MCA-M1段管腔轻度不规则。C、D血管横断面HR-MRI影像,增强前(C)和增强后(D)影像显示左侧MCA偏心性斑块伴强化(1 级),管腔狭窄程度为33.3%。
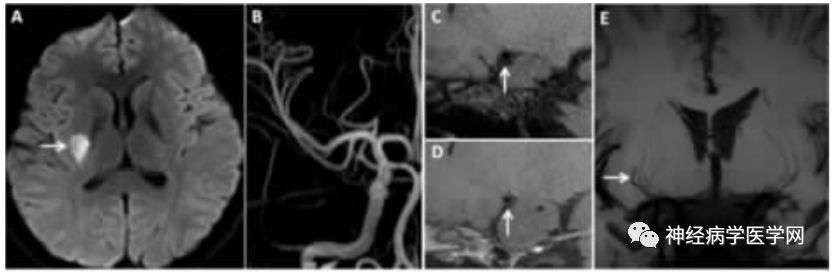 图5:DPI 病人。A DWI上显示右侧基底节区高信号病变。B TOF-MRA显示右侧颅内大动脉未见明确狭窄。C、D矢状面HR-MRI,增强前(C)和增强后(D)影像显示右侧MCA管壁未见异常增厚或强化。E 冠状面最小密度投影影像显示右侧MCA 一穿支动脉较对侧变短。
图5:DPI 病人。A DWI上显示右侧基底节区高信号病变。B TOF-MRA显示右侧颅内大动脉未见明确狭窄。C、D矢状面HR-MRI,增强前(C)和增强后(D)影像显示右侧MCA管壁未见异常增厚或强化。E 冠状面最小密度投影影像显示右侧MCA 一穿支动脉较对侧变短。
1.2 Heubner返动脉灌注区域和梗死类型
Heubner返动脉从大脑前动脉的前交通动脉附近分出(A1~A2交界处),可有1~3个穿通分支,进入前穿质、尾状核的前半部分、壳状核的前1/3、苍白球的前内侧部分、内囊膝部/前肢的前下部分、前连合部分、下丘脑前核,主要供应基底神经节的前腹侧、额叶、嗅球、下丘脑前部、视神经等。
 图6 O:Heubner返动脉从大脑前动脉的前交通动脉附近分出(A1~A2交界处);P:由前穿质前半部进入脑实质
图6 O:Heubner返动脉从大脑前动脉的前交通动脉附近分出(A1~A2交界处);P:由前穿质前半部进入脑实质
有学者认为Heubner返动脉的供血区域对应边缘区,外侧豆纹动脉的供血区域对应感觉运动区,内侧豆纹动脉的供血区域对应外侧边缘区和腹内侧感觉运动区等。
Heubner返动脉单侧损伤会导致对侧上肢瘫痪、对侧面部瘫痪、构音障碍、偏身舞蹈病,双侧损伤可导致运动不能性缄默(akinetic mutism)。
虽然Heubner返动脉和豆纹动脉是来自不同大动脉的终末动脉,但二者供应基底神经节的相同区域,其梗死类型分为放射冠区和半卵圆中心区两种模式(如下图6)。
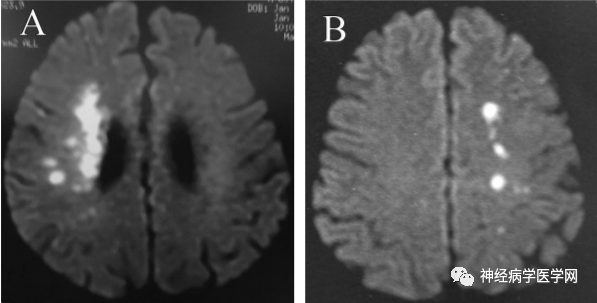 图7:放射冠区(A)和半卵圆中心区(B)两种模式
图7:放射冠区(A)和半卵圆中心区(B)两种模式
1.3 豆纹动脉灌注区域和梗死类型
豆纹动脉是一个穿通性分支,从大脑中动脉主干的水平部分(M1部分)分出,由2~12个分支(平均7.1个分支)组成,有时在M2部分还有一个分支。豆纹动脉从大脑中动脉M1部分的近端到远端依次分出,呈洋葱皮样排列,近端发出的分支较细,越往远端发出的分支越粗,分支直径一般在700~800μm之间,随后血管直径扩大。
按照从M1段发出的部位,豆纹动脉分为内侧组、中间组和外侧组三组,Marinković等 研究表明:内侧组供应壳核内部和苍白球背面,中间组和外侧组形成外部群,供应大部分壳核、 苍白球的外部、尾状核上方及内囊(如下图)。
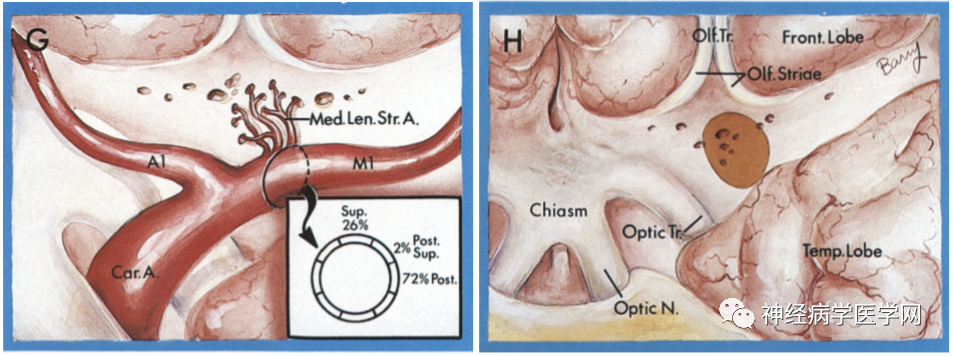 图8 G:豆纹动脉内侧组从M1段近端发出;H:由前穿质内侧进入脑实质
图8 G:豆纹动脉内侧组从M1段近端发出;H:由前穿质内侧进入脑实质
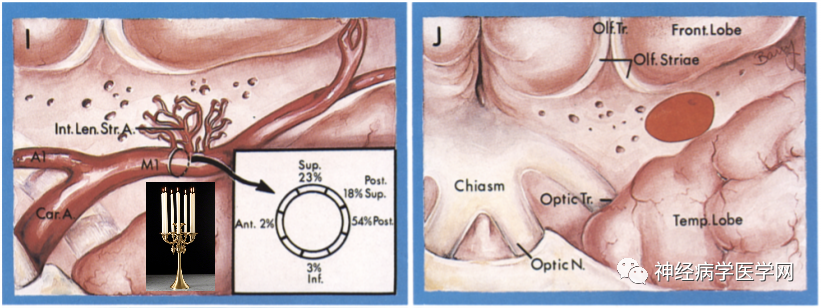 图9 I:豆纹动脉中间组由M1段发出,末端分支比较复杂,进入前穿质前形如枝状大烛台;J:由前穿质中后区进入脑实质。
图9 I:豆纹动脉中间组由M1段发出,末端分支比较复杂,进入前穿质前形如枝状大烛台;J:由前穿质中后区进入脑实质。
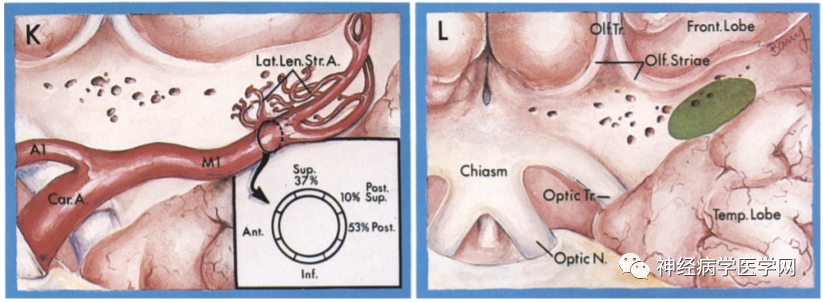 图10 K:豆纹动脉外侧组起源于大脑中动脉分叉处,在M1和M2附近发出,走形呈S形;L:由前穿质中后区进入脑实质。
图10 K:豆纹动脉外侧组起源于大脑中动脉分叉处,在M1和M2附近发出,走形呈S形;L:由前穿质中后区进入脑实质。
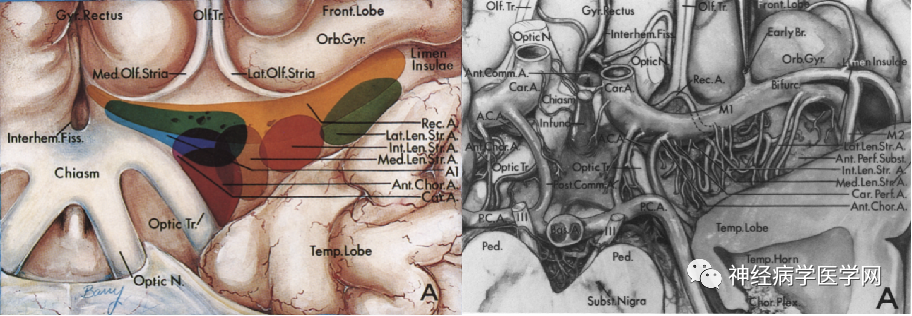
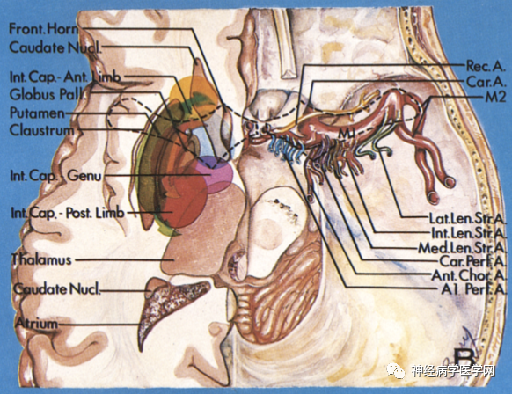 图11:穿过前穿质的各穿支动脉供应分布图
图11:穿过前穿质的各穿支动脉供应分布图
豆纹动脉成直角发出,并沿与M1段血流方向相反的方向(即向内)延伸,故承受的血流冲击压力更大。
豆纹动脉供血区域的梗死类型:
-
腔隙性梗死
-
穿支动脉粥样硬化病(BAD)型梗死
-
纹状体内囊梗死(SCI)
1989年Caplan首次提出BAD这一概念来描述深穿支动脉起始部分的狭窄或闭塞,其发病机制与小动脉粥样硬化或开口处的斑块有关,并且可以导致内囊或者脑桥等部位小的梗死灶。Fisher认为脂质透明变性发生在直径200μm或更小的血管中,导致豆纹动脉分支远端2~5mm的腔隙性梗死。
如果穿支动脉起源动脉微动脉粥样硬化闭塞,可引起整个穿支动脉梗死,则被认为是BAD型梗死。
但是,即使不是豆纹动脉发出部位,大多数豆纹动脉梗死也是直径300~700μm血管基于微动脉粥样硬化的梗死,因此,在许多腔隙性梗死病例中,病理基础为微动脉粥样硬化者比脂质透明化者多。
穿支动脉的起始处闭塞,则可以将豆纹动脉的BAD型梗死分为前/后型:后型损害了皮质脊髓束,常可以预测患者会出现进行性运动障碍和严重瘫痪(如下图)。
BAD型梗死前/后分型方法如下:
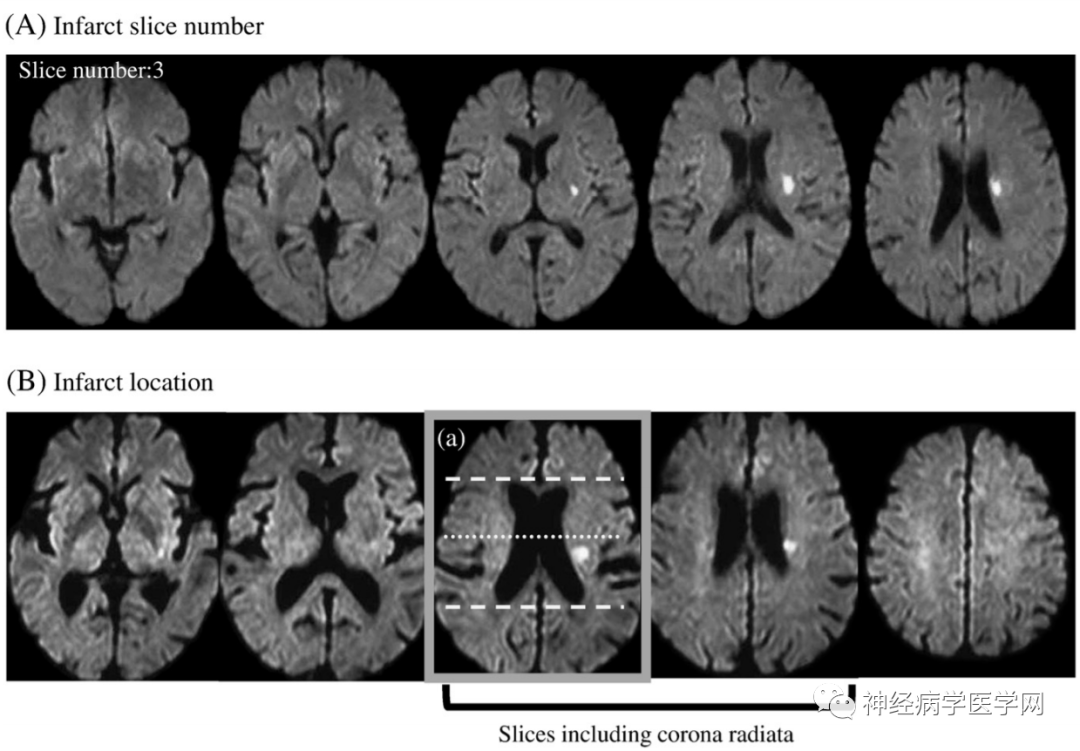
另举例如下图12:
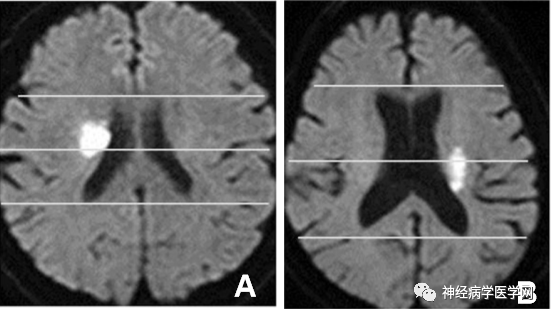 图12:由侧脑室前后径中点水平线将BAD型脑梗死分为前型(A)和后型(B)
图12:由侧脑室前后径中点水平线将BAD型脑梗死分为前型(A)和后型(B)
该分型的临床意义就在于梗死后型常可以用来预测患者会出现进行性运动障碍,因为后型损害了皮质脊髓束。
纹状体内囊梗死(SCI)是一种比较特殊的基底节区脑梗死类型,1984年Bladin等[20]提出了SCI的概念,将直径≥3cm作为诊断SCI的“金标准”,且认为梗死灶至少包括尾状核头和内囊或壳核和内囊,可伴有多种皮质症状。
SCI通常是直径2.0~3.0cm的多个豆纹动脉梗死,表现形式为晶状体型、逗号型、三角形型梗死。
SCI形成机制中栓塞原因最常见,但也可能是基于动脉粥样硬化。纹状体内囊整个区域梗死可观察到以壳核为中心和以尾状核头为中心两种模式。
另外,根据缺血的程度,还可有单一血管梗死的“斑驳型”缺血,而不是均匀的梗死病灶。
1.4 脉络膜前动脉灌注区域和梗死类型
颈内动脉发出眼动脉和后交通动脉后,AChA从外侧分出,沿视束向后外侧走行,从颞叶的内侧穿过发出穿支进入苍白球和内囊后肢,然后向侧方发出分支负责部分颞叶的血供,并有分支负责部分中脑和丘脑的血供,最后终止于外侧膝状体和侧脑室下角脉络丛。
AChA进入脉络裂以前的部分因行于环池内称为池部,进入脉络裂以后的部分称为脑室部。
池部有三支主要血管分支:
①分支向外侧分布供应颞叶内侧(杏仁核、钩回、海马前部);
②向内延伸供应大脑脚和中脑的分支;
③向上穿支供应内囊和基底神经节的分支。
也有学者将第三分支分为近端分支和远端分支,近端分支供应内囊膝部和内苍白球,远端分支供应内囊后肢和丘脑外侧。
内囊为大脑传入神经和传出神经的汇聚处,锥体束、丘脑皮质束、视辐射及听辐射均于此处汇聚通过。内囊后肢前2/3为皮质脊髓束通过,后1/3为丘脑皮质束、视辐射及听辐射的纤维通过。内囊缺血损伤后出现典型的对侧肢体偏瘫、偏身感觉缺失、同向偏盲,即AChA综合征。
受侧支循环影响,不同类型AChA梗死类型不同,在颈内动脉闭塞的情况下,后交通动脉和(或)前交通动脉和同侧大脑前动脉的血流 是闭塞颈内动脉的侧支血流来源,如果侧支循环充分,AChA供血区域可能会免于梗死。AChA直径小,其梗死通常表现为腔隙性梗死,可能由穿支动脉阻塞引起,但大动脉或心脏栓塞也可能导致AChA供血区域完全梗死。
1.5 髓质分支灌注区域和梗死类型
半卵圆中心是大脑中动脉和大脑前动脉的皮质分支之间的边界区域。供应半卵圆中心的血管是髓质分支,从大脑皮层分支垂直进入髓质。髓质分支也被称为浅表穿支,以区别于基底节和丘脑的深穿支。
髓质分支梗死会引起几乎垂直于脑室的独特的分支梗死,Yonemura等[26]指出,髓质分支梗死中栓塞性病变比颈内动脉和大脑中动脉狭窄/闭塞病变更为常见。
有学者对79例髓质梗死患者进行了经食管超声心动图检查,发现有45例(57.0%)为栓塞性脑梗死,即超过一半为卵圆孔未闭、主动脉复杂斑块病变、心房颤动、 颈动脉病变引起的栓塞性脑梗死,其他非栓塞性脑梗死为腔隙性梗死。
髓质分支梗死是一种小梗死,往往被认为是一种小血管疾病,但是有必要动态监测栓子,并且在某些情况下,需要包括经食管超声心动图在内的检查寻找栓子来源。
普通水平成像很难区分髓质分支梗死和豆纹动脉梗死,髓质分支中从大脑中动脉M2段向脑室前角发出的分支称为长岛状动脉, Tamura等[27]检查了8例长岛状动脉梗死病例, 发现影像学上几乎沿着连接外侧裂上端与前角的线(前角-岛状裂,A-I线)呈现,与深穿支动脉梗死相比,浅表穿支动脉栓塞源性疾病起病更急且病情更重。
尽管长岛状动脉梗死是髓质分支梗死,但其靠近豆纹动脉,对于区分A-I线上方的髓质分支供血区域和下方的柱状纹状体动脉供血区域很重要。半卵圆中心是皮质分支之间的边界区域, 边界区梗死主要发生在颈内动脉狭窄或闭塞的情况下,在这种情况下,短暂性脑灌注不足可引起多个不连续的小梗死,冠状切面更易发现梗死是大脑前动脉和大脑中动脉之间的边界区梗死[28]。
另外,放射冠指的是半卵圆中心的下部, 是豆纹动脉的末端区域,对应于大脑中动脉M1段、豆纹动脉的皮质分支与髓质分支之间形成的边界区域,被称为深边界区梗死(internal border-zone infarction,IBZ)。
在大脑中动脉M1段狭窄或闭塞的情况下,大脑中动脉主干中的血液灌注不充分,导致豆纹动脉与大脑中动脉髓质分支之间的梗死,其特征为DWI高信号在放射冠前后呈串珠状分布。
2穿支动脉病变影像学进展
穿支动脉闭塞引起的梗死是缺血性卒中的重要亚型,但长期以来病因诊断困难,原因是穿支动脉细小,常规成像方法难以显示,而高分辨管壁成像具有高空间分辨率,可清晰地显示穿支动脉管壁的细微结构,从而可以检测出更小的动脉粥样硬化斑块,有助于穿支动脉疾病的研究[30]。
最近发展起来的超高场强7T MRI,显示小穿支血管细微结构的功能远远优于1.5T MRI和3T MRI。此外, 7T MRI的信噪比比3T MRI的信噪比提高约88%。Geurts等应用7T二维相位对比MRI (2D-PC-MRI)测量基底神经节和半卵圆中心穿支动脉的血流搏动指数,证明由脑小血管病变引起的卒中患者的基底神经节和半卵圆中心穿支动脉功能异常,与健康对照组相比,腔隙性梗死和深部微出血患者的穿支动脉数量较少,搏动指数(plusatility index,PI)较高。
Arts等应用7T 2D-PCMRI自动测量脑穿支动脉的血流速度和搏动性,认为这种方法可以为研究脑小血管病微循环提供更精确的定量方法,对于确定穿支动脉损伤与血管性脑损伤(如微出血、梗死、深部脑白质完整性下降及血流动力学改变)的相关性具有重要价值,可发现血管性认知障碍患者早期发生的变化。
近年来,许多新的影像学方法被广泛应用于脑穿支动脉的研究。
Liang等[36]纳入31名健康受试者和28例豆纹动脉梗死患者,采用3D-TOF-MRA和三维快速自旋回波T1WI (3D-FSE T1WI,即GE Healthcare中的CUBE T1)进行研究,结果表明豆纹动脉梗死患者患侧豆纹动脉的数量少于健康受试者对侧和同侧豆纹动脉的数量,Heubner返动脉异常可导致半卵圆中心梗死,豆纹动脉异常与放射冠梗死相关。
其认为HR 3D-FSE T1WI(CUBE T1)可可视化检测穿支动脉血管壁的病理变化,而HR 3D-TOF-MRA则可专门检测穿支动脉的数量,二者可有效识别穿支动脉及其梗死类型。
Wang等应用全脑高分辨率心血管MRI(WB-HRCMR)评估近期卒中患者豆纹动脉的变化,结果表明与无症状颅内动脉粥样硬化性狭窄(ICAS)相比,症状性ICAS豆纹动脉斑块特征更明显、长度更短,且认为豆纹动脉平均长度是卒中的独立预测因素。
3小 结
不同穿支动脉梗死类型不同:
豆纹动脉供血区域的梗死类型为腔隙性梗死、BAD型梗死和SCI;
Heubner返动脉单侧闭塞可导致对侧上肢瘫痪、面部瘫痪、构音障碍、偏身舞蹈病,双侧损伤可导致运动不能性缄默;
AChA病变可导致对侧肢体偏瘫、偏身感觉缺失、同向偏盲,即AChA综合征;
髓质分支梗死会引起几乎垂直于脑室的独特的分支梗死,还会导致半卵圆中心、放射冠部位的边界区梗死。
穿支动脉是末梢动脉,其急性缺血可导致腔隙性梗死,慢性缺血可导致脑白质疏松,后者临床更常见。
白质疏松症首先发生在脑室周围和深部白质区域,这两个区域都是分水岭地区,任何弥散性动脉病都会加剧其灌注压力,使其受到慢性缺血性损伤的影响。
神经影像学新技术(如7T 2D-PC-MRI、HR 3D-TOF-MRA、HR 3D-FSE T1WI等)有助于确定穿支动脉早期病变,并可早期发现疾病的发生发展。


