PNAS封面 | 北京大学陈知行团队研发新探针实现线粒体多色STED成像
时间:2022-12-26 21:00:37 热度:37.1℃ 作者:网络
线粒体是细胞的动力来源,影响细胞稳态、增殖、死亡的关键信号通路。由于线粒体的动态行为和与其他细胞器的丰富相互作用,荧光显微镜的发展特别推动了线粒体研究线粒体。线粒体内膜 (inner membrane, IM)向内凹陷形成许多层状或管状的内嵴,其间距通常小于100 nm,导致传统荧光显微镜无法观察到其内部精细结构。因此,基于固定样本的电子显微镜技术一直作为捕捉线粒体膜结构的主流工具。
近年来,活细胞线粒体纳米成像已从原理验证发展成为一种结构和功能研究的可行方法。其中,受激发射损耗纳米显微镜(STED)和结构光照明显微镜(SIM)已被报道用于活细胞的内嵴成像。然而,目前线粒体纳米结构的可视化大多局限于癌细胞的二维(2D)单色成像,正交策略尚未建立,且STED图像采集会受到细胞器的光损伤或快速光漂白的影响,很难观察到原生状态下的线粒体形态。
2022年12月20日,北京大学未来技术学院、北大-清华生命科学联合中心陈知行课题组在PNAS 杂志上发表了题为 “Multi-color live-cell STED nanoscopy of mitochondria with a gentle inner membrane stain” 的研究论文,并被选为封面文章。该研究报道了一款适用于STED纳米显微镜的线粒体内嵴染料PK Mito Orange (PKMO),具有优秀的光稳定性和显著降低的光毒性,可实现在永生化哺乳动物细胞系、原代细胞和组织中的长时程、超分辨率的线粒体动力学成像, 单个线粒体的3D-STED成像,以及多色STED成像(图1)。

该研究利用环辛四烯(COT)偶联策略降低染料光毒性,同时精确调控光谱使得染料与561nm激发光和775nm STED光完美兼容。PKMO染色后的细胞在STED 纳米显微镜下,可观察到整个细胞中具有高度有序的层状内嵴网络,并以低至50 nm的光学分辨率捕获了单个线粒体内嵴形态和线粒体分裂、融合以及管状发生等动态过程。PKMO因其温和的性质和优秀的光稳定性可实现活细胞中单个线粒体的3D STED重建。PKMO除了可应用于癌细胞和永生化的细胞系以外,也可实现对光毒性极为敏感的原代细胞和组织的超分辨成像。PKMO成功展示了在COS-7,HeLa,U-2 OS细胞系以及原代脂肪细胞,原代神经元,原代胰岛组织中的内嵴结构及其动力学过程。
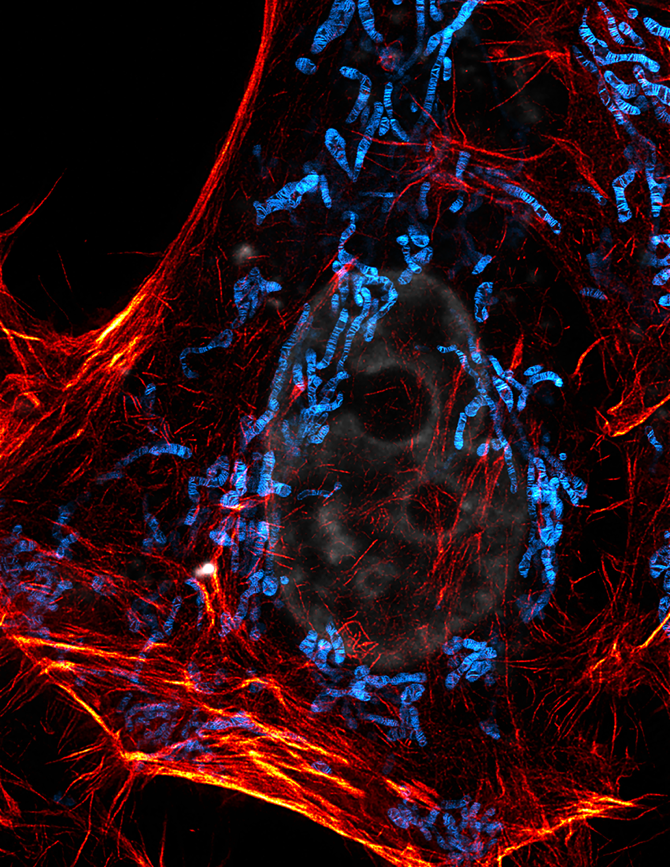
图1:PKMO标记的HeLa细胞线粒体内嵴,微丝蛋白(SPY650FastAct),和细胞核(SPY505 DNA)的多色活细胞成像图
线粒体的双层膜结构产生了线粒体亚区室,它们有着不同的用途。多色纳米显微镜技术因其可提供较高的分辨率和更多的时空信息,将取代传统的生化分析或电子显微技术成为一个强有力的新型分析手段。如图2所示,PKMO成功展示了与线粒体IM与线粒体DNA(mtDNA)、线粒体外膜、crista junction,微管蛋白和内质网的多色超分辨成像。多色活细胞STED成像可以揭示生物分子的不同线粒体定位以及线粒体在全细胞内的互作网络; 可提供与要求更高的免疫电镜技术相似的信息,且可绘制有关结构和生物分子动力学的更多信息。
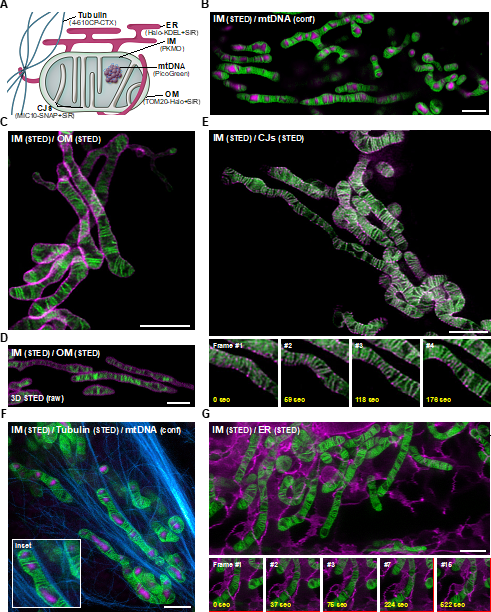
图2:线粒体内嵴与mtDNA、线粒体外膜,crista junction,内质网、细胞骨架的多色STED成像
内嵴结构的缺陷与细胞呼吸功能障碍有关,并与神经退行性疾病或心脏病有关。作者还展示了不同线粒体蛋白缺陷型的细胞系与野生细胞系的内嵴形态的差异。在未来,利用PKMO对活细胞进行超分辨成像有望取代传统耗时费力的电镜制样,成为线粒体结构功能研究的日常工具。
综上,作者团队报道了一种兼容活细胞STED成像的、高亮度、低光毒性的新型线粒体探针。PKMO可在永生化的哺乳动物细胞系、原代细胞或组织中实现长时间、超分辨率的内膜动力学记录。PKMO的光稳定性和光毒性为活细胞线粒体的3D STED显微镜打开了大门。同时,PKMO可兼容绿色和远红荧光标记物,实现多色超分辨率下的线粒体亚结构的多组分分析。多色STED显微镜可在100 nm分辨率下捕获线粒体与不同细胞成分的相互作用,BAX诱导的细胞凋亡过程,以及转基因细胞中的内嵴表型。因此,这项工作提供了一个多功能的工具,用于以多路复用的方式研究线粒体内膜结构和动力学。
北京大学前沿交叉学科研究院、北大-清华生命联合中心2019级博士生刘天妍、马克斯·普朗克多学科科学研究所的博士后Till Stephan (Stefan Jakobs课题组) 为共同第一作者。北京大学未来技术学院、北大-清华生命科学联合中心陈知行研究员为本文的通讯作者。陈知行课题组一直致力于研发新型探针,助力未来成像技术的发展,2018年建组以来重点在活细胞成像探针方向发力。之前的系列工作吸引了马克斯普朗克研究所的Stefan Jakobs课题组共同合作,深度展示了光学性能优异的PKMO探针在线粒体结构与功能研究中的应用潜力。目前该探针由南京浦海景珊生物技术有限公司销售,并与瑞士Spirochrome公司合作进行全球推广。期待本成果能推动相关研究方向与超分辨成像组学新范式融合,成为拥有自主知识产权的关键生物技术,最终惠及广大线粒体研究工作者。
原文链接:
https://www.pnas.org/doi/10.1073/pnas.2215799119


