Adv Sci 中国科学院上海营养与健康研究所杨黄恬研究组合作发现,人多能干细胞源心外膜细胞促进梗死心肌修复的作用和炎症调控机制
时间:2023-08-03 15:26:09 热度:37.1℃ 作者:网络
心肌梗死(心梗)导致不可逆的心肌细胞死亡,丢失的心肌细胞被纤维疤痕替代,继而导致心脏功能适应不良甚至心力衰竭,严重威胁患者健康和生命。同时,心梗导致其它非心肌细胞死亡和心肌组织破坏;而急性心梗后过度炎症反应又加重了心肌损伤。因此,发现适度调控急性心梗后炎症微环境、激活心脏内源性修复机制和方法对发展促进梗死心肌修复的策略具有重要意义。
心外膜细胞主要分布在心包膜脏层,为间皮细胞,在心脏发育过程中通过上皮间质转化参与冠状动脉形成与心肌细胞增殖调控。移植心脏分离的心外膜来源细胞具有促进小鼠梗死心肌修复的作用,但机制远未阐明。人多能干细胞(hPSCs)源心外膜细胞(hEPs)作为支持细胞与hPSCs源心肌细胞(hCMs)共移植促进hCMs肌丝结构成熟和驻留,但尚不清楚hEPs是否具有促进梗死心肌修复的作用。
2023年7月28日,中国科学院上海营养与健康研究所杨黄恬研究组与同济大学附属东方医院高崚研究组合作在国际学术期刊Advanced Science在线发表了题为“hESC-Derived Epicardial Cells Promote Repair of Infarcted Hearts in Mouse and Swine”的研究论文。该研究发现移植hEPs可改善小鼠和猪心梗后心功能、抑制疤痕形成,并发现hEPs通过抑制干扰素IFN-β介导的炎症反应,进而促进梗死心肌修复的旁分泌新因子新机制。

研究人员利用小鼠和猪心梗模型,结合多种研究方法发现心梗急性期移植hEPs促进小鼠心功能恢复、抑制疤痕形成,并伴随着单核/巨噬细胞浸润减少、修复型巨噬细胞增多、促进心肌细胞存活和血管、淋巴管新生。
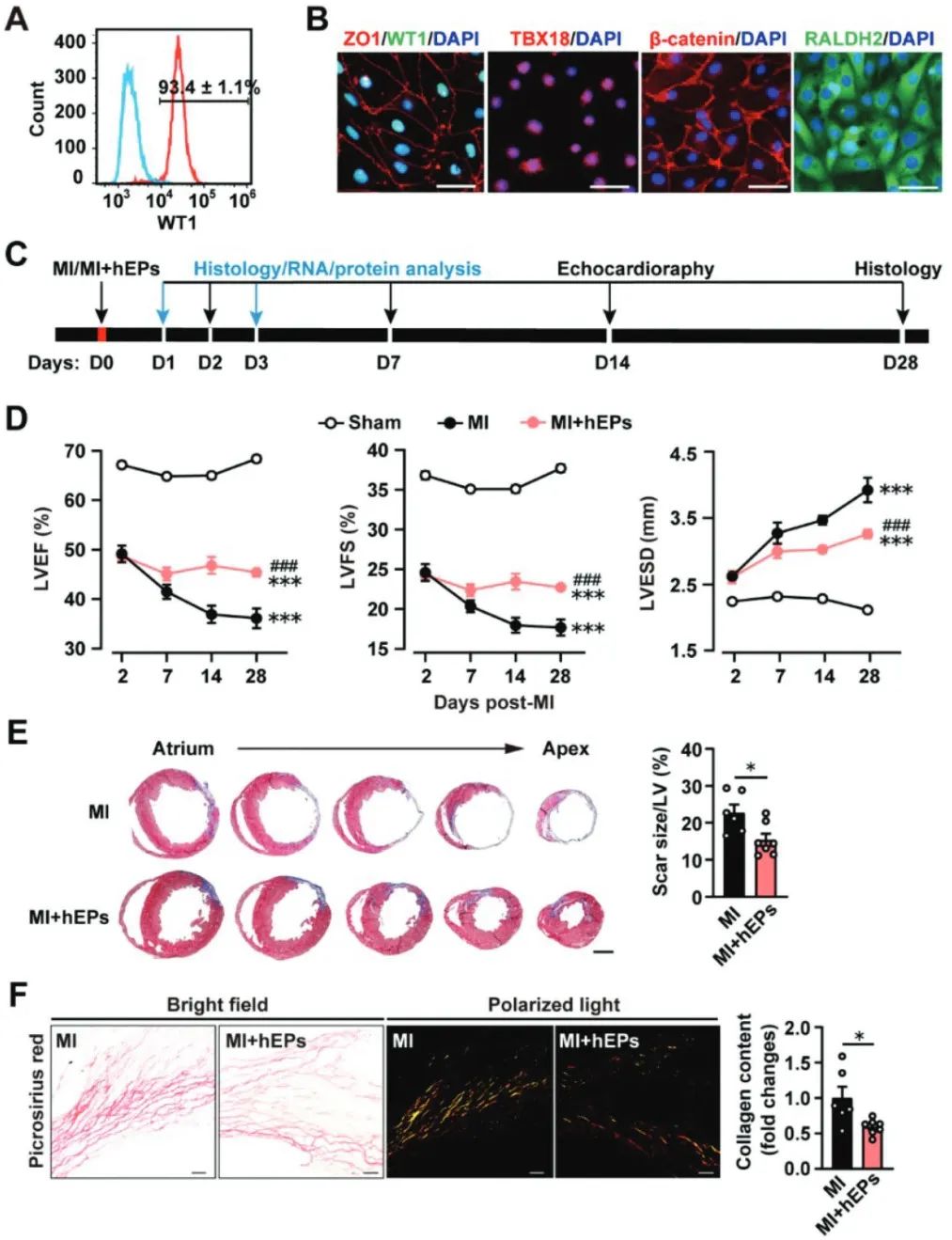
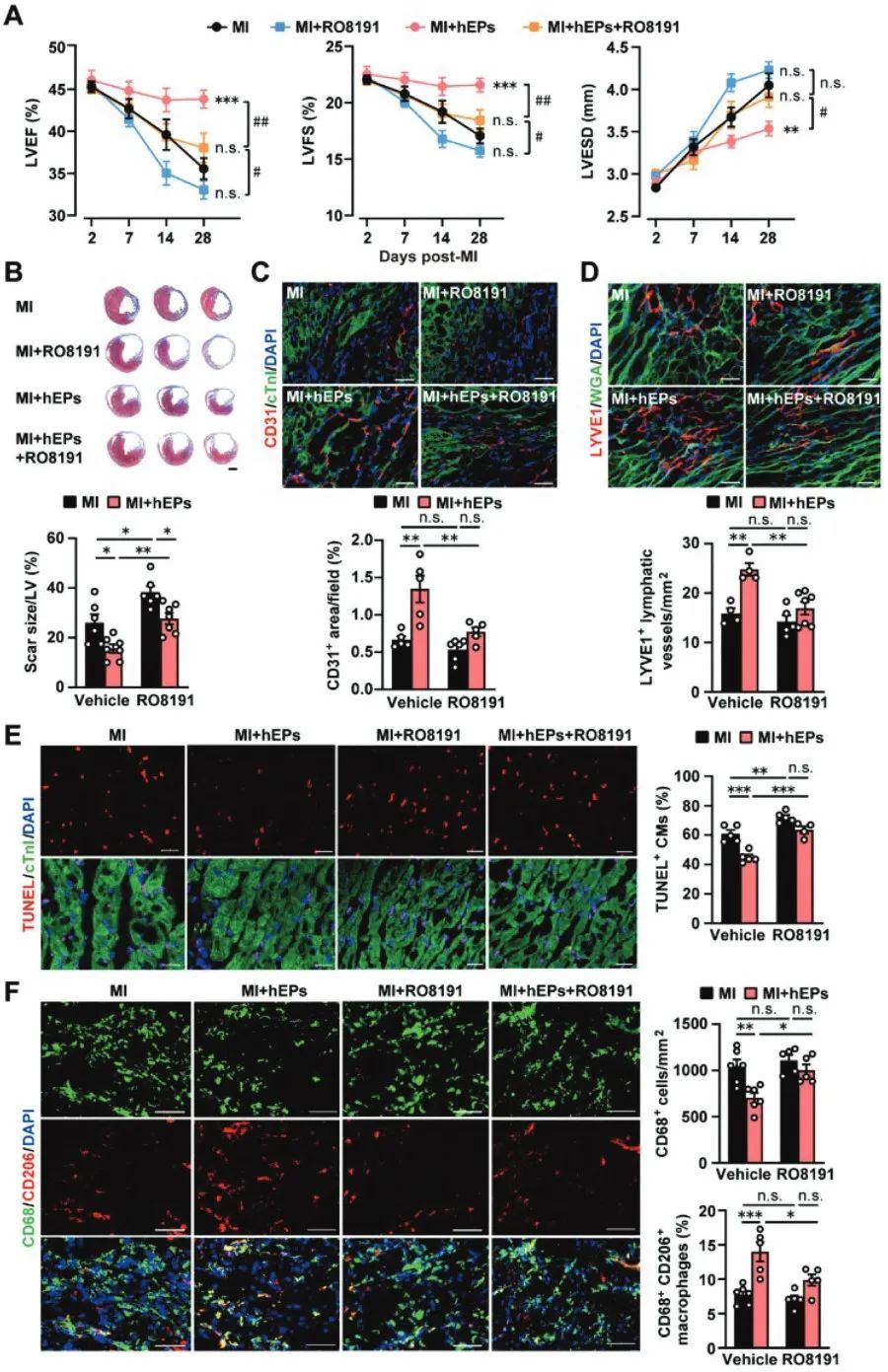
机制分析发现,hEPs移植显著抑制梗死心肌炎症反应,尤其是下调I型干扰素(IFN-I)信号;IFN-I受体激动剂RO8191削弱hEPs介导的抑制炎症反应、促进修复型巨噬细胞极化和心肌修复的作用;质谱筛选和多方验证发现hEPs分泌内凝集蛋白(ITLN1),其可与IFN-β结合,模拟hEPs抑制IFN-I介导的炎症反应和促进修复型巨噬细胞极化的作用;移植ITLN1敲低的hEPs则取消hEPs在梗死心脏抑制IFN-I信号、炎症调控和心肌修复作用。
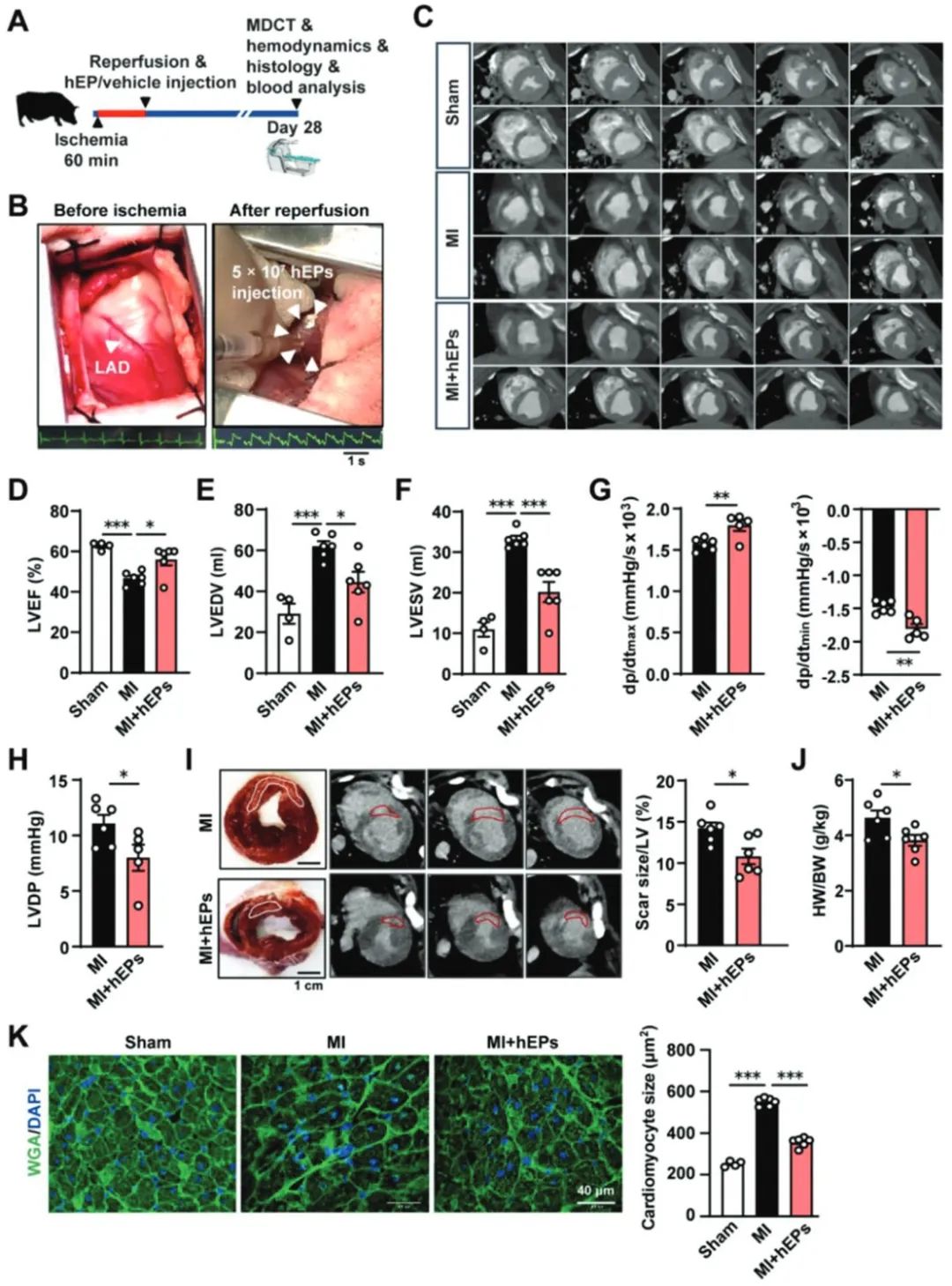
进一步,在更接近临床的猪心梗模型证明移植hEPs抑制炎症反应、促进猪梗死心肌修复,且未观察到器官毒性。
综上,hEPs移植促进小鼠和猪梗死心肌修复,其主要机制之一是hEPs分泌的ITLN1与IFN-β相互作用,进而抑制IFN-I途径介导的巨噬细胞炎症反应、促进修复型巨噬细胞极化。该研究揭示了hEPs及分泌的蛋白因子通过抑制IFN-I途径调控炎症反应,进而促进心肌修复的重要作用,并发现了调控IFN-β的新模式和调控炎症反应的新机制,证明精确调控急性心梗后炎症反应对心肌修复至关重要、提示hEPs有可能成为心梗后心肌修复的新型细胞来源。
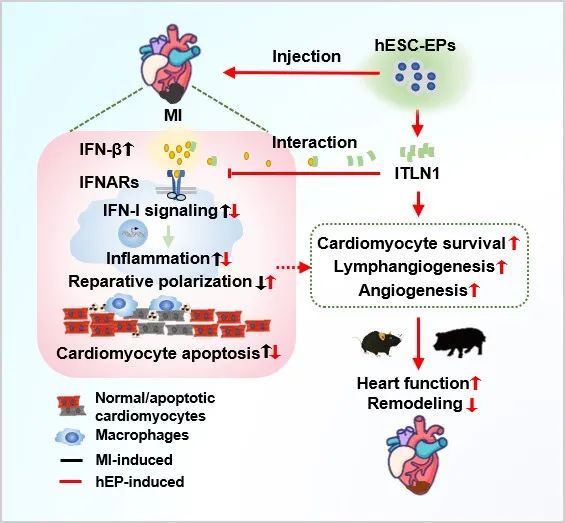
hPSCs源心外膜细胞通过分泌的内凝集蛋白调控炎症反应、促进梗死心肌修复的模式图
杨黄恬研究组博士研究生罗小玲和江芸为该论文共同第一作者,中国科学院上海营养与健康研究所杨黄恬研究员和同济大学附属东方医院高崚研究员为该论文通讯作者。该工作得到科技部国家重点研发计划、中国科学院战略性先导科技专项、国家自然科学基金和上海高校高峰学科(第四类)基金的资助;并获得中国科学院上海营养与健康研究所所级中心公共技术平台和上海市东方医院医学影像科戴工华老师的帮助及论文回修时中国医科院阜外医院王利教授的帮助。
原文链接:
https://doi.org/10.1002/advs.202300470


