Hepatology:究竟是哪个因素促进了HCC的转移?
时间:2023-05-08 10:27:03 热度:37.1℃ 作者:网络

肝细胞癌(HCC)是全球癌症相关死亡的第三大常见原因。早期单发肿瘤的HCC患者可进行手术切除,并表现出最长的生存率。然而,大多数HCC病例诊断时已为无法切除的中晚期,此时疾病已经发展成多结节肿瘤,并伴有血管侵犯和肝外扩散。这种循序渐进的疾病进展和相应的治疗方案与患者出现疾病转移性扩散的可能性密切相关。尽管近年来临床上针对晚期HCCs的治疗方案已大大扩展,但患者的生存获益仍然不大。残留或扩散的转移细胞的高复发率是实现患者更好的生存获益结果的主要未克服的挑战。
众所周知,转移是决定癌症患者生存率的主要因素。肿瘤细胞从原发部位到继发部位的定植过程中存在一些瓶颈,导致一小部分传播的细胞能够在继发部位成功引发肿瘤。调节细胞外基质(ECM)、重新排列细胞骨架、代谢可塑性和癌症干性的能力是直接导致其转移成功率的关键细胞内在属性。由于缺乏针对这一现象的有效疗法,因此需要对这一过程中的调节因素有更好的临床相关的机理理解。调查HCC细胞的晚期肿瘤阶段和较高的转移潜力之间的联系可以提供有用和可操作的见解。
近日,发表在Hepatology杂志的研究探讨了MID1IP1作为HCC中攻击性表型的关键诱导因子的促肿瘤作用,并为这些细胞表型提供了机制上的解释。
利用患者HCCs的全转录组测序,研究发现并验证了中线1相互作用蛋白1(MID1IP1)是转移性HCCs中最显著上调的基因之一,并表明了其在HCC转移中的潜在作用。临床病理相关性表明,MID1IP1的上调与更具侵略性的肿瘤表型和较差的患者总生存率明显相关。在功能上,MID1IP1的过表达明显促进了HCC细胞的迁移和侵袭能力,增强了肿瘤形成能力和癌症干性相关基因的表达,而它的稳定敲除则取消了这些影响。扰乱MID1IP1后,在正位肝脏注射小鼠模型中肿瘤明显缩小、肺转移减少、在体内尾静脉注射模型中肺转移减少。在机制上,发现SP1转录因子是MID1IP1转录的上游驱动因素。此外,对MID1IP1表达的HCC细胞进行转录组测序,发现FOS like 1 (FRA1)是MID1IP1的一个关键下游媒介。MID1IP1上调FRA1,随后促进其转录活性和基质金属蛋白酶MMP9的细胞外基质降解活性,而敲除FRA1则有效废除了MID1IP1诱导的迁移和侵袭能力。
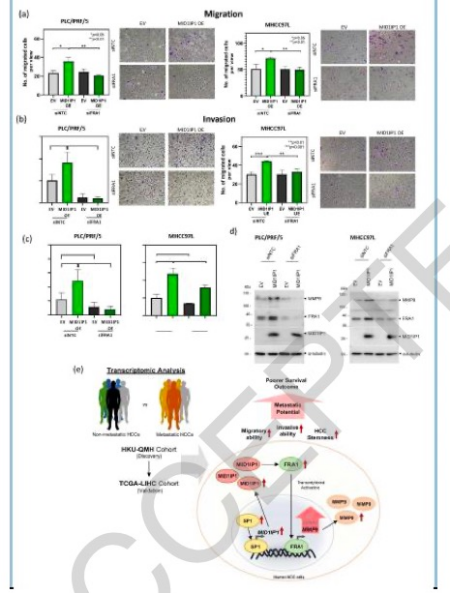
图 FRA1介导MID1IP1诱导的HCC迁移和侵袭能力以及MMP9的表达。在PLC/PRF/5和MHCC97L细胞中过量表达MID1IP1并敲除或不敲除FRA1后,HCC细胞的(a)迁移能力和(b)侵袭能力的相对变化,分别通过转孔迁移和侵袭试验。通过RT-PCR和Western blot,MID1IP1 OE MHCC97L和PLC/PRF/5细胞中MMP9的相对(c)mRNA和(d)蛋白表达(n=3,数据显示为±S.D)。(e) 研究结果的图表总结:MID1IP1经常在人类HCCs中过量表达,并在几种促进肿瘤的功能表型中起着贡献作用。其通过促进FRA1介导的MMP9通路来驱动癌症转移,导致HCC细胞具有更高的迁移性和侵袭性,从而使患者的生存率降低(*p<0.05,**p<0.01,***p<0.001,t检验)
本项研究发现,MID1IP1是促进FRA1介导的MMP9信号传导的调节器,并证明了其在HCC转移中的作用。因此,靶向MID1IP1介导的FRA1通路可作为一种潜在的治疗策略来对抗HCC的进展。
原文出处:
Yung-Tuen Chiu,Abdullah Husain,Karen Man-Fong Sze,et al.Mid-line 1 interacting protein 1 promotes cancer metastasis via FOS like 1-mediated matrix metalloproteinase 9 signaling in HCC.DOI:10.1097/HEP.0000000000000266


