专家论坛|李荣宽:非酒精性脂肪性肝病的诊断与评估
时间:2023-08-28 14:46:08 热度:37.1℃ 作者:网络
非酒精性脂肪性肝病(NAFLD)影响全球约25%的人口,近年来已超过病毒性肝炎,成为慢性肝病的主要病因[1]。随着肥胖和代谢综合征(MetS)的流行,NAFLD已成为我国健康体检肝生物化学指标异常的首要原因[2]。NAFLD包括一系列病理学特征:从在肝细胞质中异位积聚甘油三酯(即肝脂肪变性),形成炎症和肝细胞损伤[即非酒精性脂肪性肝炎(NASH)],到进行性纤维化并发展为肝硬化、终末期肝病或HCC。NAFLD的发生与2型糖尿病(T2DM)密切相关,也与动脉硬化性心血管疾病和慢性肾脏疾病相关联。肝脂肪变性是诊断NAFLD的先决条件,而肝活检是诊断肝脂肪变性的“金标准”。此外,肝组织病理还能够评估NASH的存在与否,伴或不伴有进展期肝纤维化。然而,肝活检取样仅占器官体积的约1/50 000,并且有其固有的局限性,如成本、因样本采集不足导致的取样错误、样本的错误处置、观察者的差异和不良事件风险,使其不适合进行大规模的筛查[3]。因此,在NAFLD患者的管理中,简单、易获取且经过验证的非侵入性测试是非常必要的。肝纤维化是NAFLD患者死亡的独立预测因子[4],因此准确的纤维化分期以及诊断早期纤维化的能力对于NAFLD的早期诊断至关重要。本文对NAFLD的诊断及评估等多个方面研究进展进行全面综述。
1对“非酒精性”的理解
NAFLD的诊断需要排除饮酒及肝脂肪变性或脂肪性肝炎的所有其他病因。首先,为了区别NAFLD和AFLD,患者要无过量饮酒史,即男性饮酒折合乙醇量 < 30 g/d,女性 < 20 g/d[5]。其次要排除所有已知的可导致脂肪肝的慢性肝病,如病毒性肝炎(尤其是基因3型丙型肝炎)、肝豆状核变性、血色素沉着症、自身免疫性肝炎。最后需要排除所有导致肝脂肪变性的继发原因,如药物因素(包括他莫昔芬、胺碘酮、糖皮质激素、合成雌激素、甲氨蝶呤、抗病毒药物等)、代谢或遗传因素(包括β脂蛋白缺乏血症、溶酶体酸性脂肪酶缺乏症、脂肪代谢障碍、Weber-Christian综合征等)、营养因素(营养不良、吸收不良、全胃肠外营养、快速减重、空肠回肠旁路术后等)及其他特殊情况(如小肠憩室、石化产品暴露、有机溶剂暴露等)[6]。
然而,“非酒精性”的真实意义在于NAFLD与MetS和胰岛素抵抗密切相关。因此,所有具有一种或多种MetS(包括腹围增加、T2DM、高甘油三酯血症、低高密度脂蛋白血症及高血压)的个体都应警惕NAFLD。但这个规律并不适用于由于PAPLA3基因突变导致的NAFLD[7]。“NAFLD”过度强调酒精滥用,忽视了代谢功能障碍在该疾病中的重要性。2020年,Eslam等[8]提出了对脂肪肝新的、全面重新定义,建议将NAFLD重新命名为代谢相关性脂肪性肝病(MAFLD)。这个命名强调了肥胖、胰岛素抵抗、血脂异常、T2DM和全身炎症在脂肪肝发生和发展中的重要作用。NAFLD和MAFLD都要求存在肝脂肪变性,但NAFLD的诊断是要排除酒精性和其他肝脏疾病,而MAFLD是一种相对积极的诊断,基于超重/肥胖或存在T2DM,或存在两种及以上代谢风险因素。
2肝脂肪变的诊断与评估
NAFLD无论病因如何,都是由于肝脂肪沉积,也称为脂肪变性。因此检测肝脂肪变性是否存在是诊断NAFLD的第一步。病理学上用于量化肝脂肪含量的传统组织病理学方法是一种视觉半定量方法,常用的分级方法是四级量表法(0~3)。0~3级分别对应 < 5%、5%~33%、34%~66%和>66%的肝细胞中的脂肪沉积[9]。但由于肝活检的局限性,非侵入性测试(NIT)在临床上的意义愈发重要。
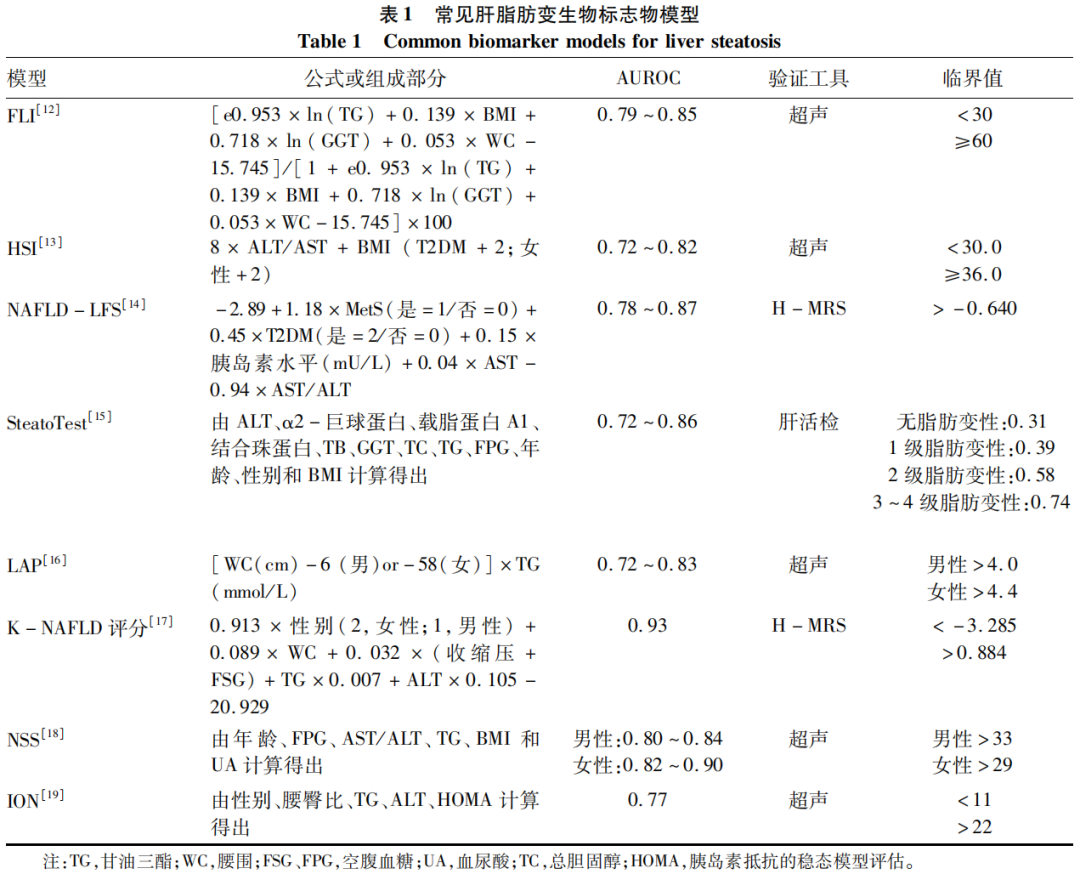
目前,最常见的基于血清的脂肪变性生物标志物是ALT和GGT。长期以来,ALT一直被用作肝脂肪变性的标志物,但其敏感度和特异度均较低[10]。NAFLD患者的GGT通常升高,有研究[11]结果表明,其与纤维化晚期和死亡率的增加有关,然而仅凭借GGT水平无法确定肝脂肪变性的程度。由于单一因素对肝脂肪变性的评估准确性较差,目前出现了较多的基于血清的生物标志物组合,包括脂肪肝指数(FLI)[12]、肝脂肪变性指数(HSI)[13]、NAFLD肝脂肪评分(NAFLD-LFS)[14]、SteatoTest[15]、脂质积聚产物评分(LAP)[16]、K-NAFLD评分[17]、NAFL筛查评分(NSS)[18]和NASH指数(ION)[19](具体计算公式及诊断性能见表1)。这些模型可以在识别肝脂肪变性或心血管及代谢危险因素方面发挥作用,但目前上述指标均不能用于NAFLD的临床诊断或NAFLD患者预后管理,哪种算法可以被推荐作为NAFLD筛查的初始工具尚需进一步研究[20]。
由于基于血清生物标志物的局限性,肝脂肪变性的诊断还应结合影像学方法。超声检查因其易操作性及价格低廉被广泛用于肝脂肪变性的首选检查。超声通过评估肝肾对比度、肝实质回声强度、声束衰减、血管壁回声强度和胆囊壁清晰度等来诊断肝脂肪变性[21]。欧洲肝病学会[21]提出超声被推荐用于筛查T2DM患者的肝脂肪变性。然而,超声的局限性在于对轻度(< 20%)肝脂肪变性的敏感性有限,且对肝脂肪变的评估受严重纤维化的影响[22]。受控衰减参数(CAP)是一种通过超声瞬时弹性成像平台定量检测肝脏脂肪变性的新方法,为肝脂肪的常规筛查提供了便利。有研究[23]结果表明,CAP技术对NAFLD及酒精性肝病患者均具有诊断价值,能够检出5%以上的肝脂肪变,准确区分轻度肝脂肪变与中-重度肝脂肪变。一项包含2 375例NAFLD患者的荟萃分析[24]将CAP与肝组织学的脂肪变性结果进行了比较研究,结果显示,脂肪变性>11%时AUROC为0.82,CAP临界值为248 dB/m;脂肪变性>33%时AUROC为0.86,CAP临界值为268 dB/m;脂肪变性>66%时AUROC为0.89,CAP临界值为280 dB/m。但CAP的缺点是检测失败率高(0~24%),尤其是在肥胖患者中。为了克服这一缺点,FibroScan对于肥胖患者不再使用传统的M探头,而改用专门设计的XL探头[25]。
基于MR的技术已被广泛验证可以作为肝脂肪变性的定量工具。其中MRI的生物标志物质子密度脂肪分数(PDFF)被公认为是肝脂肪变性的非侵入性参考标准,并有可能取代肝活检。该生物标志物能够测量脂肪的可移动质子的相对比例,并与肝脏甘油三酯浓度密切相关。PDFF在脂肪变性的诊断、分级和纵向监测方面显示出很高的准确性[26]。目前有两种主要的基于MR的肝脂肪定量技术:质子磁共振波谱(H-MRS)和多回波Dixon MRI。有研究[27]表明,与组织学结果相对照,MRS对于肝脂肪变性的诊断具有较高的准确性(检测≥1级脂肪变性时AUROC为0.97~0.99)。然而,MRS也具有局限性,仅对肝脏的小部分进行脂肪定量导致了采样的不确定性,且由于复杂及高难度的操作和需要后续进行结果分析限制了其广泛使用。多回波Dixon技术则可以精确地区分来自水和脂肪的信号,并可通过计算PDFF来获得整个肝脏的脂肪信号分布图[28]。然而,关于纤维化对PDFF测定肝脂肪变性的准确性有无影响仍存在争议,尚需进一步研究。
3脂肪性肝炎的诊断与评估
与非酒精性单纯性脂肪肝相比,NASH患者中肝纤维化、肝硬化、肝癌的发生率明显增高。因此,对NASH的早期诊断并进行干预至关重要。但是,现有的影像学技术和实验室检查等无创方法均不能准确诊断NASH。因此,目前肝活检仍然是诊断NASH的“金标准”,其病理表现包括脂肪变性聚集、肝细胞气球样变和小叶炎症,病变主要位于肝小叶第三区[29]。目前的半定量分级及分期系统主要包括美国NASH临床研究协作网公布的NAS积分和欧洲脂肪肝协作组提出的SAF积分。NAS积分是目前大多数有关NASH研究所依据的标准,分为0~8分,在脂肪变性、气球样变和小叶炎症三类中得到1分或更高即可诊断为NASH[30]。而SAF积分是一种涵盖了脂肪变性、活性、纤维化的评分系统,可以使用脂肪肝抑制进展算法对肥胖导致的肝损伤进行分类。有研究[31]表明,该评分法相比NAS积分更能提高病理诊断的一致性。虽然肝活检有其固有的局限性,而且病理学家对NASH病理的特征及定义仍有一定的争议,但其对于病情的判断以及疗效评估的作用是无法替代的。2018年由中华医学会肝病学分会脂肪肝和酒精性肝病学组制定的《非酒精性脂肪性肝病防治指南》[2]中对于肝活检的推荐意见如下:合并MetS、T2DM、血清氨基酸转移酶和/或CK-18持续增高的NAFLD患者是NASH的高危人群,建议通过肝活组织检查明确诊断。
早期发现NASH有利于预防NASH相关纤维化,因此除了行肝活检,目前也在积极探索、尝试应用NIT来对NASH行早期筛查。细胞角蛋白-18(CK18)是一种中间丝蛋白,是被研究较多的、诊断NASH的生物标志物之一。CK18在细胞调亡时被切割为CK18 M30和CK18 M65两个片段。有研究[32]通过检测CK18在评估不同纤维化阶段NASH的准确性差异验证CK18可能预测NASH患者疾病的严重程度。一些炎症标志物,如CXCL10、TNF-α和IL-8在区分NASH与单纯性脂肪变性和非NASH方面表现出中等的诊断效能[33-34]。肝脏分泌的成纤维细胞生长因子21(FGF21)是NASH的另一个潜在生物标志物。一项研究[32]结果显示,FGF21的AUROC为0.62,126 pg/mL和578 pg/mL的两个临界值对排除及诊断NASH的敏感度和特异度均大于90%,且FGF21与CK18联合使用能够进一步提高其阳性及阴性预测值。脂肪细胞因子可能是诊断NASH的潜在标志物,包括脂联素、瘦素和抵抗素等[35]。
目前的研究[36]结果表明,应用常规影像技术(超声、CT或MRI)对NASH和单纯性脂肪变性进行鉴别是非常困难的。磁共振弹性成像(MRE)是一种非侵入性定量检测软组织弹性及结构的影像检查手段。该研究[36]结果显示,MRE诊断NASH的临界值为2.74 kPa,AUROC为0.93。有研究[37]发现,通过MRI信号衰减值测量的肝脏铁积聚与NAFLD疾病的严重程度以及纤维化进展显著相关,基于MRI的肝脏铁积聚评估NASH的AUROC为0.91,敏感度为83%,特异度为80%。
近年来,作为NAFLD新兴的、非侵入性生物标志物,非编码RNA得到越来越多的关注。非编码RNA的异常表达与NAFLD相关。其中miRNA在NAFLD中的作用相关研究较多。miR-122、miR-34、miR-192和miR-375在NAFLD中表达上调,并与疾病严重程度呈正相关[38]。最显著的变化出现在miR-122上,miR-122是最丰富的肝脏特异性miRNA(占肝脏miRNA总量的70%以上),被认为是NAFLD(尤其是NASH)的潜在生物标志物。有研究[38]表明,miR-122在NAFLD患者血清中显著升高,肝脏miR-122水平与组织学的严重程度呈正相关。
4脂肪性肝纤维化、肝硬化的诊断与评估
检测NAFLD患者的肝纤维化及肝硬化具有重要的临床意义。晚期肝纤维化(F3~F4)可独立预测肝脏相关并发症的发生、肝移植的需求以及肝脏相关病死率[4]。晚期肝纤维化还与慢性肾脏病的高发病率和血管相关疾病病死率增加相关。肝活检仍然是检测肝纤维化及肝硬化最准确的手段。1991年Knodell等提出了最初的半定量评分系统,该系统将分级和分期的结果综合描述在病理报告中。随后的评分系统将分级和分期分别进行计分,包括朔伊尔评分系统、Batts-Ludwig评分系统、METAVIR评分系统以及Ishak评分系统等[39]。目前临床上最常用的是METAVIR评分系统,其将肝纤维化分为0~4期,即F0~F4:F0为无纤维化;F1为肝门束扩大,但未形成间隔;F2为肝门束扩大,少量间隔形成;F3为广泛形成间隔,无肝硬化;F4为肝硬化期[40]。
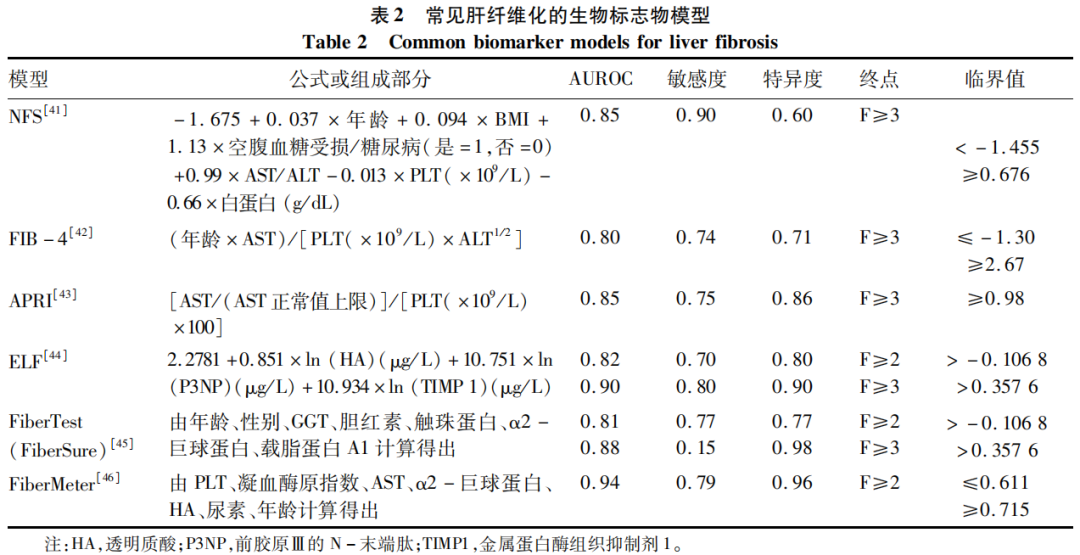
用于评估纤维化阶段的NIT在NAFLD患者的管理中发挥越来越重要的作用。表2列出了目前常见的非侵入性血清生物标志物模型。FIB-4和NAFLD纤维化评分(NFS)是使用最广泛的算法[41-42],这两种算法都具有较高的阴性预测值。APRI评分被推荐作为晚期肝纤维化的另一个标志物,其在评估NAFLD患者肝纤维化分期方面的准确性已在许多研究中得到证实[44]。一些生物标志物面板,如增强型肝纤维化(ELF)测试[44]、FiberTest(FiberSure)[45]和FiberMeter[46]也被应用于临床。ELF包括3个直接的纤维化标志物,除了区分晚期纤维化患者外,还可以很好地预测肝脏相关的发病率和死亡率。因此,在FIB-4和NFS提示晚期纤维化的患者中,可考虑进行该试验[44]。
近年来,影像学技术的进展显著提高了肝纤维化的无创评估能力。基于FibroScan的振动控制瞬时弹性成像(VCTE)使用脉冲回波超声测量通过肝实质剪切波的速度,以获得作为肝纤维化标志的肝硬度测量。VCTE的结果至少需要10次测量,测量的肝组织区域约为1 cm(直径)×4 cm(长度),约为肝活检的100倍[47]。肝硬度测量值< 8 kPa可以大概率排除晚期纤维化[48],有助于确定哪些患者需要行肝活检。但是至今仍无公认的阈值用于确诊肝硬化[49]。声脉冲辐射力成像技术(ARFI)是基于超声的弹性成像方法,能够定量评估组织硬度。与VCTE类似,有研究[50]表明,ARFI对晚期肝纤维化具有良好的诊断效能,平均AUROC为0.84~0.87,对肝硬化诊断的平均AUROC为0.91~0.94。此外,与VCTE不同,ARFI的诊断效能通常不受肥胖或血管或胆道等干扰结构的限制。然而,ARFI的缺点是取样体积大小<VCTE,并且对质量标准的评估较少。二维剪切波超声弹性成像技术是近些年问世的超声弹性成像新技术,其原理是声辐射力作用于多个点位移组织,用于实时检测剪切波在图像多个点的传播。有研究[51]表明,二维剪切波超声弹性成像技术对于NAFLD肝纤维化晚期的诊断效能与VCTE相近。
MRE可以使用现有的MRI描仪进行。MRE通常在肝脏最宽的位置放置厚度为5~10 mm的4个轴向或横向的切片,通常相当于肝总体积的5%~35%。通过在生成的弹性图上绘制感兴趣区域,避免边缘效应、大血管、胆囊窝以及受心脏和血管伪影影响的任何区域,从而获得肝脏硬度。有研究[52]结果表明,MRE在诊断NAFLD患者的肝纤维化、预测晚期肝纤维化和肝硬化方面具有较高的准确性,AUROC值>0.90。然而,与VCTE不同,因其需要MRI设备,成本高且耗时,因而无法做到大规模检测。
最近一项研究[53]发现,血清miR-193a-5p的水平与NAFLD活性评分和纤维化程度密切相关,提示miR-193a-5p是进展性NAFLD潜在的临床生物标志物。另有一项研究[54]使用基于肠道微生物群方法与VCTE、NFS和FIB-4联合预测83例经肝活检证实的NAFLD患者的晚期肝纤维化。该项由临床特征和肠道菌群组合的随机森林模型对晚期肝纤维化诊断的AUROC为0.87,与NFS和FIB-4相似,但低于VCTE。
5危险因素评估
NAFLD的危险因素包括肥胖、MetS、高血压、血脂异常、T2DM和慢性肾脏疾病等。疑似NAFLD的患者需要全面评估人体指标和血清糖脂代谢指标及其变化。肥胖被认为是NAFLD的主要危险因素。然而,一定比例的NAFLD患者BMI正常,即存在瘦型或非肥胖型NAFLD,全球患病率在5%~26%,由于缺乏明显的危险因素,使诊断难度大大增加[55]。一般而言,与健康个体相比,瘦型NAFLD患者的代谢已经发生了异常改变,甘油三酯和胰岛素抵抗(IR)水平较高,但与肥胖型NAFLD患者相比,MetS的患病率较低[1]。即使瘦型NAFLD个体可能仅出现中度代谢的异常改变,其也有发展为NASH和晚期纤维化的风险。人体成分测定有助于发现常见于“瘦人”的隐性肥胖(体脂含量和/或体脂占体质量百分比增加)和肌少症[2]。MetS有多种定义,但公认的表现是腰围增加、高血糖、血脂异常和系统性高血压。NAFLD和MetS表现之间的关联通常是双向的,尤其在糖尿病和高血压方面,MetS会增加NAFLD的风险,而NAFLD或NASH治疗也会改善MetS的一些表现。
T2DM与NAFLD的进展密切相关,事实上,超过50%的T2DM患者患有NAFLD[56]。糖尿病不仅是NAFLD的常见合并症,也是NAFLD向NASH发展的决定因素之一,进一步可发展为肝硬化及HCC。与MetS一样,T2DM患者易患NAFLD,反之亦然。另一方面,IR被认为是导致NAFLD和T2DM发展的关键发病机制之一,随着疾病进展而恶化。在肝脏中,IR的特征是糖异生增加和肝糖原合成减少[57]。因此,NAFLD患者也有更高的糖尿病发病风险。HOMA-IR是用于评价群体IR水平的指标,计算方法如下: 空腹血糖水平(FPG,mmol/L)×空腹血胰岛素水平(FINS,mIU/L)/22.5,正常成人HOMA-IR指数大约为1[2]。
近年来,基于遗传学、代谢组学及肠道微生物组对NAFLD进展的研究越来越多。其中对NAFLD的发展和进展影响最显著的风险变体是PNPLA3,有研究[7]表明,其与NAFLD纤维化进展、HCC发展、ESLD和全因死亡率相关。TM6SF2也与NAFLD的进展相关。在NAFLD患者中,TM6SF2 E167K变体与显著纤维化(F2~F4)密切相关[58]。有研究[59]结果表明,肠道微生物群能够影响肝脏的碳水化合物和脂质代谢,也影响促炎和抗炎之间的平衡,能够直接影响NAFLD及其进展为NASH。
6展望
NAFLD是一个日益严重的全球健康问题。NAFLD的早期诊断及对危险因素准确评估对阻止NAFLD进展到晚期肝纤维化、肝硬化及HCC至关重要。目前NAFLD诊断的金标准仍为肝脏病理,但因其固有的局限性难以广泛推广,越来越多的NIT被用于NAFLD各阶段的诊断。除了传统的血清学生物标志物及各种影像学方法,出现了诸多基于遗传学、表观遗传学、代谢及肠道微生物的新兴生物标志物,但是相对于组织学其准确度依旧欠佳。NAFLD是一种复杂的疾病,涉及多个器官和多种机制。相信随着对NAFLD发病机制的进一步研究,将会有更多新的无创、精确、简便的诊断方法问世,使NAFLD的诊断及评估更为精准。
全文下载
http://www.lcgdbzz.org/cn/article/doi/10.3969/j.issn.1001-5256.2023.08.003
引证本文
张馨元, 刘宇, 王文玲, 等. 非酒精性脂肪性肝病的诊断与评估[J]. 临床肝胆病杂志, 2023, 39(8): 1780-1788


