最新进展 | 小分子药RRx-001延长脑胶质瘤患者生存 I期临床试验结果公布
时间:2023-09-06 16:54:02 热度:37.1℃ 作者:网络
【编译者按】
目前针对新诊断胶质母细胞瘤(GBM)的标准治疗方案是最大安全范围内手术切除,随后联合使用替莫唑胺(TMZ)和放射治疗(RT),然后进行6到12周期的替莫唑胺维持治疗。

本研究所使用的RRx-001是一种能够穿透血脑屏障的小分子,它作为一种NLRP3抑制剂,同时能在在缺氧条件下产生一氧化氮使肿瘤相关巨噬细胞极化,并使肿瘤血管正常化。
该分子已获得FDA批准用于头颈部癌症治疗,目前正在进行小细胞肺癌(SCLC)的III期临床试验。本试验G-FORCE-1 (NCT02871843)作为一项多中心剂量递增的I期临床研究,首次评估了RRx-001作为GBM标准治疗的附加治疗的作用。
本研究确定了在替莫唑胺维持治疗期间,给予每周一次RRx-001 4mg的治疗剂量,具有较好的安全性和耐受性,同时观察到了初步的治疗活性;这为将来II期临床试验提供了剂量依据。该研究首次在GBM中评估了NLRP3抑制剂RRx-001的治疗相关作用。这一试验为GBM患者的生存改善提供了新的思路,展现出了目前肿瘤治疗场(TTF)等方案所不具备的便捷性以及高依存性,具有较好的研究前景。
研究方法
患者纳入:
年龄大于等于18岁,新诊断为高级别胶质母细胞瘤,没有同期进行其他治疗;Karnofsky评分大于等于70,血液相关检查及肝肾功能良好。
研究设计:
G-FORCE-1 (NCT02871843)作为一项多中心剂量递增的I期临床研究,共分为两个部分。
第一部分(队列1~4):前6周内接受30次放射治疗(总剂量60Gy) + 替莫唑胺75 mg/m2 qd,同时每周服用1次RRx-001(根据3+3设计,剂量从0.5 mg增加到4 mg),随后停药6周,再进行标准替莫唑胺维持治疗(第一周期150 mg/m2,随后周期为200 mg/m2),直至疾病进展。
第二部分(队列5~6):前6周内接受30次放射治疗(总剂量60Gy) + 替莫唑胺75 mg/m2 qd + RRx-001 4mg qw,随后停药6周,再根据3+3设计分别进行下列2种不同的维持治疗方案,直至治疗6个疗程或者疾病进展:1)RRx-001 0.5 mg qw + TMZ 100 mg/m2 qd×5d/week;2)RRx-001 4 mg qw + TMZ 100 mg/m2 qd×5d/week。
患者评估和随访
所有患者在基线状态下接受必要的实验室及影像学检查,使用MRI(首选)或CT进行肿瘤成像,并从临床记录中获取MGMT启动子甲基化状态和IDH突变状态。在放射治疗期间及治疗维持阶段,每周评估患者的不良事件,并进行完整的血细胞计数和血液化学分析。
大约在放疗完成后4周进行重复肿瘤成像检查,然后每8周进行一次,直到肿瘤进展。研究使用改良的RANO标准评估疗效,根据该标准,疾病进展定义为肿瘤大小增加至少25%或出现新病灶。
试验终点:
主要终点:RRx-001、TMZ和RT联合治疗的推荐剂量/最大耐受剂量。
次要终点:包括总生存期、无进展生存期、客观缓解率、缓解持续时间和临床获益率。
结果
主要分析
截至数据分析时,16名患者中有8名(50.0%)仍然存活,中位随访时间为12.5个月(1.9-28.3),中位总生存期为21.9个月(95%CI: 11.7-NA),总体应答率(ORR)为18.8%(0 CR,3 PR),疾病控制率为68.8%(0 CR, 3 PR, 8 SD),无进展生存期中位数为8.0个月(95%CI: 5.0-NA)(见图1)。
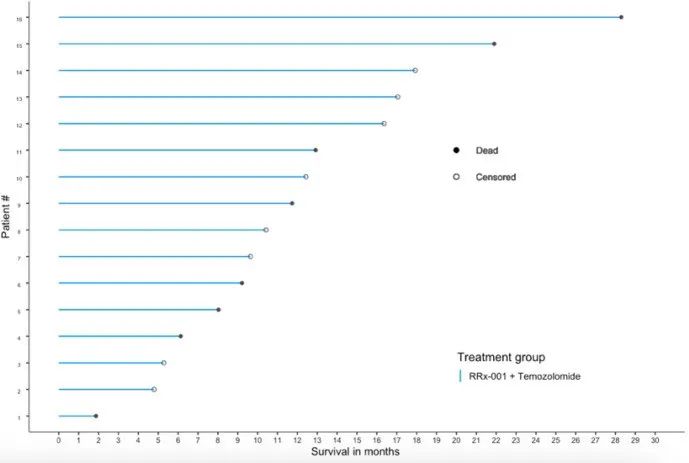
图1 总生存期的泳道图。提示数位患者总生存期得到获益
预后分析:
MGMT状态具有预后意义。对于4例MGMT未甲基化肿瘤的患者,中位总生存期尚未达到,而对于9例甲基化肿瘤的患者,中位总生存期为21.9个月(95%CI:11.7-NA)。MGMT未甲基化肿瘤患者的中位PFS为6.5个月(95%CI:4.6-NA),而甲基化肿瘤患者的中位PFS为8个月(95%CI:8.0-NA)。
IDH类型也具有预后意义。对于IDH野生型的12名患者,总生存期中位数为21.9个月(95%CI:11.7-NA),对于IDH突变型的2名患者,中位生存期为12.9个月。IDH野生型患者的中位PFS为9.0个月(95%CI:8.0-NA,n=12),而IDH突变型患者的中位PFS为8.0个月(n=2)。
此外,10例仅接受TMZ维持治疗的患者OS中位数为21.9个月(95%CI:11.7-NA),中位PFS为8.5个月(95%CI:5.0-NA);6例接受TMZ + RRx-001维持治疗的患者未达到中位OS,中位PFS为8.0个月(95%CI:4.0-NA)。
剂量递增和毒性
截至2019年7月22日,最常见的严重不良事件(SAEs),包括高血糖和癫痫(6.2%,1/16),癫痫(31.2%,5/16),头痛(6.2%,1/16),尿路感染(6.2%,1/16)。作者认为SAEs与服用RRx-001没有关联。3级以上毒性反应的发生率包括血小板减少症(31.2%,5/16)和贫血(6.2%,1/16)。与RRx-001相关的主要不良事件包括输液相关反应(25%)和输液相关疼痛(6.2%)。
此外,RRx-001似乎减轻或减少了在替莫唑胺和放疗治疗期间白细胞和血小板的下降,但未减少红细胞的下降。这可能表明RRx-001在一定程度上保护骨髓,如下图2所示。图2中,垂直虚线代表RRx-001治疗前的界限。
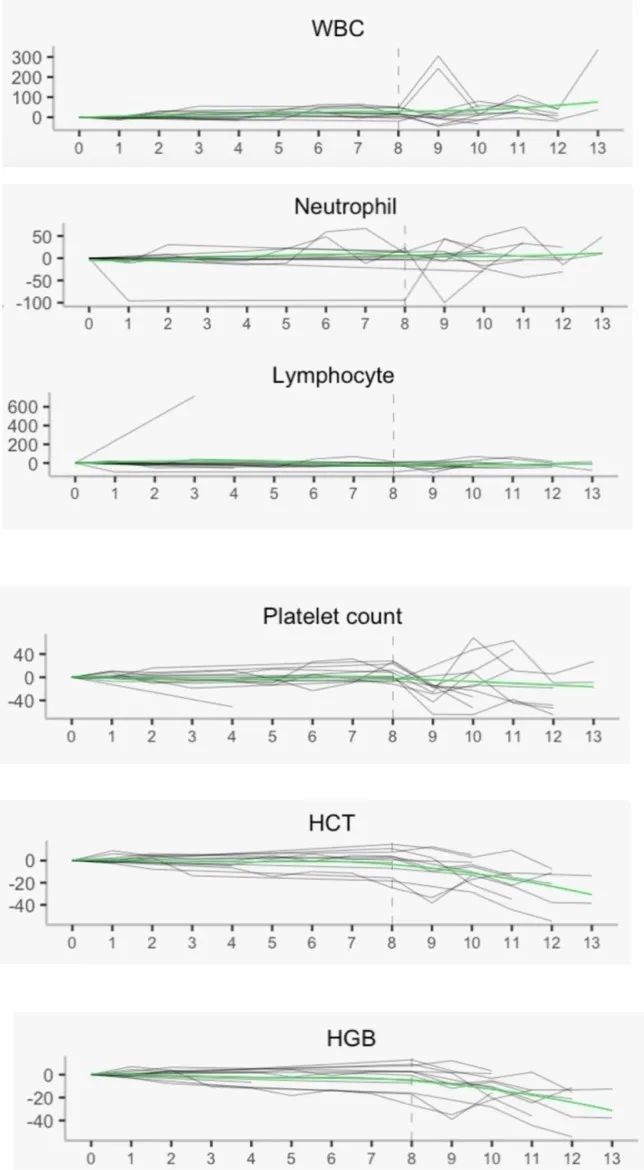
图2 局部回归下的血液学实验测量结果。这些测量结果显示,在RRx-001、替莫唑胺和放疗治疗后,除了血红蛋白和红细胞比例之外,所有参数在所有方面都保持稳定。WBC表示白细胞;HCT表示红细胞比例;HGB表示血红蛋白
小结
在这项G-FORCE-1试验中,RRx-001与放疗和替莫唑胺的联用在整个研究剂量范围内耐受性良好,毒性可接受,我们认为安全性和耐受性的主要目标已经达到。鉴于其充满希望且新颖的作用机制,在胶质母细胞瘤患者中进行II期临床试验中对RRx-001进一步研究具有重要意义。
原文链接:https://www.frontiersin.org/journals/oncology/articles/10.3389/fonc.2023.1176448/full


