Cancer Research:高通量药物筛选为高危肿瘤患儿提供新的治疗策略
时间:2023-09-15 23:03:02 热度:37.1℃ 作者:网络
随着组学技术的快速发展以及生物信息与大数据科学的交叉应用,精准医疗开始在临床应用中发挥作用。当下的大多数精准医疗项目是通过患者肿瘤的分子信息确定其疾病的驱动因素,并以此为基础提供临床建议。
不过既往研究表明,34%~87%的儿童肿瘤依靠分子特征图谱分析发现了驱动因子,这也意味着仍有数量可观的患者无法依靠该手段获取有效的临床建议。
患者来源的体外肿瘤模型,包括原代肿瘤细胞及人源肿瘤异种移植模型(PDX),经证实可准确反应该患者的肿瘤特征。因此,体外肿瘤模型可以在临床治疗决策中发挥作用,确定肿瘤分子特征和药物敏感性之间的关系。
近日,澳洲“零儿童癌症” (Zero Childhood Cancer) 计划组在 Cancer Research 发表了题为 High-Throughput Drug Screening of Primary Tumor Cells Identifies Therapeutic Strategies for Treating Children with High-Risk Cancer 的研究,发布了125例不同癌种患者来源的原代肿瘤模型在体外对126种抗肿瘤药物的应答结果分析。一方面,该工作证实了已知肿瘤驱动因子(如NTRK, BRAF, and ALK)与对应抑制剂之间的药物应答关系,证明该实验方案可靠。同时联合分子分析,鉴定了与WEE1和MEK抑制剂疗效相关的新的标志物;另一方面,研究发现高通量药物筛选检测比分子标记更能反应药物体内反应。值得强调的是,该研究中82%的高通量药物筛选进程在患者临床护理期间完成,意味着实验结果可以有效应用于病患临床指导中。

2017年9月-2022年9月期间,ZERO项目对来自166例患者的169个肿瘤样本进行体外高通量药物筛选试验。其中125个样本成功地进行了药物筛选,涵盖了脑肿瘤、血液系统恶性肿瘤、神经母细胞瘤、肉瘤和其他实体肿瘤等多种儿童肿瘤。该项目中用于高通量药物筛选的肿瘤模型通过以下四种方法获得:
1)将新鲜肿瘤组织解离成活的单细胞直接进行药物筛选;
2)体外扩增解离的肿瘤细胞进行药物筛选;
3)将肿瘤组织在小鼠体内扩增进行药物筛选;
4)肿瘤组织在小鼠体内扩增后再进行解离并体外扩增后获得的肿瘤细胞进行药物筛选。
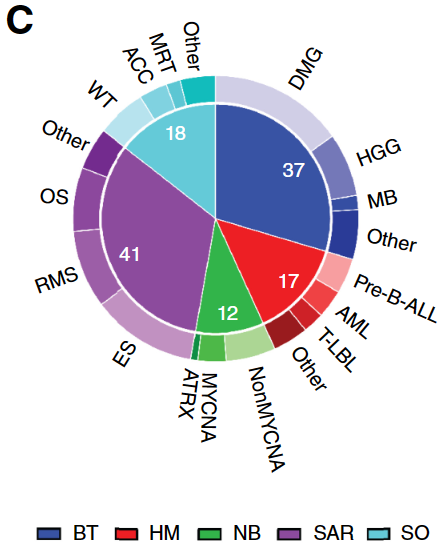
成功完成高通量筛选的肿瘤类型及其亚型分布情况
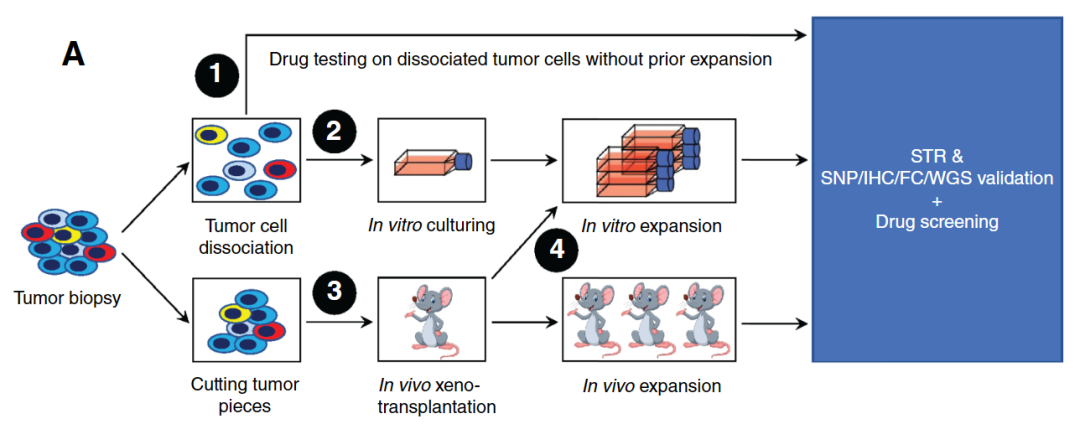
体外高通量药物筛选工作流程
该项研究中提供了大量基于药物敏感程度与肿瘤分子特征图谱联合分析得到的可靠数据,并发现了新的与药物敏感度相关的分子特征,在此不一一赘述。此外,研究结果也提供了仅靠分子特征图谱分析无法准确预测药敏结果的例子,如下面这个例子:
针对PI3K-AKT-mTOR信号通路异常采取相应治疗手段是儿童肿瘤中最常见的操作之一,使得采用mTOR抑制剂成为较常见的治疗方法。实验结果显示,PI3K-AKT-mTOR信号通路抑制剂在125个样本队列中具有不同的药物应答反应,且未与该通路中涉及的基因(PIK3CA, PIK3R1, PTEN, or TSC2)异常情况呈现明显相关性。为了验证这一发现,对含有同一通路不同基因突变的骨肉瘤患者(TSC2突变)和尤文氏肉瘤患者(PIK3CA突变)进行mTORC1抑制剂替西罗莫司的治疗实验比较。一方面,收集患者肿瘤组织植入小鼠中进行模型实验,结果显示替西莫司治疗显著改善了移植尤文氏肉瘤小鼠的无事件生存率。同时,患者本人也呈现一致治疗结果,骨肉瘤患者病情进展,尤文氏肉瘤患者部分缓解。以上结果表明,仅靠分子水平上对致癌基因的分析并不总是足以预测所有靶向药物反应,高通量药物筛选或可为肿瘤精准治疗提供新的策略。
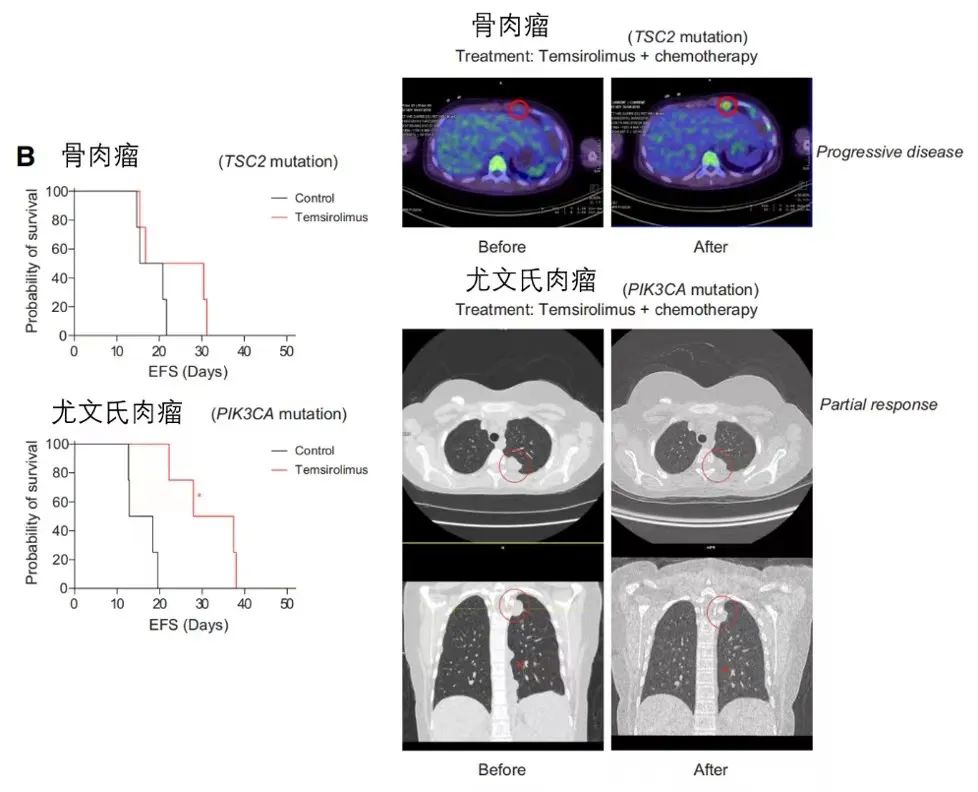
替西罗莫司对同一信号通路基因突变的不同肿瘤展现出不同的治疗效果(左,小鼠模型;右,患者)
这项研究结果展示了高通量药物筛选纳入精准医疗项目的研究价值,为高风险儿童癌症患者的治疗提供了更多的方案。重要的是,依赖高效可行的实验方案,当患者正在接受临床治疗时,即可进行参考。此外,该研究结果探索并整合了抗癌药物和肿瘤分子特征图谱之间的相互作用,推动了精准治疗的的发展。
DOI: 10.1158/0008-5472.CAN-22-3702.


