成人呼吸道感染病原诊断核酸检测技术临床应用专家共识(2023)
时间:2023-09-16 20:04:23 热度:37.1℃ 作者:网络
呼吸道感染性疾病是临床常见疾病类型,可分为上呼吸道感染和下呼吸道感染。上呼吸道感染主要累及鼻腔、咽/喉部等,而下呼吸道感染多为喉以下的气管/支气管感染及肺部感染[1]。
世界卫生组织(WHO)发布的2019年全球前10位死亡原因中,下呼吸道感染居第4位,全年导致260万人死亡;且在低、中、中高和高收入国家中,下呼吸道感染是唯一一类均位列前10位死亡原因的感染性疾病[2]。
病原体的快速检测和准确诊断是感染性疾病有效治疗的重要前提,但仅依靠传统微生物学及免疫学技术,近70%的患者无法明确病原学诊断[3]。
近年来,随着病原体单靶标聚合酶链反应(PCR)、以症候群为基础的病原体多重PCR技术、微流控芯片技术、数字PCR技术、宏基因组高通量测序(mNGS)技术以及多重病原靶向测序(tNGS)技术的应用,大幅提高了呼吸道感染性疾病的病原诊断能力,在病原体致病因子、耐药基因检测等方面也取得了重要进展[3-5]。
基于以上原因,中华检验医学培训工程专家委员会联合中华医学会呼吸病学分会,邀请我国呼吸、感染、临床微生物检验和分子检验等领域专家,共同制定了《成人呼吸道感染病原诊断核酸检测技术临床应用专家共识(2023)》。
该共识对不同分子诊断技术的特点和适用范围,以及该类技术在不同类型成人呼吸道感染疾病中的应用策略给出了明确推荐意见,以期更好地指导临床实践。

1 共识形成方法
共识专家组由中华检验医学培训工程专家委员会和中华医学会呼吸病学分会委员推荐产生。2021年12月召开共识启动会,就共识关键性问题拟定提纲及任务分工,组建共识执笔组、撰写专家组、评审专家组。
共识执笔组以“呼吸道感染(respira-tory tract infection)”“分子检测(molecular testing)”“分子诊断技术(molecular diagnostic tests)” 为关键词,检索PubMed、中国知网、万方数据知识服务平台和维普数据库中的中、 英文文献,经去重及阅读文献摘要和/或全文,共纳入55篇文献,形成共识初稿。
2022年9月和2023年2月连续召开2次会议,由执笔人和撰写专家组成员围绕共识初稿展开2轮讨论、提出修订意见并形成共识草案。随后以函审的形式发给评审专家组征求意见,共收到函审意见41条,合并重复意见后采纳其中30条。
最终由撰写组和评审专家组成员共计85人对共识核心意见进行共识度无记名投票,投票等级分为:a)完全同意;b)基本同意;c)不确定;d)不太同意;e)完全不同意。
若a、b、c、d中任一项票数超过50%,或a+b、d+e票数超过70%,即视为达成共识;其余情况均视为未达成共识,相关意见进入下一轮投票。以a+b或d+e得票数占回收有效票数的百分比,作为共识意见的专家共识度[6]。
经过两轮德尔菲法,最终形成了15条核心推荐意见,见表1。
表1 《成人呼吸道感染病原诊断核酸检测技术临床应用专家共识(2023)》核心推荐意见

2 呼吸道病原体核酸检测方法
分子诊断技术在呼吸道感染性疾病,尤其是在全球应对新型冠状病毒大流行中发挥了重要作用,高灵敏度和高特异度的核酸扩增试验(NAATs)已成为诊断新型冠状病毒感染的参考标准。
随着基因组学、工程学和纳米科学等前沿学科的交叉融合快速发展,NAATs呈现出多种多样的检测方法和日新月异的技术手段,以PCR为基础的实时荧光PCR、多重PCR、数字PCR和等温扩增技术,以及高通量测序、基因芯片、核酸质谱、生物传感器等检测技术,在大型实验室批量检测或现场核酸即时检测(POCT)中得以广泛应用。
除呼吸道病毒外,一些技术还能检测细菌性肺炎的常见病原体及特定耐药基因。面对诸多检测方法,临床医生和微生物实验室需审慎判断何时选择何种方法或不同方法的组合,其决定因素包括流行病学、实验室资源、工作流程和检测成本等(表2)。
表2 呼吸道病原体核酸检测技术比较
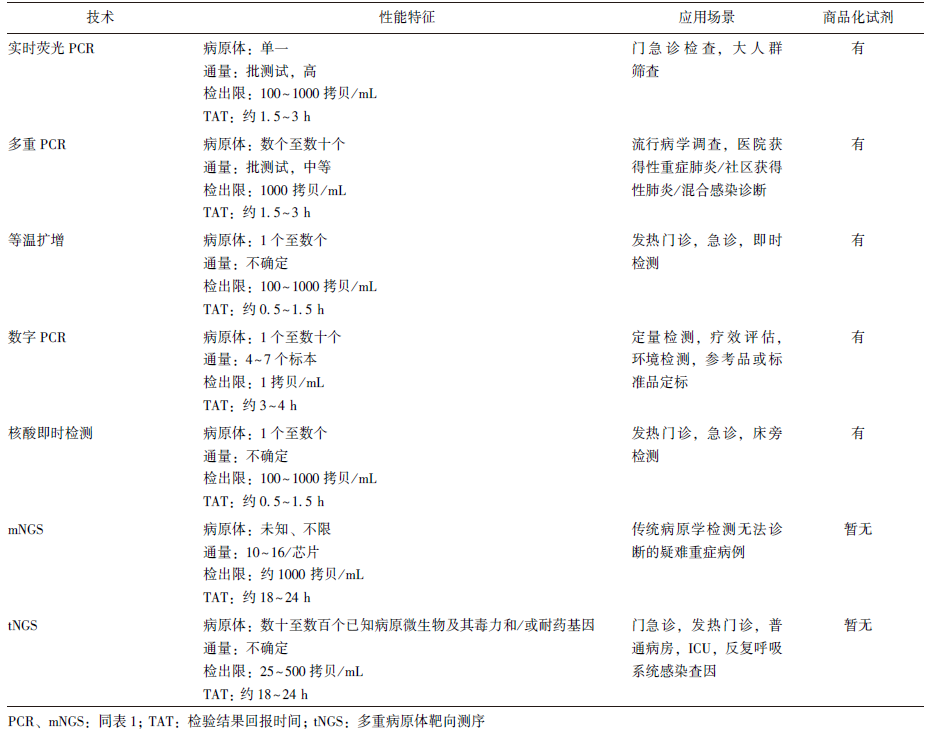
2.1 实时荧光PCR 技术
实时荧光PCR技术是一种可对核酸进行定量检测的试验方法,其原理主要是通过实时采集荧光信号对核酸扩增进行监测。在PCR扩增的指数时期,模板的阈值循环(Ct)值与其起始拷贝数存在线性关系,可实现对未知样本的定量检测。
2.1.1 临床应用场景
主要适用于门急诊、住院患者和大规模人群筛查,基于分子检验平台进行病原体(包括病毒、细菌、真菌、非典型病原体)的核酸检测,检测标本类型以鼻咽拭子、痰和支气管肺泡灌洗液(BALF)为主。
现有的商品化单靶标核酸检测病原体包括:新型冠状病毒、鼻病毒、嗜肺军团菌、耶氏肺孢子菌等;多靶标核酸检测病原体包括:呼吸道合胞病毒、甲型流感病毒、乙型流感病毒、腺病毒、副流感病毒、肺炎支原体、肺炎衣原体、结核分枝杆菌等[7]。
2.1.2 技术特点
作为传统的经典定量分析方法,荧光探针法的灵敏度和特异度明显优于底物发光法,但特异性引物探针的成本和对仪器的要求较高。其结果判读较为复杂,需要对扩增曲线和熔解曲线进行分析。
2.1.3 性能验证要求
定量检测需验证的性能指标应包括:正确度、精密度(包括测量重复性和测量中间精密度)、不确定性、特异度(包括抗干扰能力)、灵敏度、检出限、定量限、线性区间(可报告区间)等。定性检测需验证的性能指标包括:方法符合率、检出限、抗干扰能力、交叉反应等[8],具体性能指标以产品说明书要求为准。
2.2 等温扩增技术
相较传统PCR变温技术,等温扩增技术通常无需改变反应温度,该技术方案多、技术原理差异较大且各具优势,但基本原理仍是以特异性酶和引物进行扩增。等温扩增技术大多为指数扩增,目前多为定性检测[9]。
2.2.1 应用场景
主要适用于发热门诊、急诊患者上呼吸道感染病毒(如新型冠状病毒、流感病毒等)及下呼吸道感染细菌(如肺炎链球菌、金黄色葡萄球菌、肺炎克雷伯菌等)的快速筛查。
2.2.2 技术特点
等温扩增反应通常耗时短,扩增效率高,不需要PCR循环仪[10] 且操作简单,但由于其技术的复杂性,尚难以全部直接用于临床。
技术局限性:(1) 在引物设计上,环介导等温扩增技术、交叉引物扩增技术、链置换扩增、重组酶聚合酶等温扩增技术等较为复杂,且引物数量通常>4条,而滚环核酸扩增技术和解旋酶依赖性扩增技术则相对容易。(2)需额外进行核酸提取。
2.2.3 性能验证要求
通常等温扩增为定性实验,需满足中国合格评定国家认可委员会GL039[11]定性实验的验证要求:符合率≥90%;阴性和弱阳性样本精密度检测结果完全一致;参照厂家说明进行靶基因检测,5次重复检测均应检出,20次重复检测应检出至少18次。
2.3 数字PCR技术
数字PCR是一种不依赖于核酸外标的核酸绝对定量技术[12]。其原理是通过微流控技术,将目标核酸和PCR反应液分布在多个反应单元内进行PCR扩增,以液滴形式进行检测的方式也被称为微滴数字PCR。
该技术通过检测扩增后每个反应单元的荧光信号强度,判断含有目标核酸的反应单元个数,基于泊松分布计算起始样本中的目标核酸分子数,实现对核酸浓度的绝对定量。
2.3.1 应用场景
可直接定量检测样本中病原体数目,尤其适用于低浓度样本、低丰度基因或突变基因的检测,也可作为质控方法评估其他分子检测产品的扩增效率。
2.3.2 技术特点
无需标准曲线和标准品,可有效减少临床样本复杂本底对扩增的干扰,具有良好的重现性和准确度。其主要影响因素是PCR扩增和荧光信号分析,前者与PCR扩增效率、扩增体系的配置有关;后者与检测器的灵敏度、核酸拷贝数、被分割成的物理单元数以及反应单元数有关,反应单元数越多,灵敏度越高。
技术局限性:(1)不同数字PCR采用的微流控单元分割技术和耗材试剂具有封闭性,不同厂家试剂和平台的检测结果存在差异,尚无可评估其定量结果准确性的跨平台质控技术及非数字PCR方法学质控;(2)依托荧光探针进行定量检测的方法受限于靶标通量;(3)由于该技术检测灵敏度为单分子水平,不适用于检测浓度相对较高的样本;(4) 数字PCR报告审核规则,尤其是低丰度检测结果的报告原则,尚无定论。
2.3.3 性能验证要求
定量检测性能验证指标应包括:反应单元体积精密度、准确度、有效率;样本检测重复性、线性、动态范围、灵敏度。应使用泊松分布计算靶标分子拷贝数,不同荧光通道之间应不存在相互干扰。基于芯片的数字PCR芯片内应无气泡,阳性和阴性的随机分布应得到视觉确认。微滴数字PCR单次反应生成的最小液滴数应符合厂商建议或用户自定义值[13]。
2.4 核酸POCT技术
核酸POCT为POCT技术中涉及核酸检测的一大类技术的总称,是核酸提取技术和分子扩增技术(包括实时荧光PCR、巢式PCR、等温扩增、数字PCR等技术)的融合。其最大特点是将核酸的提取、扩增、检测均置于一个反应装置中,通过特定设备对扩增信号检测,完成对靶标核酸的筛查。目前核酸POCT主要以全自动封闭管理系统为主。
2.4.1 应用场景
主要适用于发热门诊、急诊、ICU和某些特定病区感染患者的病原体快速检测。与传统POCT不同,呼吸道病原体核酸POCT需对检测病原体的生物安全进行评估[14]。流感病毒、肺炎衣原体、肺炎支原体、百日咳杆菌等呼吸道病原体核酸POCT产品,已作为该类型代表产品问世。
2.4.2 技术特点
核酸POCT的灵敏度和特异度高于免疫学POCT,但其成本较高。虽然大部分核酸POCT产品为封闭体系,但仍需注意PCR污染的可能性。此外,其检测设备一般较小,便于携带,但也导致其通量较低,不适用于大规模人群筛查,满足大型医院临床检测需求往往需要配备多组设备。
2.4.3 性能验证要求
定性检测性能验证指标应包括:符合率≥90%;阴性和弱阳性样本精密度检测结果完全一致;靶基因5次重复检测均应检出,20次检测应至少检出18次。
定量检测性能验证指标应包括:至少 80% 的样本结果偏倚在±7.5%区间内;批内和批间精密度满足说明书范围;线性区间满足说明书范围;20 次检测中≥18个检测结果与参考值之间的偏倚在±7.5%区间内[8,11]。
2.5 病原体高通量测序技术
病原体高通量测序技术通过对临床标本中的核酸进行测序,并通过与微生物参考基因组比对获取标本中的微生物物种组成、丰度等信息[15]。
目前该技术主要分为3类:无偏倚检测的mNGS、检测多重病原体及其耐药基因或毒力基因的tNGS和获取某一种或多种病原体全基因组数据的全基因组测序技术(WGS)。
2.5.1 应用场景
由于病原体高通量测序技术复杂、结果解读难度大且价格昂贵,建议根据临床需求在传统微生物检测的基础上选择性使用[16-18],例如,在需尽快明确病原学诊断时、目前可及的微生物检验手段无法明确诊断时、出现聚集性呼吸道传染性病例需进行病原体溯源时使用。
2.5.2 技术特点
病原体高通量测序技术可对标本中的核酸片段进行物种鉴定,但其物种、耐药基因和毒力基因鉴定的准确性受标本采样、实验操作流程、病原体参考基因组数据库和生物信息学分析等多种因素影响[19]。在临床报告的解读过程中,除深入分析测序数据外,结合患者临床信息及其他实验室数据综合判断和鉴别定植菌与责任病原体亦十分关键[20-21]。
2.5.3 性能验证要求
实验室在开展病原体高通量测序临床检测前,需参考实验室自建方法的相关要求完成方法学建立和性能确认,结合预期临床用途确立预期性能指标,应包括:
(1)生信流程评估:最低测序数据量、准确率、召回率、精确率和F1值等;
(2)全流程性能确认:背景核酸数据模型、阳性阈值、重复性、最低检测限、抗干扰力、稳定性等;
(3)临床评估:对一定数量的真实临床标本进行检测,确定阴性预测值和阳性预测值[22-23]。
3 成人呼吸道感染病原体诊断
3.1 急性上呼吸道感染
急性上呼吸道感染是由各种病毒和/或细菌引起的,主要侵犯鼻、咽或喉部的一组急性感染性疾病,以病毒感染多见,如鼻病毒、呼吸道合胞病毒、流感病毒、冠状病毒等,少数为细菌感染,其中以链球菌最常见。临床症状不具有特异性,多以上呼吸道卡他症状、咽部不适为临床表现,可伴发热、头痛、咳嗽等其他症状。
3.1.1 是否推荐急性上呼吸道感染患者常规病原学检查?
需根据疾病流行情况、患者病情严重程度、症状持续时间、合并症情况、免疫抑制状态评估结果、其他辅助检查结果的可参考性以及对预后的初步评判,决定是否对疑似急性上呼吸道感染的上述患者进行检测。
例如,在新型冠状病毒或流感病毒大流行期间,快速分子检测有助于预检分诊、缩短就诊时间、减少传染病传播风险;又如,当患者免疫功能严重受损,同时疑似流感样症状时,或呼吸道病毒检测可能影响医生抗病毒药物或停用抗生素的决定时,需对呼吸道病毒进行检测[24]。
3.1.2 急性上呼吸道感染病原诊断有哪些推荐?
在流行风险高的季节,高危人群(老年人、儿童、孕产妇、合并基础疾病患者)进行流感病毒检测可能比经验性抗流感治疗更经济[25]。此外,快速的结果反馈(如2 h内即出结果的快速分子检测)能够缩短患者门急诊就诊时间,降低流感传播风险,有利于传染病控制[26]。
3.2 气管支气管炎
气管支气管炎指气管、支气管黏膜及其周围组织的慢性非特异性炎症,常因病毒或细菌感染导致该疾病加重。主要表现为长期咳嗽咳痰,伴/不伴呼吸困难等表现。该病临床特征特异性不强,常需与慢性阻塞性肺疾病、支气管哮喘、支气管扩张症等疾病鉴别,此时需结合肺功能、胸部CT等检查协助诊断。
对于反复急性加重、发热伴有脓痰、病情评估需要住院诊治的患者,可考虑细菌涂片或培养尽快明确病原学以指导抗生素应用。
在流感病毒、新型冠状病毒等大流行期间,门急诊针对上述两种病毒的抗原检测或分子诊断技术有助于快速分诊并指导隔离防控,避免院内传播,但前者敏感性低于后者。
对于免疫功能正常且存在住院风险的成人患者而言,尽快采用多重PCR技术明确病原,可能缩短抗生素使用时间和住院时间[27],但儿童毛细支气管炎患者并不推荐常规病毒检测[28]。
3.3 肺炎
3.3.1 社区获得性肺炎
我国成人社区获得性肺炎(CAP)常见病原体为肺炎链球菌、肺炎支原体、流感嗜血杆菌、肺炎衣原体、肺炎克雷伯菌、金黄色葡萄球菌等,近年研究显示,病毒性肺炎在成人CAP中占比高达15.0%~34.9%[29],同一患者可同时合并细菌、病毒、真菌等病原体感染[1]。
1 CAP患者需要侵入性病原学标本采集吗?
重症CAP接受机械通气治疗的患者,若经验性治疗无效,怀疑有特殊病原体感染,或经积极抗感染治疗病情无好转,需与非感染性肺部病变鉴别,可经支气管镜留取下呼吸道标本进行病原学检测。肺炎合并胸腔积液,尤其是肺炎病灶同侧的胸腔积液可行胸腔穿刺进行胸水病原体检测。
2 核酸检测技术在CAP病原体诊断中的价值大吗?
CAP的致病菌培养往往耗时长,而苛养菌感染培养阳性率较低,因此核酸检测在诊断CAP病原学方面具有较大优势。若怀疑为支原体、衣原体、军团菌、病毒等感染时,可采用血清特异性抗原、抗体检测联合核酸检测和分离培养;实时荧光PCR、等温扩增、数字PCR、高通量测序技术可同时检测多种病原体,提供病原体分型、毒力基因和耐药基因等深入分析[1],若临床倾向于RNA病毒感染,建议选择RNA高通量测序。
建议危重症患者同时开展常规病原学检查辅以病原体核酸检测[18],二者可相互补充,有利于快速准确确定致病原,更好地服务于临床。
3.3.2 医院获得性肺炎/呼吸机相关性肺炎
医院获得性肺炎(HAP)/呼吸机相关性肺炎(VAP)是我国常见的医院获得性感染[30]。发生HAP/VAP后平均住院时间、抗感染治疗疗程均延长,且住院医疗费用增加[31]。我国HAP/VAP常见病原菌包括鲍曼不动杆菌、铜绿假单胞菌、肺炎克雷伯菌、金黄色葡萄球菌、大肠埃希菌等,耐药菌较为常见[30]。
1 是否推荐HAP/VAP患者常规留取标本行微生物学检查?
临床诊断HAP/VAP后,应积极留取呼吸道、血液、胸腔积液标本行微生物学检查。呼吸道标本应尽可能先进行涂片镜检,再进行病原体培养、抗原及核酸检测等。
2 HAP/VAP患者应通过非侵入性方法还是侵入性方法获得呼吸道标本?
非侵入性方法指经咳痰、鼻咽拭子、鼻咽吸取物或气管导管内吸引收集标本。侵入性方法指经支气管镜留取下呼吸道标本、经支气管镜或经皮肺穿刺活检留取组织标本等。
对于HAP患者,应先通过非侵入性方法留取呼吸道分泌物行涂片及半定量培养,经验性治疗无效、疑似特殊病原菌感染或采用非侵入性方法获得的呼吸道标本无法明确病原体时,再通过侵入性方法采集标本行微生物学检查。
VAP患者由于存在人工气道,除常规经气管导管吸取呼吸道分泌物进行涂片、培养外,还可通过侵入性方法采集标本(如BALF、支气管毛刷等)进行定量培养。
3 如何理解mNGS在临床诊断HAP/VAP患者中的价值?
HAP/VAP患者常见病原体为细菌,病原学诊断以传统培养为主,必要时可联合多重PCR、微流控芯片等多靶标病原体核酸检测,无需常规行mNGS。仅在患者存在免疫缺陷、3 d内未通过传统微生物学检测获得明确病原学依据,且经验性抗感染治疗无效时,考虑行以DNA检测为主的mNGS[17]。
3.4 慢性阻塞性肺疾病急性加重
慢性阻塞性肺疾病急性加重(AECOPD)是慢性阻塞性肺疾病患者的常见和重要事件,通常被描述为有慢性阻塞性肺疾病基础的患者出现呼吸道症状的急性恶化而导致额外治疗。其主要症状是气促加重,常伴有咳嗽加剧、痰液分泌增加和/或痰液性状改变,部分患者可伴有心悸、疲乏等不适,严重者可出现呼吸衰竭和/或心功能不全的临床表现[32]。这些症状均缺乏特异性,因此需与其他肺内疾病(如肺炎、肺栓塞、气胸等)和肺外疾病(如心源性肺水肿、心律失常等)相鉴别。
下呼吸道细菌感染是AECOPD的常见原因,常见致病菌包括流感嗜血杆菌、卡他莫拉菌、肺炎链球菌、铜绿假单胞菌和肠杆菌目;相对少见的病原体包括肺炎衣原体、肺炎支原体、军团菌、金黄色葡萄球菌等,鼻病毒等呼吸道病毒也是AECOPD的常见诱因[33-36]。
3.4.1 是否推荐AECOPD患者常规送检痰涂片和/或痰培养?
适于门诊治疗的轻症患者,不建议常规送检痰培养。
对于反复急性加重、初始抗菌治疗疗效欠佳、需住院治疗的重度急性加重(尤其伴有脓性痰)以及存在铜绿假单胞菌感染危险因素的患者,推荐常规送检痰涂片镜检和培养;应尽可能在启动抗菌治疗或改变治疗方案前送检合格的下呼吸道标本[32]。
对于经充分解痉、抗炎以及合理抗菌治疗但仍治疗失败的患者以及住院患者继发感染,推荐积极排查耐药菌以及真菌、分枝杆菌等特殊病原体,进行常规痰涂片镜检和培养、血清学以及结核分枝杆菌分子生物学检测。
3.4.2 是否推荐AECOPD患者常规行流感病毒、新型冠状病毒抗原和/或核酸检测?
对于AECOPD患者,不建议常规行流感病毒抗原和核酸检测。
对于有流行病学史、流感样症状或病情严重需要住院治疗的AECOPD患者,推荐尽早行流感病毒、新型冠状病毒等呼吸道病毒的抗原和/或核酸检测,核酸检测的敏感性高于抗原检测[32,37]。
3.5 肺结核及结核胸膜炎
肺是结核分枝杆菌进入人体的主要通道,结核分枝杆菌通过吸入引起肺部感染。肺结核往往发展缓慢,临床表现多样。肺结核的诊断并不简单,常规实验室检查对其诊断帮助有限,胸部影像学具有重要价值,胸部CT比X线能提供更多有价值的细节。肺结核的确诊依靠细菌学检查,抗酸染色对诊断结核分枝杆菌非常重要,但其缺乏特异性;结核分枝杆菌培养是确诊方法。
3.5.1 肺结核患者病原学检查的首选标本是什么?
新鲜咳出的痰或诱导痰是结核分枝杆菌抗酸染色和培养的重要标本。
3.5.2 是否需对肺结核患者行气管镜检查?
对于无法获取合格痰标本的患者,气管镜检查获取BALF和防污染毛刷标本尤为重要。
3.5.3 是否需进行结核分枝杆菌核酸检测?
核酸扩增技术可作为结核分枝杆菌快速诊断方法[38]。美国疾病预防控制中心建议对可疑活动性结核涂片抗酸染色阴性的患者,至少行1次呼吸道标本的结核分枝杆菌核酸检测[39]。对涂片抗酸染色阳性患者,核酸扩增技术则可辅助鉴别结核分枝杆菌和非结核分枝杆菌[40]。
3.5.4 结核分枝杆菌核酸检测阴性可以排除肺结核吗?
对于涂片阴性、培养阳性的结核患者,痰标本结核分枝杆菌核酸检测的灵敏度和特异度分别为68%和96%[41]。因此,1次核酸检测阴性结果不足以排除肺结核。
3.5.5 在目前临床环境下是否仍可进行诊断性抗结核治疗?
实际工作中仍有16%的病例,在缺少病原学结果的情况下临床诊断肺结核并接受诊断性抗结核治疗[42]。
3.5.6 结核性胸膜炎患者是否需进行胸膜活检?
胸腔积液是结核分枝杆菌感染的一种表现,结核性胸腔积液通常为渗出液并以淋巴细胞为主。其胸水抗酸染色常呈阴性,胸水结核分枝杆菌培养阳性率约为50%左右[43],胸水的结核分枝杆菌核酸检测具有高特异度和低灵敏度。
强烈推荐怀疑结核性胸膜炎的患者接受胸膜活检和胸水分枝杆菌培养。胸膜活检标本病理检查和分枝杆菌培养联合诊断率可达80%。50%~97%的病例胸膜活检显示为肉芽肿,40%~80%的病例分枝杆菌培养阳性[38]。
3.5.7 如何选择结核特异性PCR或tNGS/mNGS行结核分枝杆菌检测?
结核特异性PCR与tNGS/mNGS对结核分枝杆菌的诊断能力相似。与传统方法相比,tNGS/mNGS比结核特异性PCR联合检测更具优势,能显著改善结核和其他病原体的病原学诊断[44],tNGS检测能够提供结核耐药基因的支持。
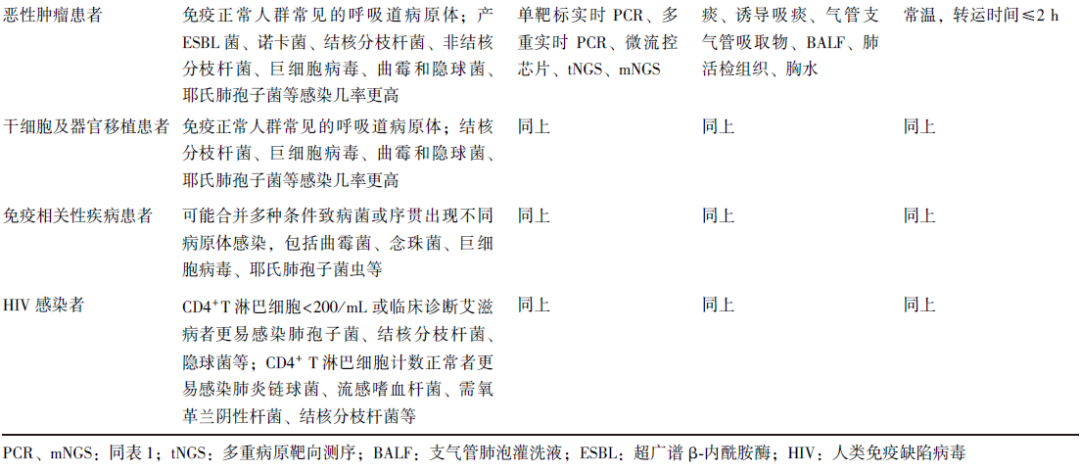
3.6 免疫功能受损人群的呼吸道感染
免疫功能受损包括原发和继发的免疫功能受损,如人类免疫缺陷病毒(HIV)感染属于原发性免疫功能受损,肿瘤、干细胞及实体器官移植和自身免疫性疾病长期使用糖皮质激素、免疫抑制剂等属于继发免疫功能受损。
除常见病原体外,结核分枝杆菌、诺卡氏菌、巨细胞病毒、耶氏肺孢子菌、曲霉和隐球菌等机会性感染的几率更高[45],机会性病原体感染后症状与体征隐匿,尤其HIV感染、器官移植患者发生下呼吸道感染时病原体构成更加复杂,条件致病菌、少见病原体、混合感染发生的比例更高,此时患者病情更重、进展更迅速。可考虑多种方法并行送检,临床常需积极开展涵盖目标病原体的多靶标核酸检测或mNGS以尽早诊断致病病原体[46]。
3.6.1 对免疫功能受损宿主是否推荐行BALF核酸检测?
在经验治疗的同时,应尽早开展支气管镜检查及支气管肺泡灌洗进行包括PCR或mNGS等在内的病原体检测,减少初始经验性治疗对病原学检测结果的影响。对BALF样本进行的其他微生物检查项目取决于患者临床表现、影像学特征以及特定病原体感染的危险因素,进行包括细菌涂片和培养、真菌涂片和培养、细胞学分析、组织病理学等在内的病原学检查[47]。
3.6.2 怀疑免疫功能受损宿主肺真菌感染时采用什么检测技术?
对侵袭性真菌感染的高危患者,建议行真菌荧光染色、真菌培养、血清学、分子生物学甚至组织病理学检测。尤其真菌荧光染色、1,3-β-D-葡聚糖试验(G试验)、隐球菌荚膜多糖抗原、血及BALF标本曲霉半乳甘露聚糖试验(GM试验)联合核酸检测,可提高真菌检出率;对于可以获得组织病理学标本的患者也可行mNGS;如临床倾向肺孢子菌感染,可采用呼吸道标本六胺银染色或PCR,联合血清G试验,以明确诊断[48],BALF及血标本mNGS也有助于诊断,但PCR或mNGS肺孢子菌阳性不能区分定植和感染,需结合临床综合判断。
3.6.3 对免疫受损合并肺部感染宿主,有必要开展血标本mNGS吗?
免疫受损宿主肺部感染伴发菌血症的机会为5%~10%,明显高于免疫功能正常宿主,此类患者出现重症CAP时,可同时行BALF及血标本mNGS,以协助明确可能的致病菌;血标本mNGS检测特异度略高于BALF,灵敏度低于BALF[49]。
3.6.4 是否推荐免疫低下宿主行PCR检测病毒感染?
PCR技术具有较高的灵敏度及特异度,对发展为有症状感染的诊断也有很高的阴性符合率,已成为检测病毒感染的标准方法。尤其推荐在造血干细胞及实体器官移植后定期采用PCR方法进行病毒(包括巨细胞病毒、EB病毒和其他季节性流行呼吸道病毒)的动态检测[50-51]。
4 小 结
成人呼吸道感染类型多样,不同感染类型及不同基础疾病患者病原谱各具特点,在临床常规诊疗过程中,应以患者临床症状体征为基础,联合应用影像学、传统微生物学、免疫学和分子生物学等检测技术(表3),依据相应检测标准作出快速、精准诊断。分子生物学诊断技术在临床的应用目前仍有较多问题亟待解决,尤其是对临床结果的正确解读。不同检测技术所提供的结果具有不同临床意义,联合应用可进一步提高病原学检测的灵敏度和特异度,更好地解释患者的病程发展并进行治疗监测。
表3 成人呼吸道感染病原体核酸检测技术应用建议[52-54]

参考文献
[1]邹晓辉, 曹彬. 呼吸道感染病原学诊断年度进展2021[J]. 中华结核和呼吸杂志, 2022,45:78-82.
[2]World Health Organization.Global Health Estimates: Life expectancy and leading causes of death and disability[EB/OL].(2021-05-03)[2023-07-30].https://www.who.int/ data/gho/data/themes/mortality-and-global-health-estimates.
[3]瞿介明, 刘海霞. 病原体分子诊断技术在下呼吸道感染诊断中的应用及其价值[J]. 中华结核和呼吸杂志, 2019,42:486-489.
[4]Hanson KE, Azar MM, Banerjee R, et al. Molecular Testing for Acute Respiratory Tract Infections: Clinical and Diag-nostic Recommendations From the IDSAs Diagnostics Committee[J]. Clin Infect Dis, 2020,71:2744-2751.
[5]Tenover FC. The role for rapid molecular diagnostic tests for infectious diseases in precision medicine[J]. Expert Rev Precis Med Drug Dev, 2018,3:69-77.
[6]北京协和医院罕见病多学科协作组, 中国罕见病联盟. 多准则决策分析应用于罕见病药品临床综合评价的专家共识(2022)[J]. 协和医学杂志, 2022,13:126-145.
[7]刘高山, 李红, 牛培华, 等. 多重核酸检测试剂盒RespiFinder®2SMART在检测12种呼吸道感染病毒中的临床应用性能评价[J]. 国际病毒学杂志, 2020,27:61-66.
[8]中国合格评定国家认可委员会. 临床化学定量检验程序性能验证指南:CNAS-GL037-2019[S].北京:中国合格评定国家认可委员会,2019.
[9]Deng H, Gao Z. Bioanalytical applications of isothermal nucleic acid amplification techniques[J]. Anal Chim Acta, 2015,853:30-45.
[10]姜苏, 李一荣. 等温扩增技术的原理及应用[J]. 中华检验医学杂志, 2020,43:591-596.
[11]中国合格评定国家认可委员会. 分子诊断检验程序性能验证指南:CNAS-GL039[S]. 北京:中国合格评定国家认可委员会,2019.
[12]Kuypers J, Jerome KR. Applications of Digital PCR for Clinical Microbiology[J]. J Clin Microbiol, 2017,55:1621-1628.
[13]ISO. 20395: 2019 Biotechnology-Requirements for evaluating the performance of quantification methods for nucleic acid target sequences--qPCR and dPCR[S/OL].(2019-08)[2023-07-20].https://www.doc88.com/p-5803961087245.html.
[14]上海市医学会分子诊断专科分会, 上海市医学会检验医学专科分会, 上海市微生物学会临床微生物学专业委员会, 等. 病原体核酸即时检测质量管理要求专家共识[J]. 中华检验医学杂志, 2021,44:1021-1028.
[15]Chiu CY, Miller SA. Clinical metagenomics[J]. Nat Rev Genet, 2019,20:341-355.
[16]中华医学会呼吸病学分会. 下呼吸道感染宏基因组二代测序报告临床解读路径专家共识[J]. 中华结核和呼吸杂志, 2023,46:322-335.
[17]《中华传染病杂志》编辑委员会. 中国宏基因组学第二代测序技术检测感染病原体的临床应用专家共识[J]. 中华传染病杂志, 2020,38:681-689.
[18]宏基因组分析和诊断技术在急危重症感染应用的专家共识组. 宏基因组分析和诊断技术在急危重症感染应用的专家共识[J]. 中华急诊医学杂志, 2019,28:151-155.
[19]Bharucha T, Oeser C, Balloux F, et al. STROBE-metagenomics: a STROBE extension statement to guide the reporting of metagenomics studies
[20]中华医学会检验医学分会. 宏基因组测序病原微生物检测生物信息学分析规范化管理专家共识[J]. 中华检验医学杂志, 2021,44:799-807.
[21]中华医学会细菌感染与耐药防治分会. 呼吸系统感染中宏基因组测序技术临床应用与结果解读专家共识[J]. 中华临床感染病杂志, 2022,15:90-102.
[22]张栋, 张京家, 杜娟, 等. 病原宏基因组高通量测序性能确认方案[J]. 中华检验医学杂志, 2022,45:899-905.
[23]Miller S, Naccache SN, Samayoa E, et al. Laboratory validation of a clinical metagenomic sequencing assay for pathogen detection in cerebrospinal fluid[J]. Genome Res, 2019,29:831-842.
[24]Uyeki TM, Bernstein HH, Bradley JS, et al. Clinical Practice Guidelines by the Infectious Diseases Society of America: 2018 Update on Diagnosis, Treatment, Chemoprophylaxis, and Institutional Outbreak Management of Seasonal Influenzaa[J]. Clin Infect Dis, 2019,68:e1-e47.
[25]Lee BY, McGlone SM, Bailey RR, et al. To test or to treat? An analysis of influenza testing and antiviral treatment strategies using economic computer modeling[J]. PLoS One, 2010,5:e11284.
[26]Brendish NJ, Malachira AK, Beard KR, et al. Impact of turnaround time on outcome with point-of-care testing for respiratory viruses: apost hoc analysis from a randomised controlled trial[J]. Eur Respir J, 2018,52:1800555.
[27]Shengchen D, Gu X, Fan G, et al. Evaluation of a molecular point-of-care testing for viral and atypical pathogens on intravenous antibiotic duration in hospitalized adults with lower respiratory tract infection: a randomized clinical trial[J]. Clin Microbiol Infect, 2019,25:1415-1421.
[28]Ralston SL, Lieberthal AS, Meissner HC, et al. Clinical practice guideline: the diagnosis, management, and prevention of bronchiolitis[J]. Pediatrics, 2014,134:e1474-e1502.
[29]钟文, 吴凡, 吴建, 等. 病毒性肺炎治疗新进展[J]. 中华结核和呼吸杂志, 2022,45:121-126.
[30]施毅. 中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)[J]. 中华结核和呼吸杂志, 2018,41:255-280.
[31]Kalil AC, Metersky ML, Klompas M, et al. Executive Summary: Management of Adults With Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society[J]. Clin Infect Dis, 2016,63:575-582.
[32]中华医学会呼吸病学分会慢性阻塞性肺疾病学组, 中国医师协会呼吸医师分会慢性阻塞性肺疾病工作委员会. 慢性阻塞性肺疾病诊治指南(2021年修订版)[J]. 中华结核和呼吸杂志, 2021,44:170-205.
[33]Sethi S, Murphy TF. Infection in the pathogenesis and course of chronic obstructive pulmonary disease[J]. N Engl J Med, 2008,359:2355-2365.
[34]Ye F, He LX, Cai BQ, et al. Spectrum and antimicrobial resistance of common pathogenic bacteria isolated from patients with acute exacerbation of chronic obstructive pulmonary disease in mainland of China[J]. Chin Med J (Engl), 2013,126:2207-2214.
[35]Ma X, Cui J, Wang J, et al. Multicentre investigation of pathogenic bacteria and antibiotic resistance genes in Chinese patients with acute exacerbation of chronic obstruc-tive pulmonary disease[J]. J Int Med Res, 2015,43:699-710.
[36]江雁琼, 伍慧妍, 文艳琼. 慢阻肺急性加重期感染病原菌分布与机体免疫功能检测及其临床意义[J]. 中国病原生物学杂志, 2019,14:213-216.
[37]国家卫生健康委办公厅国家中医药管理局办公室. 关于印发流行性感冒诊疗方案(2020年版)的通知[EB/OL]. (2022-10-04)[2023-07-20]. http://www.nhc.gov.cn/ yzygj/s7653p/202011/a943c67d55c74e589d23c81d65b5e 221.shtml.
[38]Lyon SM, Rossman MD. Pulmonary Tuberculosis[J]. Microbiol Spectr, 2017.doi: 10.1128/microbiolspec.TNMI7-0032-2016.
[39]Centers for Disease Control and Prevention. Updated guidelines for the use of nucleic acid amplification tests in the diagnosis of tuberculosis[J]. MMWR Morb Mortal Wkly Rep, 2009,58:7-10.
[40]Yan L, Xiao H, Zhang Q. Systematic review: Comparison of Xpert MTB/RIF, LAMP and SAT methods for the diagnosis of pulmonary tuberculosis[J]. Tuberculosis (Edinb), 2016,96:75-86.
[41]Dorman SE, Schumacher SG, Alland D, et al. Xpert MTB/RIF Ultra for detection of Mycobacterium tubercul-osis and rifampicin resistance: a prospective multicentre diagnostic accuracy study[J]. Lancet Infect Dis, 2018,18:76-84.
[42]Scott C, Kirking HL, Jeffries C, et al. Tuberculosis trends--United States, 2014[J]. MMWR Morb Mortal Wkly Rep, 2015,64:265-269.
[43]Gopi A, Madhavan SM, Sharma SK, et al. Diagnosis and treatment of tuberculous pleural effusion in 2006[J]. Chest, 2007,131:880-889.
[44]Zhou X, Wu H, Ruan Q, et al. Clinical Evaluation of Diagnosis Efficacy of Active Mycobacterium tuberculosis Complex Infection via Metagenomic Next-Generation Sequencing of Direct Clinical Samples[J]. Front Cell Infect Microbiol, 2019,9:351.
[45]Timsit JF, Sonneville R, Kalil AC, et al. Diagnostic and therapeutic approach to infectious diseases in solid organ transplant recipients[J]. Intensive Care Med, 2019,45:573-591.
[46]张弦, 顾宇峰, 赵华, 等. 宏基因组学二代测序在免疫功能受损不明原因肺部感染患者病原鉴别中的意义[J]. 交通医学, 2020,34:242-245.
[47]Ramirez JA, Musher DM, Evans SE, et al. Treatment of Community-Acquired Pneumonia in Immunocompromised Adults: A Consensus Statement Regarding Initial Strategies[J]. Chest, 2020,158:1896-1911.
[48]王瑜琼, 黄琳娜, 詹庆元. 肺孢子菌肺炎诊断方法的研究进展[J]. 中华结核和呼吸杂志, 2020,43:878-880.
[49]Chen J, Zhao Y, Shang Y, et al. The clinical significance of simultaneous detection of pathogens from bronchoalveolar lavage fluid and blood samples by metagenomic next-generation sequencing in patients with severe pneumonia[J]. J Med Microbiol, 2021.doi: 10.1099/jmm.0.001259.
[50]石炳毅, 肖漓, 孙丽莹. 器官移植受者巨细胞病毒感染临床诊疗规范(2019版)[J]. 器官移植, 2019,10:142-148.
[51]Manuel O, Estabrook M. RNA respiratory viral infections in solid organ transplant recipients: Guidelines from the American Society of Transplantation Infectious Diseases Community of Practice[J]. Clin Transplant, 2019,33:e13511.
[52]Miller J. Michael. 临床微生物标本送检指南[M]. 马小军, 周炯, 杨启文, 等(译). 北京:布克(北京)文化传播有限公司, 2013.
[53]Gilbert DN, Chambers HF, Saag MS, et al. The Sanford Guide to antimicrobial therapy 2020[M]. 50th edtion. 北京: 中国协和医科大学出版社, 2021.
[54]国家卫生健康委全国细菌耐药监测网质量管理中心. 感染性疾病病原学检测标本采集及转运指导原则[M]. 北京: 中国协和医科大学出版社, 2020.


