Sci Adv:同济大学揭示食管鳞癌进展和耐药性的新机制
时间:2023-09-17 08:08:41 热度:37.1℃ 作者:网络
食管鳞状细胞癌(ESCC)因强大的侵袭性表型和化疗耐药,是最致命的癌症之一。ESCC患者预后较差,主要是症状不明显,早期易发生转移。迄今为止,顺铂是治疗ESCC的首选药物,但耐药仍然是一个巨大的问题。因此,弄清ESCC进展和顺铂耐药背后的生物学过程,寻找新的治疗靶点势在必行。自噬是一种重要的稳态细胞循环机制,在耐药性中起着至关重要的作用。TAO激酶属于丝裂原活化蛋白激酶,介导多种癌症的耐药性。然而,TAO激酶在ESCC进展和化疗耐药中的作用尚未被探讨。
9月13日,同济大学研究人员在学术期刊《Science Advance》上发表了题为“TAOK3 Facilitates Esophageal Squamous Cell Carcinoma Progression and Cisplatin Resistance Through Augmenting Autophagy Mediated by IRGM”的研究论文。本研究报道了TAOK3通过增强细胞自噬进而促进食管鳞癌的进展和化疗耐药。机制上,TAOK3磷酸化KMT2C在S4588并加强KMT2C和ETV5之间的相互作用。因此,KMT2C核易位增加,自噬相关基因IRGM的转录进一步上调。此外,抑制剂SBI-581在体外和体内均能显著抑制TAOK3介导的细胞自噬,并与顺铂协同治疗ESCC。

https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202300864
食管癌在人类癌症死亡率中排名第六,其中(ESCC)约占90%。ESCC与广泛的淋巴扩散有关,通常在晚期诊断出来。化疗对ESCC患者至关重要,在术后辅助治疗和一线治疗中发挥着不可替代的作用。顺铂仍是治疗ESCC的首选药物,但耐药限制了其实际疗效,恶化了ESCC患者的预后。因此,研究ESCC的发生机制及顺铂耐药机制,发现ESCC新的治疗靶点及预后指标具有重要意义。
1001 (TAOK)激酶是丝氨酸/苏氨酸激酶,属于SET20激酶家族。作为MAP3K的一种,TAO激酶对刺激有反应,如紫外线照射、细胞因子、热、营养缺乏和渗透性休克。据报道,在电离和紫外线辐射模拟下,TAO激酶被ATM(共济失调毛细血管扩张突变)磷酸化和激活,并进一步调节p38介导的DNA损伤反应。此外,除了p38 MAPK级联中的MKK3/6外,TAO激酶被发现可磷酸化MKK4/7并激活JNK信号级联。Hippo信号通路,也称为SWH通路,调节细胞增殖和凋亡。除了参与MAPK级联反应外,TAO激酶也被发现调节Hippo信号通路。除了调节各种信号通路,TAO激酶被证实与其他细胞蛋白相互作用,既有依赖的,也有不依赖的。TAO激酶通过与一些靶蛋白相互作用,调节DNA损伤应答、细胞骨架稳定性、凋亡等生理和病理生理应答。值得注意的是,据报道TAO激酶可介导多种癌症的化疗耐药。然而,TAO激酶在ESCC中的作用尚未被探讨。
本研究中,研究人员首次发现在ESCC细胞系和组织中,TAOK3而不是TAOK1和TAOK2显著过表达。此外,只有TAOK3能够增强ESCC的自噬。在功能上,TAOK3可以促进ESCC细胞的增殖、迁移、侵袭和顺铂耐药,但抑制细胞凋亡。这些结果表明,TAOK3通过诱导自噬促进ESCC的进展和顺铂耐药。从机制上讲,TAOK3可以使组蛋白甲基转移酶KMT2C在S4588位点磷酸化,并加强KMT2C与转录因子ETV5之间的相互作用。研究结果表明,TAOK3可以被视为ESCC的癌基因和预后生物标志物,类似于其他癌症。相关分析显示IRGM蛋白表达水平与TAOK3蛋白表达水平呈正相关,表明IRGM蛋白表达在ESCC组织中受TAOK3调控。
鉴于本研究中TAOK3依赖于其激酶活性促进ESCC的进展,研究人员期待寻找特异性的TAOK3抑制剂,以改善其对肿瘤进展的影响。最近,研究人员对5600种化合物进行扫描后,发现了一种针对TAOK3的特异性抑制剂SBI-581 (IC50 = 42nm)[28]。然而,其肿瘤抑制作用,特别是与化疗的协同作用尚未被研究。研究还发现,SBI-581可以将TAOK3的磷酸化明显迁移到KMT2C,并且KMT2C与ETV5的结合被稳健释放。使用SBI-581后,ESCC细胞的自噬水平降低,IRGM过表达可有效恢复这种作用。体外和体内实验证实了SBI-581与顺铂的协同作用。这些结果表明,SBI-581能够显著抑制TAOK3对ESCC的作用,并与顺铂在ESCC治疗方面具有良好的协同作用。因此,SBI-581在未来临床应用于ESCC治疗的可能性很大。
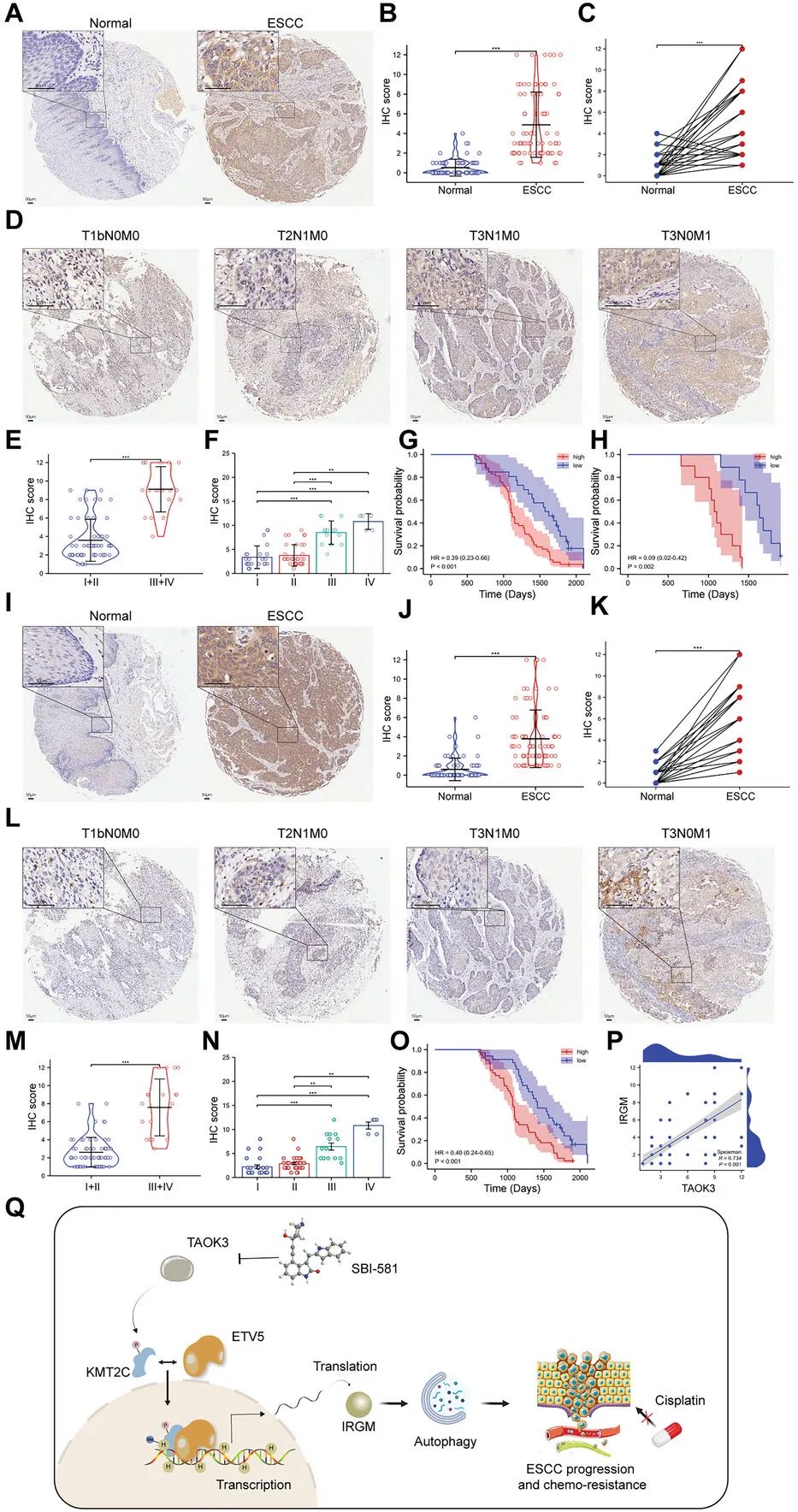
TAOK3和IRGM在ESCC组织中过表达,在临床上与肿瘤分期和不良预后相关
综上,研究人员首次确定了TAOK3在ESCC的进展和化疗耐药中的潜在作用。TAOK3在ESCC中的过表达可上调自噬相关蛋白IRGM的表达,进一步增强ESCC的自噬。从机制上讲,TAOK3磷酸化KMT2C的S4588位点,并促进KMT2C和ETV5之间的相互作用。在KMT2C和ETV5的帮助下,KMT2C的核易位增加,IRGM的转录上调。TAOK3可以作为ESCC的癌基因和重要的预后生物标志物。抑制剂SBI-581可与顺铂联合作为一种新的治疗策略。
参考资料:
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202300864


