Cancer Cell:首次阐明真菌促进肺癌发展的分子机制
时间:2023-09-25 11:13:27 热度:37.1℃ 作者:网络

9月21日,国际顶尖肿瘤学期刊《Cancer Cell》(癌细胞)在线发表了上海交通大学公共卫生学院/单细胞组学与疾病研究中心/肿瘤系统医学全国重点实验室王慧/刘宁宁联合团队题为“The intratumor mycobiome promotes lung cancer progression via myeloid-derived suppressor cells”的研究论文,该研究首次阐明真菌促进肺癌发展的分子机制,引发业界广泛关注。联合团队从肿瘤组织内分离并鉴定出一株促进肺癌发展的真菌菌株—聚多曲霉,通过整合深度宏基因组学、培养组学、基因组学、转录组学等多组学技术,解析了肺腺癌患者不同组织部位内的真菌微生物组的种类与分布特征,阐明瘤内真菌聚多曲霉通过与宿主之间的相互作用,诱导肿瘤免疫抑制的微环境,最终促进肺癌发展的机制,同时证实聚多曲霉在肿瘤内的富集与肺癌患者的较差预后密切相关,该研究具有重大的公共卫生、疾病筛查和肺癌精准治疗意义。在公众健康领域,该发现为肺癌的早筛提供了新型真菌标志物;在疾病治疗领域,在菌株水平精准靶向真菌可以促进免疫杀伤,从而抑制肺癌的恶化进展,该项研究成果将极大推动基于靶向真菌的肺癌个体化靶向-免疫治疗新策略,填补真菌和肺癌分子机制研究方面的空白。
近年来,“多形态微生物组”被列为癌症的新标志物,促进了人类对癌症认知的重大突破。肿瘤内微生物组是肿瘤微环境的重要组成部分,其与宿主的相互作用对癌症的发生、发展至关重要,因此肿瘤内微生物研究为癌症的诊断、筛查和治疗提供了崭新的视角。然而,人们对瘤内微生物组的异质性、潜在来源和富集,以及癌症恶化等关键问题了解甚微。探讨肿瘤内四界微生物组在癌症的发病和药物治疗过程中的分子生物学机制和健康价值,将为制定中国人群癌症的精准筛查与防治策略提供重要的理论基础。
前期,该联合团队在本领域已经积累了丰富的研究基础和系列成果:①自主研发了单细胞微生物组、单细胞蛋白质组和瘤内四界菌群时空转录组分析等核心技术,突破了传统微生物组与宿主交互作用研究的技术瓶颈,整合营养流行病学、宏基因组、蛋白质组、代谢组、单细胞组学、人群元数据和临床数据等多维度多模态数据信息,构建出膳食营养-瘤内四界微生物组(细菌、真菌、古菌、病毒)-代谢物-蛋白质-免疫状态-健康效应之间的关联和时空演化规律图谱;②建立了样本采集、保存和运输、微生物组DNA富集和提取、测序和分析、培养组学分离活菌、分子、细胞和动物实验验证等一整套真菌微生物组研究的标准操作规程(SOP),目前已经在科技部国家重点研发计划项目的资助下,在全国多家医院投入使用(Nat Protoc 2017; Nat Commun 2021; Npj Precis Oncol 2020; Phenomics 2023; Front Cell Infect Microbiol (Editorial) 2023),同时正在与世界卫生组织(WHO)合作推动该SOP的国际化认证;在真菌与宿主相互作用分子机制研究方面,取得了系列重要研究成果(Cell Res 2010; PLoS Genet 2013; PNAS 2017; PLoS Pathog 2018; mBio 2020; Microbiol Spectr 2022; Cell Rep 2022);③依托上海交通大学医学院单细胞组学与疾病研究中心,前期研制多项单细胞前沿研究技术和瘤内四界菌群分析研究方法(Gut 2017; EBioMedicine 2017; Cell Discovery 2017; Sci Total Environ 2020; Adv Mater 2020; Clin Transl Med 2021; Nat Commun 2021; Nature 2021, MedComm 2022; J Pharm Anal 2023),建成规模最大、覆盖最广、数据最全的基于宏基因组测序的结直肠癌患者肠道四界微生物组及互作网络数据库(Nat Microb, 2022 ESI高被引论文)。以上成果均为本项目的顺利开展奠定了良好的研究基础。
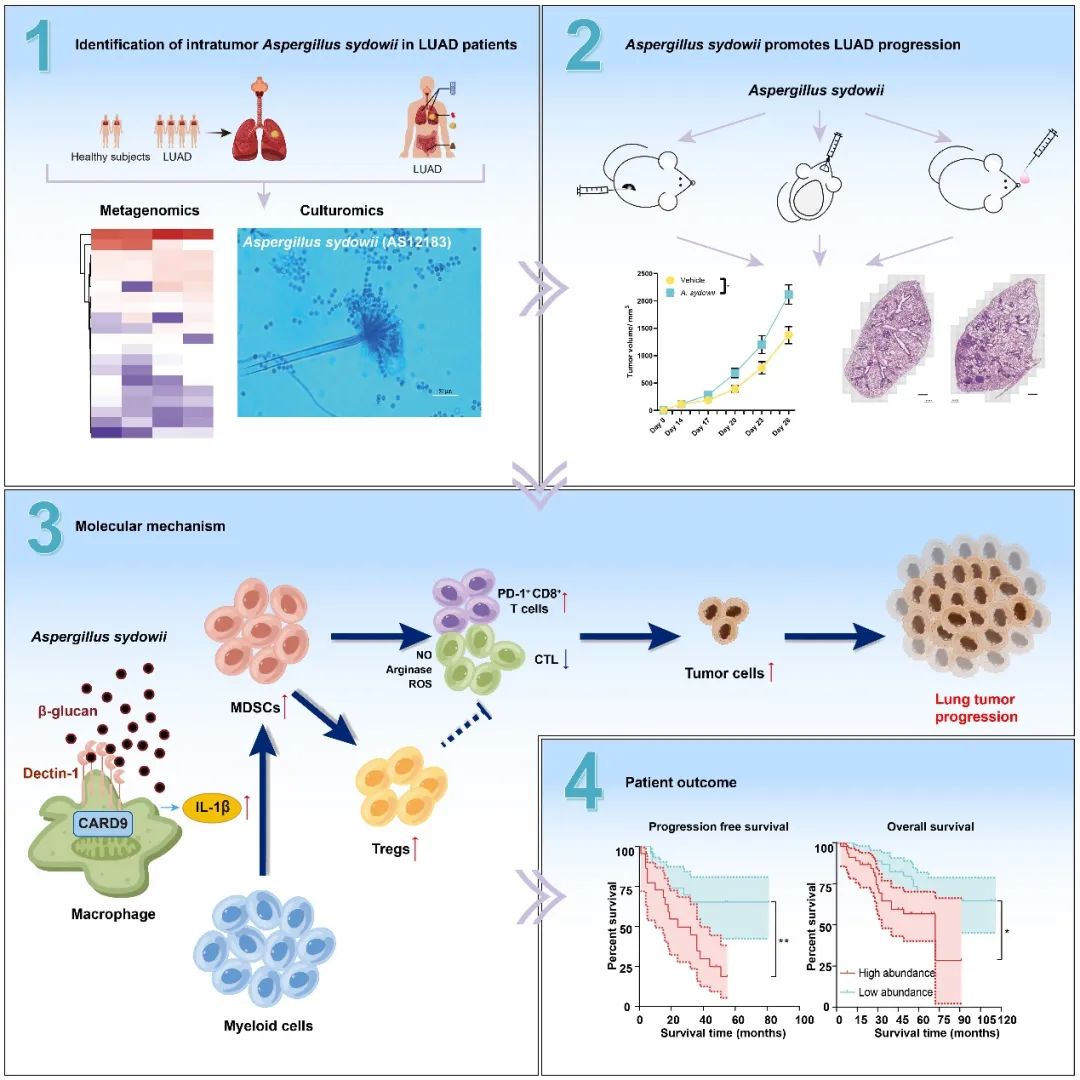 ▲ 聚多曲霉(Aspergillus sydowii)通过细胞壁中的β-glucan结合Dectin-1,诱导宿主细胞CARD9信号通路的表达,促进IL-1β的分泌募集下游MDSCs细胞,增强其抑制CD8+ T细胞杀伤的能力,最终诱导免疫抑制微环境的形成,从而促进肺癌发展。
▲ 聚多曲霉(Aspergillus sydowii)通过细胞壁中的β-glucan结合Dectin-1,诱导宿主细胞CARD9信号通路的表达,促进IL-1β的分泌募集下游MDSCs细胞,增强其抑制CD8+ T细胞杀伤的能力,最终诱导免疫抑制微环境的形成,从而促进肺癌发展。
本研究以上海交通大学公共卫生学院为第一作者和通讯作者单位,同济大学附属上海市肺科医院与中科院上海免疫与感染研究所为共同第一作者和共同通讯作者单位。刘宁宁研究员为第一作者兼共同通讯作者,同济大学医学院易呈祥博士以及上海交通大学公共卫生学院卫璐琦博士为共同第一作者,通讯作者为王慧教授、刘宁宁研究员、张鹏教授和陈昌斌研究员。该研究得到了上海交通大学医学院单细胞组学与疾病研究中心Christopher Heeschen教授和郑小琪教授、上海交通大学医学院附属第一人民医院钟林教授、中国科学院分子细胞科学卓越创新中心季红斌教授和杨巍维教授、南昌大学第一附属医院黄孝天和曾令兵教授、世界卫生组织国际癌症研究署主任Zisis Kozlakidis教授、清华大学林欣教授、南京师范大学陆玲教授、上海市免疫学研究所刘智多研究员、上海市肿瘤研究所覃文新教授的大力支持和帮助,同时得到了科技部国家重点研发计划、国家自然科学基金委、上海市科委、上海市教委、上海高水平地方高校创新团队等项目资助。
原始出处:
The intratumor mycobiome promotes lung cancer progression via myeloid-derived suppressor cells.Cancer Cell. 2023 Sep 19:S1535-6108(23)00288-X. doi: 10.1016/j.ccell.2023.08.012


