温州医科大学沈建良AM:免疫调节水凝胶,有效治疗糖尿病足溃疡创面!
时间:2023-10-09 20:27:44 热度:37.1℃ 作者:网络
糖尿病足溃疡(DFU)是糖尿病患者中一种严重且迅速增长的慢性并发症,目前的治疗方案仍然没有特异性。高血糖引起的炎症和过量的活性氧(ROS)是DFU伤口愈合过程中常见的障碍,往往导致康复受阻。这两种影响相辅相成,形成了一个无穷无尽的循环。然而,仍然缺乏针对这两个方面并打破恶性循环的充分和包容的方法。温州医科大学沈建良提出了一种治疗DFU创面的新方法,利用免疫调节水凝胶实现自级联葡萄糖耗竭和清除ROS来调节糖尿病微环境。具体地说,AUPT@melanin结合(GHM3)水凝胶敷料的开发是为了促进有效的热疗增强的局部葡萄糖消耗和ROS清除。从机制上讲,GHM3扰乱了ROS-炎症级联循环,下调了M1/M2巨噬细胞的比例,从而改善了糖尿病大鼠背部皮肤和DFU创面的治疗效果。总之,这种建议的方法为DFU提供了一种简便、安全和高效的治疗方式。该研究以题为“An Immunomodulatory Hydrogel by Hyperthermia-Assisted Self-Cascade Glucose Depletion and ROS Scavenging for Diabetic Foot Ulcer Wound Therapeutics”的论文发表在《Advanced Materials》上。

该研究制备了一种用于治疗DFU创面的混合免疫调节水凝胶(方案1),该水凝胶由金-铂合金沉积的黑色素(AUPT@melanin)纳米颗粒和复合水凝胶(苯基硼酸改性明胶和硫醇修饰的透明质酸)组成。黑色素是一种经典的ROS清除材料,由于其表面的多酚基,也可以用作负载Au和铂纳米颗粒的沉积场所。正如预期的那样,设计的AuPt@melanin纳米颗粒作为一个自级联平台来消耗葡萄糖和清除ROS。为了更好地适应伤口微环境,使用了苯基硼酸(葡萄糖响应型)、双键修饰的明胶和硫醇修饰的透明质酸来包裹AuPt@melanin纳米粒。通过简单的局部注射,以硫醇-烯为主要交联剂的弱水凝胶覆盖在伤口上。然后,通过紫外光诱导的双键自由基聚合可以进一步增强水凝胶的力学性能,并可以使用近红外触发热疗(42.5℃)来调节伤口处的葡萄糖和ROS的清除效率。在链脲佐菌素诱导的大鼠DFU模型中,验证了该GHM3水凝胶在促进巨噬细胞从M1表型向M2表型转变方面的有效性。

方案1.用于促进DFU伤口愈合的免疫调节水凝胶
【AUPT@melanin纳米粒子的制备与表征】
该研究采用一步氧化还原反应方法轻松制备AuPt@melanin纳米颗粒。选择黑色素纳米颗粒是因为黑色素纳米表面表现出大量的酚羟基,赋予它们清除活性氧的卓越能力。同时,这些酚羟基还可以作为螯合和还原Au3+和Pt2+的结合位点。选择Au和Pt纳米颗粒的共沉积是为了利用Au的类葡萄糖氧化酶特性和Pt的类过氧化氢酶特性。这种组合能够在DFU的高血糖和缺氧伤口微环境中实现连续的自我级联葡萄糖消耗。设计的AuPt@melanin纳米颗粒有望整合自级联葡萄糖消耗和 ROS 清除功能。AuPt@melanin具有优异的光热稳定性。此外,AuPt@melanin的光热转换效率为20.8%。这些属性凸显了AuPt@melanin纳米颗粒在光热辅助DFU伤口愈合方面的巨大潜力。接下来,评估了AuPt@melanin的ROS清除性能。正如预期的那样,AuPt@melanin对各种自由基表现出超过80%的令人印象深刻的清除率。在DFU伤口部位使用AuPt@melanin有望促进葡萄糖消耗和ROS清除,从而可能加速糖尿病伤口从炎症阶段向修复阶段的转变。
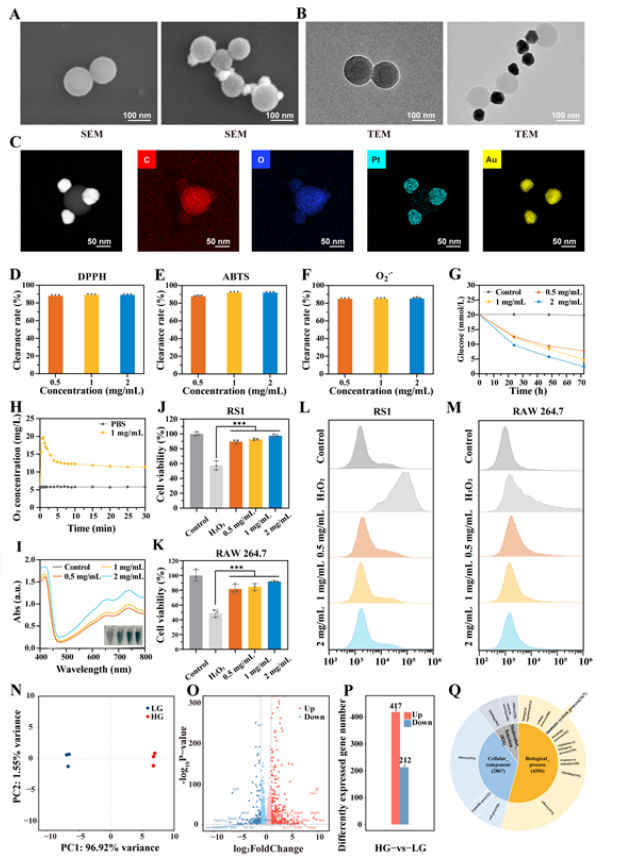
图 1. AuPt@melanin纳米颗粒的制造和表征
【AuPt@melanin掺入水凝胶的制备和表征】
该研究观察了冻干GHM水凝胶的表面特征和微观孔隙率。GHM1(不含AuPt@melanin)和GHM3(含有1 mg/mL的AuPt@melanin)水凝胶表现出多孔三维网状结构,为渗出液吸收和细胞增殖提供了最佳环境。接下来,评估了GHM水凝胶的吸水和保留特性。GHM水凝胶表现出出色的吸收和保持水分的能力。因此,它们可以有效吸收伤口的渗出物并维持最佳的湿度水平,这对于糖尿病足溃疡的愈合至关重要。此外,GHM水凝胶显示出优异的机械性能,包括自愈性、可注射性和粘附性,为它们在复杂伤口环境中的轻松应用和指定作用铺平了道路。
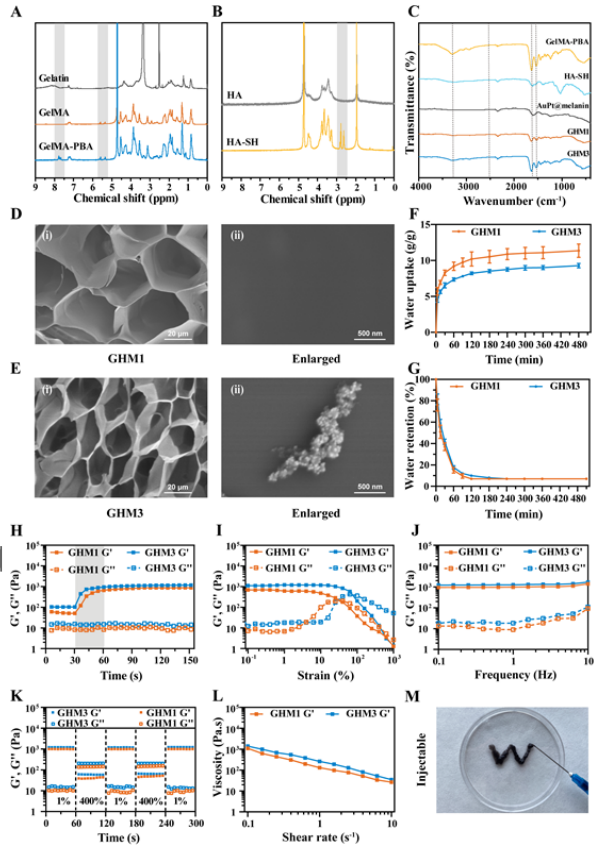
图 2. 掺有AuPt@melanin纳米粒子的水凝胶的制备和表征
【GHM水凝胶的体外生物相容性】
在考虑临床环境中的伤口敷料时,对水凝胶的一个关键要求是优异的生物相容性。GHM3组在48小时时表现出明显更快的伤口愈合速度。此外,评估了水凝胶促进人脐静脉内皮细胞 (HUVEC)血管生成的能力,结果表明GHM3水凝胶的血管生成趋势显着改善。GHM3水凝胶在体外增强的细胞迁移和特殊的血管生成特性可归因于AuPt@melanin纳米粒子的抗炎能力,它可以减轻氧化应激诱导的血管生成障碍,进一步证实了GHM水凝胶优异的生物相容性。之后,使用溶血试验评估GHM的血液相容性,结果表明GHM水凝胶具有生物相容性,不会引起溶血,并促进细胞生长/增殖。此外,采用大鼠尾止血模型和肝脏止血模型评估了GHM水凝胶的止血特性。与用纱布和市售3M水凝胶治疗的组相比,肝脏出血明显减少,这表明GHM水凝胶作为敷料发挥了极好的止血效果。
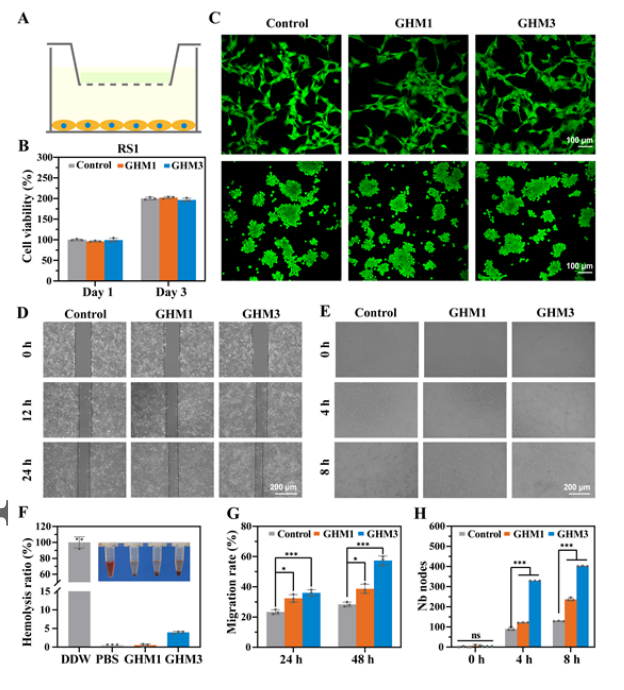
图 3. GHM水凝胶的体外生物相容性
【GHM水凝胶的光热和ROS清除性能】
评估了GHM水凝胶的光热性能。使用红外相机实时捕获水凝胶的红外热图像。结果表明 GHM水凝胶具有出色的光热稳定性。此外,合成的GHM3水凝胶表现出显着的自由基清除能力,表明其在伤口愈合应用中作为抗氧化剂的潜力。
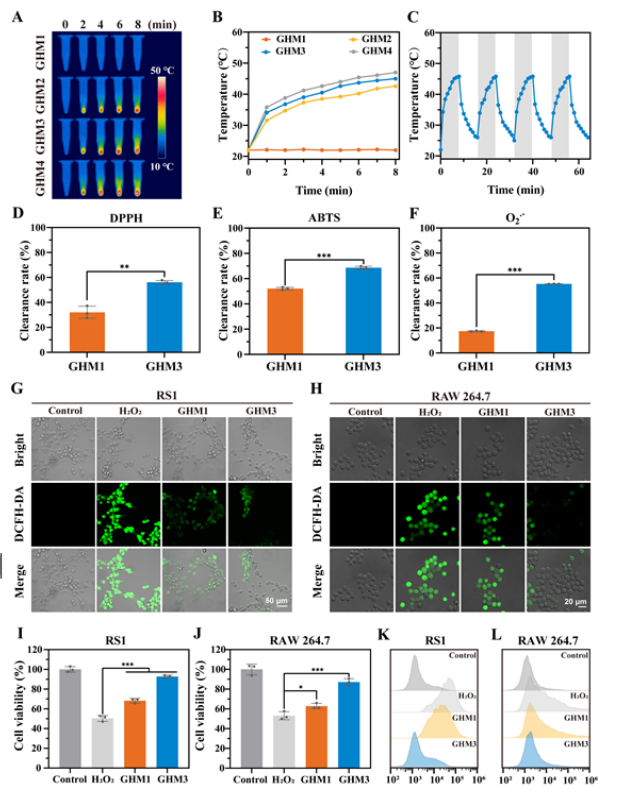
图 4. GHM水凝胶光热和ROS清除能力的体外研究
【GHM 水凝胶的体外免疫调节】
在DFU伤口中,从M1表型到M2表型的转变受到阻碍,导致持续炎症和伤口愈合延迟。糖尿病足溃疡中存在高葡萄糖微环境,导致体内氧化应激水平增加,这是影响伤口愈合的重要因素。因此,该研究试图通过消耗葡萄糖和清除ROS来改善伤口的炎症微环境,以促进巨噬细胞从M1向M2的转变。在GHM1和GHM3组中,与对照组相比,CD206染色显着升高,同时CD86染色减少,表明M2巨噬细胞的激活增强。
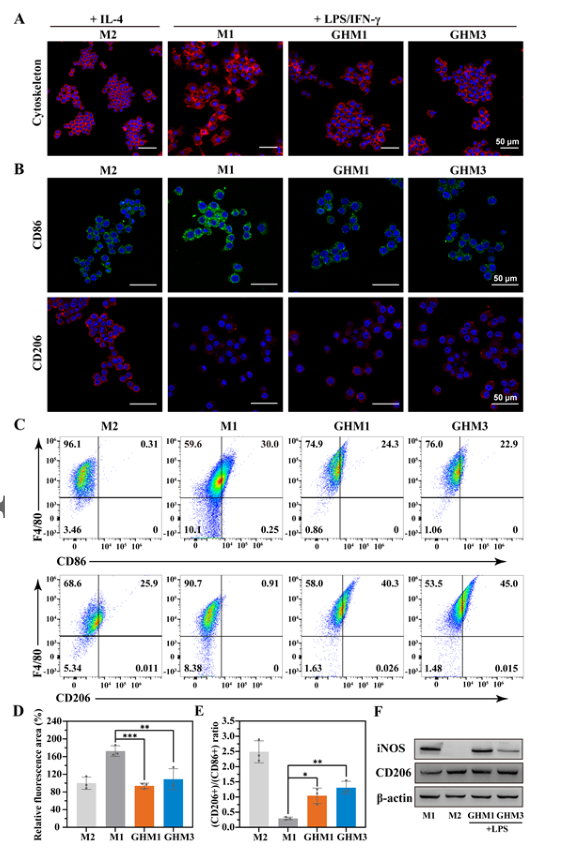
图 5. GHM水凝胶免疫调节的体外评估
【GHM水凝胶治疗性能的RNA测序分析】
使用RNA测序(RNA-Seq)评估在IFN-γ和LPS刺激诱导的炎症条件下在GHM3水凝胶上培养24小时的巨噬细胞中的信使RNA (mRNA)水平。总而言之,GHM3水凝胶充当免疫调节支架,通过抑制NOD样受体信号通路来减少炎症。这种抑制促进了巨噬细胞从M1表型向 M2表型的转变,从而加速了伤口愈合。
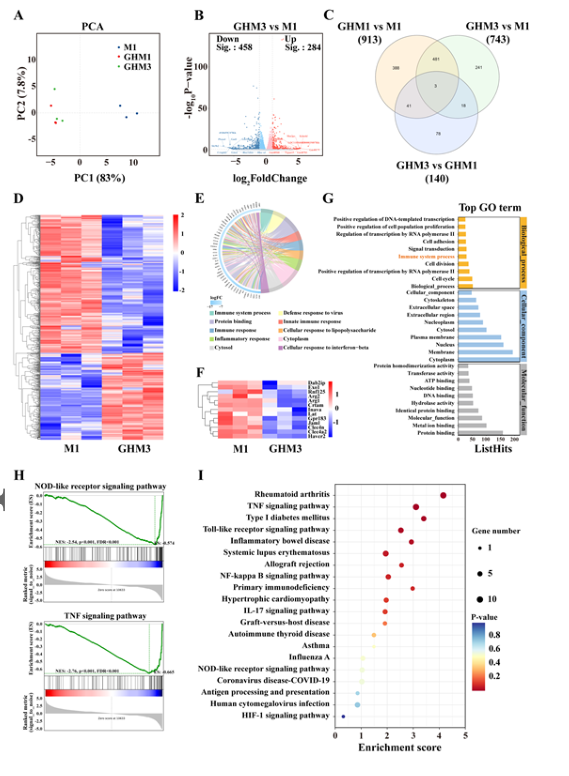
图 6. NIR辅助GHM水凝胶处理的RNA测序结果分析
【GHM水凝胶对糖尿病大鼠背部皮肤创伤的治疗作用】
随后,该研究检查了合成的GHM水凝胶对糖尿病大鼠伤口的愈合效果。GHM3组的伤口愈合有所改善,伤口面积仅为14.9%,而GHM3+NIR组的伤口愈合最为显着,伤口面积仅剩余 9.9%。苏木精和伊红(H&E)染色显示,使用GHM3 + NIR处理的伤口完全恢复,具有排列密集的肉芽组织和完全恢复活力的表皮。此外,胶原沉积对于促进细胞增殖、分化和伤口愈合至关重要。Masson染色表明,在接受GHM3处理并暴露于近红外光的组中,胶原纤维平行于毛囊排列,表现出最有序和一致的胶原沉积。结合这些结果,GHM3+NIR可以加速巨噬细胞表型从M1到M2的有效转变,从而帮助伤口抑制炎症反应,促进血管生成和组织重塑,最终实现快速、高质量的皮肤伤口修复。
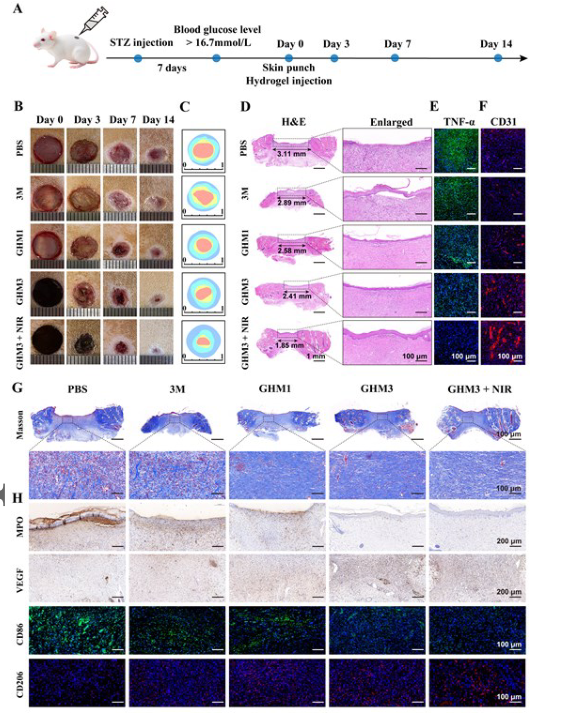
图 7.用于愈合糖尿病大鼠背部皮肤伤口的体内免疫调节
【GHM水凝胶对糖尿病大鼠DFU创面的治疗作用】
与背部皮肤伤口相比,设计用于治疗DFU的水凝胶敷料需要满足更高的标准。本研究采用双交联策略来实现GHM水凝胶机械性能调节的更大灵活性。此外,引入苯基硼酸基团能够与AuPt@melanin纳米材料中相邻的儿茶酚基团形成葡萄糖响应性苯基硼酸酯键,从而促进按需释放。总的来说,多功能GHM3水凝胶与近红外技术的结合为增强慢性糖尿病患者的伤口愈合过程提供了一种有前景的方法。这种治疗策略表现出多种有益效果,包括减少炎症、加速肉芽组织再生和胶原蛋白沉积,以及促进新血管形成。
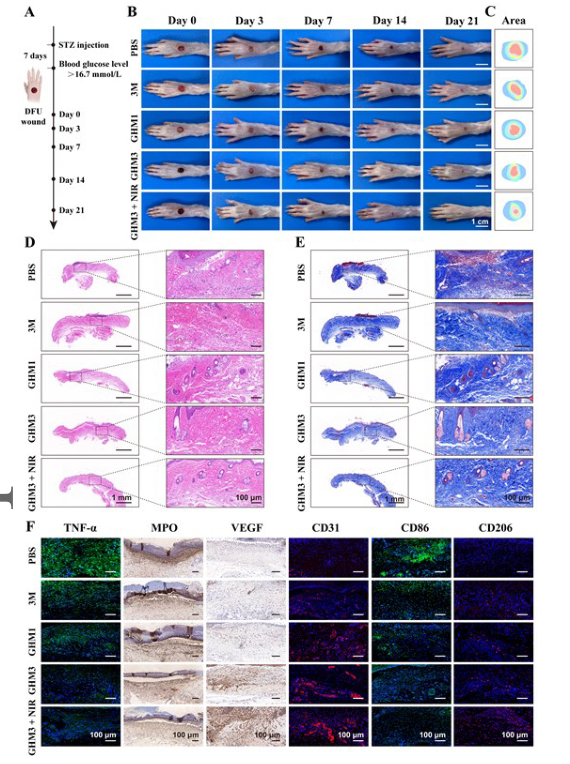
图 8. 用于DFU伤口愈合的体内免疫调节
【小结】
该研究开发了一种基于AuPt@melani纳米粒子和具有强大免疫调节特性的改性明胶/透明质酸的非常有前途的混合水凝胶(GHM3)。通过自我级联葡萄糖消耗和ROS清除,GHM3 有效缓解高葡萄糖微环境中过多的ROS水平,并诱导M2型巨噬细胞极化,从而减少炎症反应。体外实验和RNA测序分析表明GHM3干扰ROS-炎症级联循环并降低M1/M2巨噬细胞的比率。在糖尿病大鼠模型上进行的体内实验,涉及将GHM3水凝胶应用于背部皮肤和DFU伤口,结果表明GHM3可以破坏高血糖诱导的持续炎症循环和ROS水平升高,有效减轻炎症,促进胶原沉积,加速血管再生。因此,热疗辅助GHM3水凝胶在促进伤口愈合方面表现出卓越的功效。总体而言,这种方法作为治疗糖尿病患者皮肤伤口的理想和潜在的治疗策略具有重大前景。
原文链接:
https://doi.org/10.1002/adma.202306632


