【协和医学杂志】宏基因组高通量测序技术在中枢神经系统感染性疾病中的临床价值分析
时间:2023-11-05 11:42:03 热度:37.1℃ 作者:网络
中枢神经系统感染性疾病是临床重要的急危重症,在世界范围内具有较高的发病率和病死率[1]。早期识别致病病原体并给予针对性治疗,是改善患者预后的关键[2]。尽管如此,采用传统的病原学检测技术进行中枢神经系统感染性疾病诊断,仍存在超过半数的感染无法明确病原体[3]。
宏基因组高通量测序(mNGS)技术可非靶向检测临床标本中存在的细菌、真菌、病毒和寄生虫等病原体核酸,具有广谱和灵敏度高的特点,其临床应用越来越广泛。目前,国内外相关研究也肯定了mNGS技术在中枢神经系统感染性疾病中的诊断价值[2,4-7]。
2017年,中国医学科学院北京协和医院检验科团队开始探索建立mNGS检测技术流程,并于2022年正式投入临床应用。不同于第三方实验室,该检测平台的报告解读基于技术解读和临床解读两个层面,由从事生物信息学、临床感染、临床微生物学等专业人员合作完成。本研究基于该检测平台,对临床诊断为中枢神经系统感染性疾病患者的脑脊液mNGS检测结果进行回顾性分析,评价其在中枢神经系统感染性疾病诊断中的价值。
1 材料与方法
1.1 临床资料
本研究为回顾性诊断性试验,研究对象为2022年4—12月于中国医学科学院北京协和医院就诊的患者。纳入标准:(1)患者最终临床诊断为中枢神经系统感染性疾病,参考《北京脑炎协作组脑炎诊断标准》[8];(2)行脑脊液mNGS检测。排除标准:脑脊液细胞学证实为中枢神经系统恶性肿瘤或已确诊为自身免疫性脑炎的患者。
本研究已通过中国医学科学院北京协和医院伦理审查委员会审批(审批号:I-23ZM0049),并豁免患者知情同意。
1.2 研究方法
登录医院信息系统,查阅并收集平台投入临床使用以来患者脑脊液mNGS检测报告结果,同时收集患者的相关临床信息、脑脊液常规、生化及病原学检查等资料。
脑脊液mNGS检测由中国医学科学院北京协和医院感染性疾病宏基因组检测平台开展。具体方法:采集患者1~2 mL脑脊液标本送检,同步进行DNA和RNA核酸提取,随后进行文库构建,并在Illumina平台进行测序,通过数据分析(广州微远基因生物公司提供平台及协和自建分析流程),获得微生物检出及比对结果。
mNGS的结果解读流程分为技术解读和临床解读两个层面[9],解读人员由多名具有丰富mNGS报告解读经验的人员构成,包括1名具有生物信息学教育背景的人员、1名具有临床检验诊断学及生物信息学专业知识的人员、1名具有微生物学及感染病学专业知识的人员。
以患者的临床诊断作为金标准,相关定义如下:(1)真阳性:mNGS检出病原体,且与患者的临床诊断符合;(2)假阴性:mNGS未检出病原体,但患者的临床诊断为中枢神经系统感染。
1.3 样本量估算
根据既往研究数据[2-3],采用样本量计算公式:
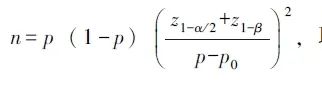
取双侧检验,在α=0.05,β=0.1的条件下,计算本研究所需最小样本量为19例。
1.4 统计学处理
采用SPSS 26.0统计软件对数据进行分析,符合正态分布的计量资料以均数±标准差表示,偏态分布的计量资料以中位数(四分位数)表示,计数资料采用频数(百分数)表示。
2 结果
2.1 患者临床资料
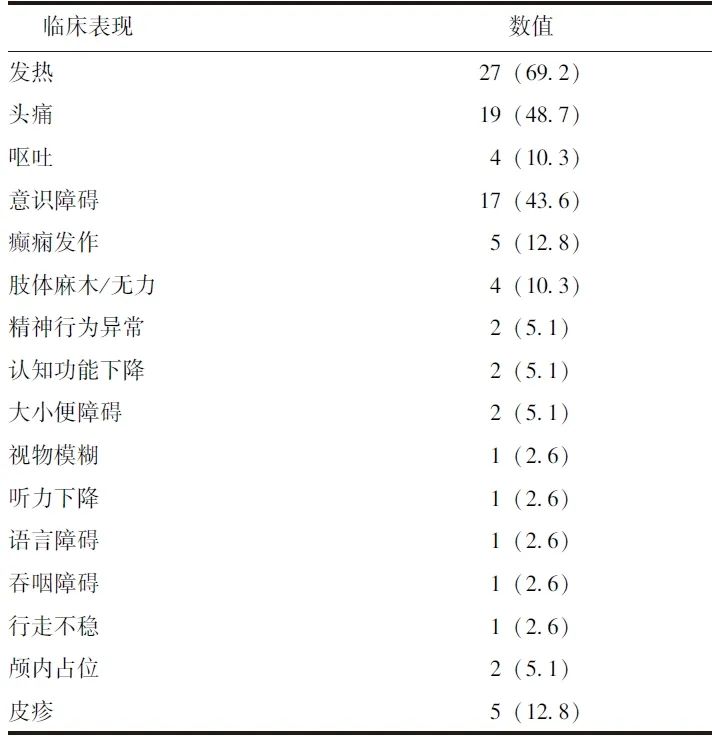
共入选39例符合纳入和排除标准的中枢神经系统感染性疾病患者,其中男性22例(56.4%),女性17例(43.6%),平均年龄(50.5±15.9)岁。主要临床表现为发热、头痛、意识障碍、癫痫发作、肢体麻木/无力、大小便障碍等(表1)。
表1 39例中枢神经系统感染者的临床表现[n(%)]
急性病程22例(56.4%),亚急性/慢性病程17例(43.6%)。患者入院后均完善腰椎穿刺检查,并送检脑脊液常规和生化检查,脑脊液白细胞计数为148(62,221)×106 /L,蛋白为1.46(0.89,2.45)g/L,葡萄糖为3.2(2.0,4.6)mmol/L,氯化物为(117.9±9.1)mmol/L。
2.2 脑脊液mNGS检测结果与临床验证
在39例患者中,10例(25.6%)脑脊液mNGS报告结果为阴性;29例(74.4%)检出疑似致病病原体特异性序列,其中11例(37.9%)检出细菌,13例(44.8%)检出病毒,3例(10.3%)检出真菌,1例(3.5%)检出细菌及病毒,1例(3.5%)检出真菌及病毒。
检出细菌以结核分枝杆菌最为常见(6例),其次为金黄色葡萄球菌(2例)、肺炎克雷伯菌(1例)、屎肠球菌及肺炎克雷伯菌混合感染(1例)、链球菌属及表皮葡萄球菌(各1例)。
检出病毒以水痘-带状疱疹病毒最为常见(9例),其次为EB病毒(3例,其中1例同时检出新型隐球菌及EB病毒)、巨细胞病毒(2例,其中1例同时检出链球菌属及巨细胞病毒)及肠道病毒71型(1例)。
检出真菌以新型隐球菌最为常见(2例),其次为白色念珠菌(1例)及烟曲霉(1例)。
29例阳性病例脑脊液mNGS检测结果均与临床诊断相符,真阳性率为74.4%。阳性病例脑脊液mNGS病原体检测结果与临床验证情况详见表2。
表2 29例阳性病例脑脊液mNGS病原体检测结果与临床验证情况

在检出结核分枝杆菌的6例患者中,除1例患者于送检当日死亡外,其余5例患者临床诊断均为结核性脑膜炎/脑膜脑炎,并接受抗结核治疗。
在此6例患者中,4例送检脑脊液X-pert® MTB/XDR检测,仅1例结果为阳性;2例送检脑脊液结核分枝杆菌核酸聚合酶链式反应(PCR)检测,结果均为阴性。在mNGS检出细菌阳性(含细菌及病毒混合检出1例)的其他患者中,除1例患者(检出金黄色葡萄球菌阳性)入院后死亡未留取病原学标本外,其余5例检测结果均与血培养/脑脊液/硬膜外脓肿脓液培养结果一致。
在检出病毒的患者中,除2例细菌及真菌混合感染外,其余13例临床诊断均为病毒性中枢神经系统感染,并接受抗病毒治疗,2例脑脊液病毒核酸PCR检测阳性。在mNGS检出真菌(含真菌及病毒混合检出1例)的患者中,仅1例脑脊液培养为阳性,2例检出新型隐球菌的病例其脑脊液隐球菌抗原均为阳性,1例检出烟曲霉的病例其血曲霉半乳甘露聚糖(GM)试验为阳性。
10例(25.6%)患者的mNGS检测结果为假阴性,根据其临床表现、脑脊液常规及生化结果等判断,临床诊断为中枢神经系统病毒感染4例,考虑细菌感染4例,无明确病原学指向2例。此10例患者的脑脊液临床常规病原学检查无阳性结果回报。
38例患者进行了脑脊液临床常规病原学检查(包括脑脊液涂片、培养、病原体抗原及PCR核酸检测)。5例(13.2%)脑脊液/硬膜外脓肿脓液培养阳性,其中细菌4例,真菌1例。1例脑脊液X-pert® MTB/XDR检测阳性,2例脑脊液病毒核酸PCR检测阳性,2例脑脊液隐球菌抗原检测阳性。整体脑脊液临床常规病原学检查的阳性率为23.7%(9/38)。
39例中枢神经系统感染患者中,16例临床诊断为细菌感染(包括7例结核性脑膜炎/脑膜脑炎、5例化脓性脑膜炎、3例脑脓肿及1例硬膜外脓肿),17例临床诊断为病毒感染(包括8例脑膜炎、4例脑炎、3例脑膜脑炎、1例脑脊髓炎及1例脑脊髓膜炎),4例临床诊断为真菌感染(包括2例隐球菌性脑膜炎、1例烟曲霉及1例念珠菌性中枢神经系统感染),2例临床无明确病原学指向。mNGS病原体检测结果与临床诊断比较详见表3。
表3 mNGS病原体检测结果与临床诊断比较[n(%)]
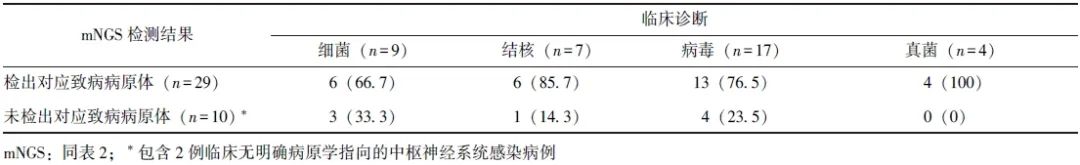
对于结核性脑膜炎/脑膜脑炎,mNGS诊断的灵敏度、特异度分别为85.7%、100%;对于其他中枢神经系统细菌感染,mNGS诊断的灵敏度、特异度分别为66.7%、100%;对于中枢神经系统病毒感染,mNGS诊断的灵敏度、特异度分别为76.5%、86.4%;对于中枢神经系统真菌感染,mNGS诊断的灵敏度、特异度均为100%。
3 讨论
本研究通过回顾性分析发现,39例临床诊断为中枢性神经系统感染性疾病患者中,29例通过mNGS检出疑似致病病原体,且均与临床诊断一致,真阳性率为74.4%,显著高于常规病原学检查结果(74.4%比23.7%)。
中枢神经系统感染性疾病作为临床急危重症,对致病病原体的早期识别和治疗是改善患者预后的关键[2]。脑脊液涂片及培养作为传统的病原学检测方法,不仅阳性率低,且培养耗时较长,不利于早期诊断。尽管脑脊液病原学抗原检测及基于PCR的核酸检测在临床逐渐推广,但其联合涂片及培养检测的阳性率未超过50%[2-3,5]。
为提高检测的阳性率,缩短检测时间,有研究引入质谱技术,无需进行培养即可直接检出脑脊液中的病原体[10],但目前该技术在国内外应用的报道较少,且脑脊液中需含有较高的菌量方可检出[11]。mNGS技术相较于传统检测方法,灵敏度更高且耗时更短,有助于临床疑难及急危重感染性疾病病原体的快速识别和诊断。
目前,国内外相关研究对mNGS技术在中枢神经系统感染性疾病诊断中的价值进行了探讨。国外一项纳入213例中枢神经系统感染性疾病患者的多中心、前瞻性研究显示,mNGS技术在中枢神经系统感染性疾病中的病原体阳性检出率为57%,在检测病毒、细菌及结核分枝杆菌感染方面优于传统检测手段[5]。
国内研究显示,mNGS技术对中枢神经系统感染性疾病的病原体阳性检出率为41%~47%[7,12-13]。尽管mNGS技术在结核分枝杆菌的检出方面存在一定局限性(核酸提取难度大,导致检出序列少或出现假阴性)[14],但本研究依然显示出脑脊液mNGS检测在结核性脑膜炎/脑膜脑炎诊断中的优势,在7例临床表现及脑脊液检测诊断为结核性脑膜炎/脑膜脑炎的病例中,6例mNGS检出结核分枝杆菌,灵敏度为85.7%。而在此7例患者中,仅1例(14.3%)痰抗酸染色为阳性,1例(14.3%)结核分枝杆菌PCR检测为阳性,mNGS检测的阳性率明显高于临床常规检测手段。且脑脊液mNGS检出结核分枝杆菌亦具有极好的特异性,这与国外文献报道一致[5,15]。
mNGS检出的29例阳性病例均与临床诊断相符,并可通过病原学检查(脑脊液涂片、培养、病原体抗原及PCR检测)验证或接受相应的抗微生物治疗。但在mNGS检出病毒的病例中,2例确诊为中枢神经系统细菌/真菌感染的病例同时检出了超过10条序列的病毒,且均为条件致病病毒(EB病毒及巨细胞病毒各1例),考虑可能为机体的潜伏感染。
本研究中,mNGS技术检出病原体的真阳性率为74.4%,高于国内外文献报道,此结果与本实验室对于报告解读流程的改进有关。mNGS技术的检测流程复杂,检测结果易受多方面因素的影响,实验室及试剂中的背景微生物、腰椎穿刺采样过程中皮肤定植菌的污染、采样及送检过程中环境微生物的污染等均对检测报告的解读存在干扰。
目前,国内mNGS检测分为院内检测和第三方实验室检测两种方式。自2017年起,中国医学科学院院北京协和医院检验科团队从临床需求出发,先后建立了mNGS的湿实验流程、生物信息分析流程、背景核酸数据模型,形成了相对规范的mNGS检测流程[16-18]。
在临床应用前,本团队结合已发表的专家共识[14,19],与急诊科、重症医学科、感染内科、神经科等多个科室的医师团队共同撰写报告解读流程文件[9,20]。在报告解读过程中,通过背景核酸数据模型过滤试剂、采样、环境中的背景微生物,同时结合患者的临床病史、脑脊液常规检测结果、病原学检测结果、影像学检查结果等综合判断检出结果与临床的一致性,最大可能避免假阳性报告的签发。同时,对于临床疑似中枢神经系统感染的患者标本,在首次检测结果未检出明确病原体的情况下,检验医师在查阅临床病例资料后指导调整湿实验流程,如提高破壁强度以提升真菌、结核分枝杆菌的核酸提取效率[21-22],增加去宿主流程以降低人源基因的比例,提升检测的真阳性率[23-24]。对于疑难病例,实验室则通过反复临床沟通、多学科会诊等策略与临床医师合作,尽可能解决临床问题。
本研究局限性:共纳入39例中枢神经系统感染性疾病病例,样本量相对较小,可能影响结果的外推性。mNGS技术作为新兴的检测技术,相较于传统检查手段,目前费用昂贵,同时对检测人员和解读人员的要求也更高,在一定程度上限制了其临床应用。随着技术的不断进步,通过降低成本费用、简化检测流程、缩短周转时间,相信mNGS技术可得到更广泛的应用。
综上,在中枢神经系统感染性疾病病原体检测方面,脑脊液mNGS检测相较于现有临床常规病原学检测手段具有更高的真阳性率,能够较为高效、快速、准确地获得致病病原体的信息,对于中枢神经系统感染性疾病的早期诊断及治疗、改善患者临床预后具有重要价值。
参考文献
[1]Venkatesan A,Tunkel AR,Bloch KC,et al. Case definitions,diagnostic algorithms,and priorities in encephalitis:consensus statement of the international encephalitis consortium[J]. Clin Infect Dis,2013,57:1114-1128.
[2]Wilson MR,Sample HA,Zorn KC,et al. Clinical Metagenomic Sequencing for Diagnosis of Meningitis and Encephalitis[J]. N Engl J Med,2019,380:2327-2340.
[3]Glaser CA,Honarmand S,Anderson LJ,et al. Beyond viruses:clinical profiles and etiologies associated with encephalitis[J]. Clin Infect Dis,2006,43:1565-1577.
[4]Fan S,Ren H,Wei Y,et al. Next-generation sequencing of the cerebrospinal fluid in the diagnosis of neurobrucellosis[J]. Int J Infect Dis,2018,67:20-24.
[5]Xing XW,Zhang JT,Ma YB,et al. Metagenomic Next-Generation Sequencing for Diagnosis of Infectious Encepha-litis and Meningitis:A Large,Prospective Case Series of 213 Patients[J]. Front Cell Infect Microbiol,2020,10:88.
[6]顾嘉程,吴洪,陈星兆,等. 宏基因组二代测序在诊断颅脑创伤相关中枢神经系统感染中的价值[J]. 中华神经外科杂志,2020,36:993-997.
[7]赵伟丽,林福虹,乔小东,等. 应用二代测序诊断中枢神经系统感染性疾病的回顾性分析[J]. 中华神经科杂志,2020,53:1016-1020.
[8]范思远,关鸿志,葛瑛,等. 北京脑炎协助组脑炎与脑膜炎诊断标准[C]. 第六届北京罕见病学术大会暨2018京津冀罕见病学术大会,2019.
[9]张栋,陆旻雅,苏慧婷,等. 病原宏基因组高通量测序报告解读流程建议[J]. 临床实验室,2023,17:65-69.
[10]Segawa S,Sawai S,Murata S,et al. Direct application of MALDI-TOF mass spectrometry to cerebrospinal fluid for rapid pathogen identification in a patient with bacterial meningitis[J]. Clin Chim Acta,2014,435:59-61.
[11]Angeletti S. Matrix assisted laser desorption time of flight mass spectrometry(MALDI-TOF MS) in clinical microbio-logy[J]. J Microbiol Methods,2017,138:20-29.
[12]李霞,谭少华,韩孟,等. mNGS在中枢神经系统感染中的诊断效能评估[J]. 吉林医学,2020,41:1864-1865.
[13]姚仲伟,苏淑芬,李美锦,等. 宏基因组测序技术在儿童中枢神经系统感染性疾病中的临床价值分析[J]. 国际医药卫生导报,2021,27:1489-1491.
[14]中华医学会神经病学分会感染性疾病与脑脊液细胞学学组. 中枢神经系统感染性疾病的脑脊液宏基因组学第二代测序应用专家共识[J]. 中华神经科杂志,2021,54:1234-1240.
[15]Yu G,Zhao W,Shen Y,et al. Metagenomic next genera-tion sequencing for the diagnosis of tuberculosis meningitis:A systematic review and meta-analysis[J]. PLoS One,2020,15:e243161.
[16]Du J,Zhang J,Zhang D,et al. Background Filtering of Clinical Metagenomic Sequencing with a Library Concentration-Normalized Model[J]. Microbiol Spectr,2022,10:e177922.
[17]Zhang D,Zhang J,Du J,et al. Optimized sequencing adaptors enable rapid and real-time metagenomic identification of pathogens during runtime of Illumina sequencing[J]. Clin Chem,2022,68:826-836.
[18]张栋,张京家,杜娟,等. 病原宏基因组高通量测序性能确认方案[J]. 中华检验医学杂志,2022,45:899-905.
[19]中华传染病杂志编辑委员会. 中国宏基因组学第二代测序技术检测感染病原体的临床应用专家共识[J]. 中华传染病杂志,2020,38:681-689.
[20]张栋,杨启文. 病原宏基因组检测平台的建设以及质量保证[J]. 中华医学杂志,2023,103:1092-1097.
[21]Wang S,Chen Y,Wang D,et al. The Feasibility of Metagenomic Next-Generation Sequencing to Identify Pathogens Causing Tuberculous Meningitis in Cerebrospinal Fluid[J]. Front Microbiol,2019,10:1993.
[22]Xing XW,Zhang JT,Ma YB,et al. Apparent performance of metagenomic next-generation sequencing in the diagnosis of cryptococcal meningitis:a descriptive study[J]. J Med Microbiol,2019,68:1204-1210.
[23]Ji XC,Zhou LF,Li CY,et al. Reduction of Human DNA Contamination in Clinical Cerebrospinal Fluid Specimens Improves the Sensitivity of Metagenomic Next-Generation Sequencing[J]. J Mol Neurosci,2020,70:659-666.
[24]Hasan MR,Rawat A,Tang P,et al. Depletion of Human DNA in Spiked Clinical Specimens for Improvement of Sensitivity of Pathogen Detection by Next-Generation Sequencing[J]. J Clin Microbiol,2016,54:919-927.


