Autophagy:动起来!江南大学柴高尚团队发现有氧运动减轻阿尔茨海默病病理进展和认知缺陷的潜在机理
时间:2023-11-18 21:26:27 热度:37.1℃ 作者:网络
越来越多的证据表明,巨自噬/自噬-溶酶体途径的缺陷对阿尔茨海默病(AD)中淀粉样蛋白β(Aβ)的积累起到贡献作用。长期以来,有氧运动(AE)一直被研究作为一种延缓和治疗AD的方法,尽管其确切的作用和机制尚不为人们所熟知。
2023年11月15日,江南大学柴高尚团队在Autophagy 在线发表题为“Aerobic exercise attenuates autophagy-lysosomal flux deficits by ADRB2/β2-adrenergic receptor-mediated V-ATPase assembly factor VMA21 signaling in APP-PSEN1/PS1 mice”的研究论文,该研究揭示了AE能够通过激活ADRB2/β2肾上腺素能受体来逆转自噬-溶酶体缺陷,从而显著减轻APP-PSEN1/PS1小鼠中的淀粉样蛋白β病理。分子机制研究发现,AE可以通过上调AMP激活蛋白激酶(AMPK)-MTOR(雷帕霉素靶点激酶)信号通路来逆转自噬缺陷。
AE可以通过上调VMA21水平来逆转V-ATPase功能。通过使用普萘洛尔(拮抗剂,30μM)抑制ADRB2可以阻断AE减轻Aβ病理和认知缺陷,通过抑制自噬-溶酶体通量。AE可能通过多种途径缓解AD,而ADRB2-VMA21-V-ATPase通过增强Aβ通过自噬-溶酶体途径的清除来改善认知功能,这也为AE减轻AD的病理进展和认知缺陷提供了新的理论基础。

阿尔茨海默病(AD)是一种进行性神经退行性疾病,是最常见的痴呆形式。由于全球人口老龄化,全球有超过5500万人患有痴呆,到2050年这一数字将增加到约7800万人。有强烈的证据显示,淀粉样蛋白β(Aβ)的积累是AD发病和神经退行的关键事件。Aβ在自噬-溶酶体中的缺陷导致其积累和聚集,引发病理标志,包括过度磷酸化的MAPT/tau、突触损伤和退行、线粒体功能障碍和神经元丧失。
APP(淀粉样蛋白前体蛋白)、PSEN1(presenilin 1)和PSEN2(presenilin 2)基因的突变是家族性AD的原因。然而,95%以上的AD病例是散发性的,没有明确的原因。重要的是,越来越多的证据表明,神经细胞Aβ吞噬和清除的损害是晚发性AD的重要前奏。因此,大量研究集中在发现能够促进Aβ清除的有效药物上,包括Aβ抗体和Aβ分泌酶抑制剂。然而,它们大多数都未能减轻认知缺陷,并引起副作用,包括神经炎症和其他神经病理。
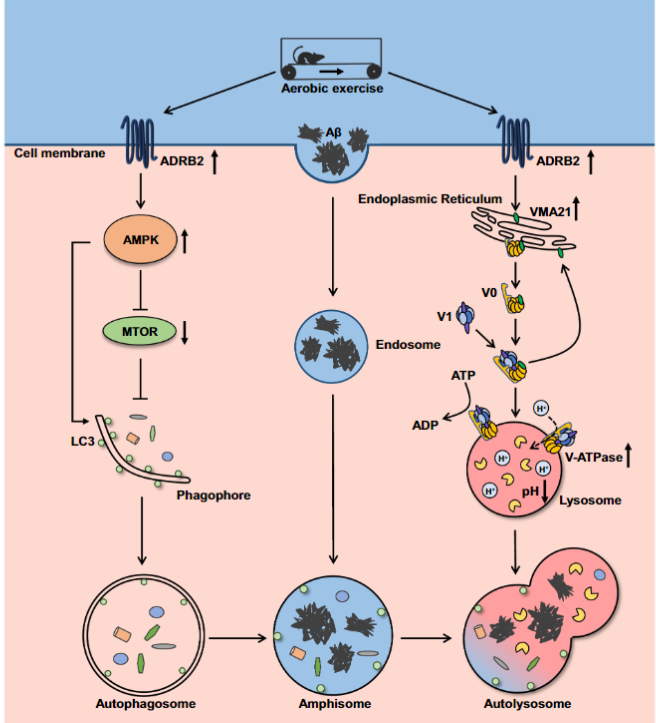
模式机理图(图片源自Autophagy )
相反,人们已经付出了很大努力,探索可能减轻记忆障碍的有效生活方式,包括认知训练计划、有氧运动(AE)、饮食等。这些研究为AD的预防和治疗带来了新的视角。长期以来,AE一直被研究作为预防和辅助治疗措施,用于心血管疾病、肥胖症、抑郁症、焦虑症和痴呆等身体和精神障碍。一些研究表明AE干预对AD患者的认知障碍有益。最近的荟萃分析证据表明,AE或体育活动可能是减缓潜在AD患者和受影响患者认知衰退的潜在策略。AE或运动干预可能会降低AD相关病理生物标志物的水平,如过度磷酸化的MAPT/tau和淀粉样负荷。然而,AE在患者中的保护机制仍不清楚。
自噬是细胞质大块内容物、异常蛋白聚集物和过时或受损细胞器的自溶体降解的主要途径。它通常由生理和病理过程以及来自异常蛋白、聚集物和受损细胞器的细胞应激激活。它还在Aβ的降解中发挥关键作用,提高自噬已被证明可以降低AD中的Aβ水平。事实上,自噬功能障碍在包括AD在内的神经退行性疾病中发挥作用。此外,在AD中,自噬功能障碍还可能受到V-ATPase(溶酶体型H+跨膜ATPase)和BECN1(beclin 1)减少的影响。
在AD大脑中,神经元的自噬过程减少,表现为自发神经瘤内大量自噬泡积累,包括自噬体和自溶小体。然而,分子机制尚不清楚。V-ATPase组装因子VMA21是V-ATPase的必需组装分子,它在自噬泡性肌病和滤泡性淋巴瘤中发挥重要作用。VMA21缺陷提高溶酶体pH,导致溶酶体降解能力下降并抑制自噬。V-ATPase活性是自溶体酸化的关键条件。重要的是,V-ATPase活性降低导致Aβ在AD小鼠模型大脑中增积在增大的去酸自噬体内,形成老年斑。然而,降低的V-ATPase活性,尤其是在AD中的机制,鲜有报道。
该研究揭示了AE可以逆转自噬-溶酶体缺陷,显著减轻Aβ病理和认知损害,其机制涉及ADRB2介导的V-ATPase组装因子VMA21信号通路。AE通过上调VMA21水平来逆转V-ATPase功能,伴随着MTOR(雷帕霉素靶点激酶)信号通路的抑制。通过普萘洛尔(prop)(拮抗剂,10μM)抑制ADRB2可以阻断AE减轻Aβ病理和认知缺陷,通过抑制自噬-溶酶体通量。总之,该研究表明,AE可以通过上调ADRB2-VMA21-V-ATPase途径来减轻Aβ病理,这也揭示了AE减轻AD病理进展和认知缺陷的新的理论基础。
原文链接:
https://doi.org/10.1080/15548627.2023.2281134


