Nucleic Acids Res:神母细胞瘤模型探究细胞周期进展与SWI/SNF活性作用
时间:2023-12-10 22:37:05 热度:37.1℃ 作者:网络
染色质重塑是基因表达动态调控的重要机制之一。染色质重塑复合物SWI/SNF在转录调控因子作用下被募集到DNA区域,依赖ATP酶活性水解ATP获得能量解开DNA,通过转录调节因子和暴露的DNA结合实现基因表达调控。约20%的恶性肿瘤中,SWI/SNF的相关基因发生一个或多个突变。而在依赖SWI/SNF活性的癌症中使用小分子药物抑制ATP酶活性可产生抗肿瘤作用,但作用机制尚不明确。
近日,美国贝勒医学院 Dr. Courtney Hodges 课题组在 Nucleic Acids Research 发表题为 Reactivation of the G1 enhancer landscape underlies core circuitry addiction to SWI/SNF 的研究论文,以神经母细胞瘤(Neuroblastoma)为模型探究细胞周期进展与 SWI/SNF ATP 酶活性之间的关系,揭示SWI/SNF活性在细胞周期G1-S转变中的关键作用。SWI/SNF失活可明显阻滞细胞周期从G1到S期的过渡,并增强临床用药异维甲酸阻滞细胞周期的能力。

为什么选择神经母细胞瘤来探讨细胞周期进展与SWI/SNF之间的关系呢?本文通讯作者Dr. Hodges接受编辑采访时提到:“与许多其他具有复杂突变模式的癌症不同,神经母细胞瘤很少有突变,通常是由基因表达变化驱动的。这类肿瘤非常适合探究基因表达是如何随时间变化的。此外,我们知道神经母细胞瘤依赖于SWI/SNF活性,这也为研究细胞周期中基因激活与SWI/SNF活性之间的互作关系提供了一个很好的平台。最主要的是有许多孩子患有高危神经母细胞瘤,存活率低,甚至会产生治疗副作用,这种迫切的需求也使得神经母细胞瘤成为回答这些问题的有力原因。”
SMARCA4是SWI/SNF复合体中具有ATP酶活性的蛋白,用小分子抑制剂BRM014抑制SMARCA4活性后,细胞活力丧失(图1A和B),并且携带神经母细胞瘤的小鼠经过治疗后肿瘤生长减缓,体重无明显变化(图1I-M),表明SMARCA4在体内和体外都是神经母细胞瘤的药理学潜在靶点。经过转录因子基因序列分析后,发现SWI/SNF失活导致带有肾上腺素能核心调控回路(CRC)转录因子motifs的DNA可及性显著降低,提示CRC转录因子与染色质的结合依赖于SWI/SNF催化活性。
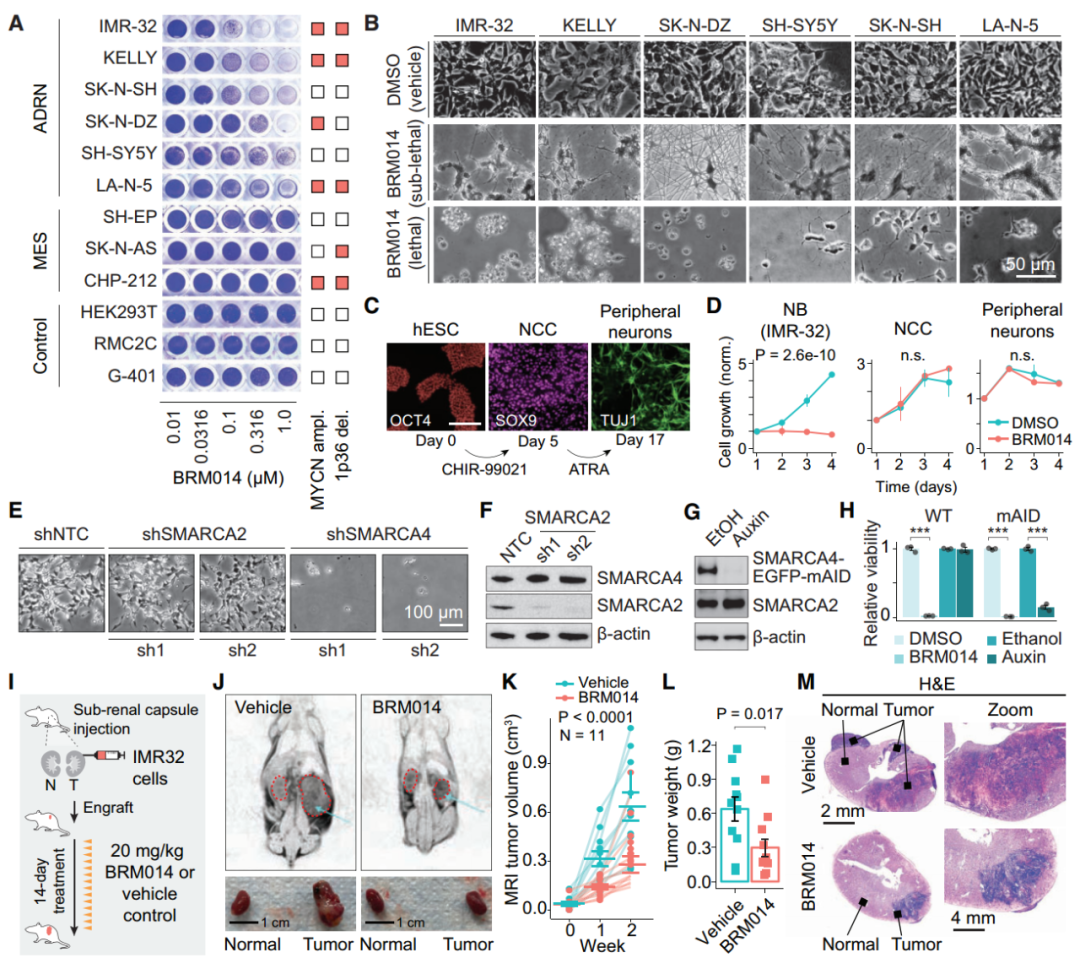
图1. SMARCA4是肾上腺素能性神经母细胞瘤的特异性靶向基因。
值得注意的是,转录因子GATA3在SWI/SNF活性被抑制后仍保持与染色质相互作用(图2B),而其他CRC转录因子表现出高度相似的全基因组变化模式(图2C),这表明CRC中存在驱动型转录因子,且SWI/SNF催化活性的产生需要转录因子之间相互作用。此外,在BRM014处理1小时内,PHOX2B基因座上SMARCA4依赖性CRC转录因子的结合快速丧失(图2F),SWI/SNF的持续失活会导致神经母细胞瘤细胞系中PHOX2B蛋白水平降低(图2G)。这表明SWI/SNF同时参与染色质占有率的调控和CRC成员的表达,SWI/SNF的抑制会导致CRC自动调节回路在1小时内迅速崩溃。
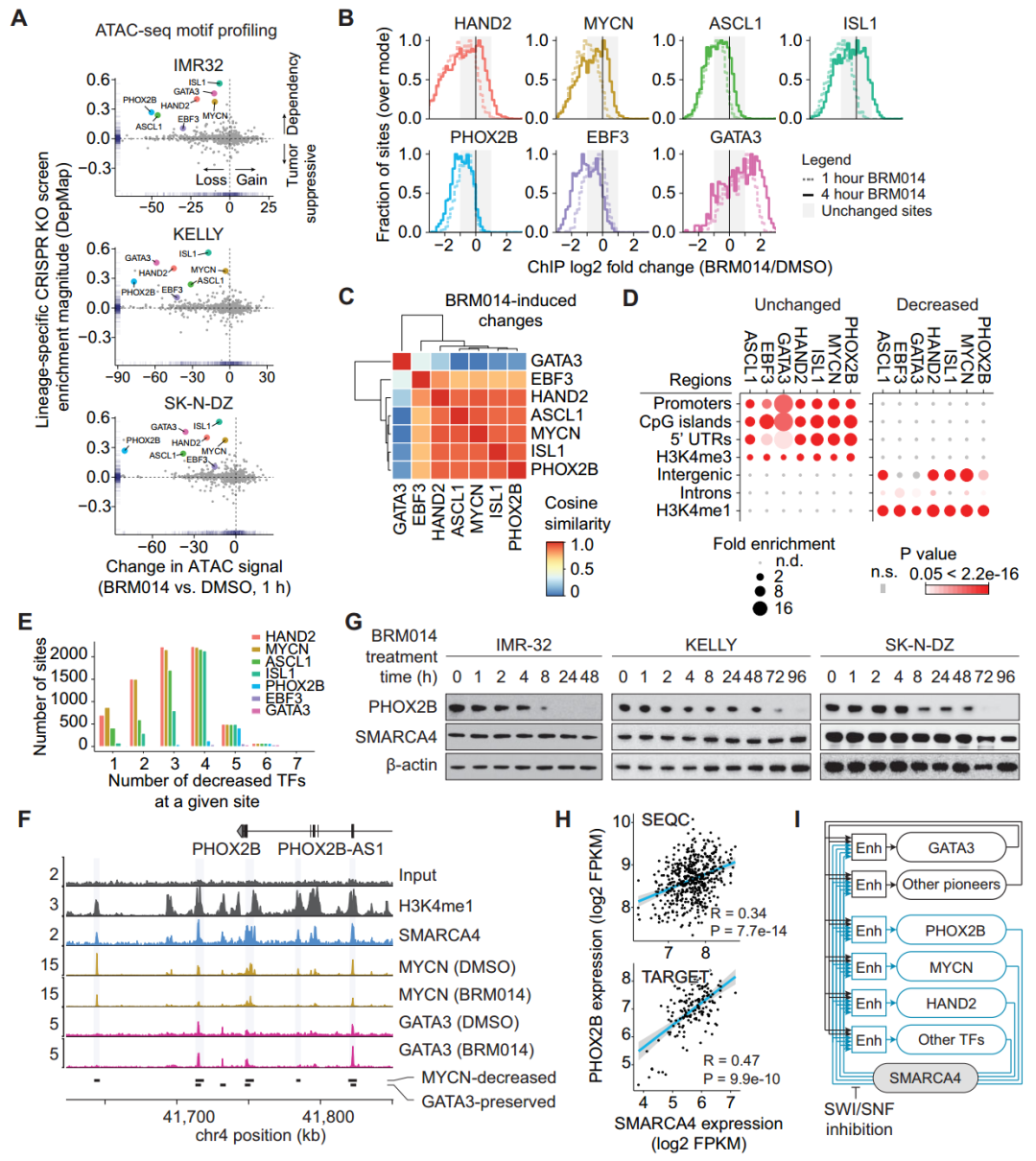
图2. SMARCA4维持肾上腺素能CRC增强子的结合和表达
经过BRM014处理后,肾上腺素能神经母细胞瘤细胞在S期转录本丢失(图3A-B),靶向降解SMARCA4后也观察到类似的转录变化。通过对MYCN扩增和非扩增的肾上腺素能神经母细胞瘤进行细胞周期分析后发现,BRM014导致神经母细胞瘤的G1细胞周期阻滞(图3C)。经过BRM014治疗后的小鼠肿瘤中G2/M期标志物表达降低(图3D),并且在神经母细胞瘤患者队列中,SMARCA4低表达与G1期的特征增加相关,表明SWI/SNF的失活在细胞、小鼠和人类肿瘤中都对细胞周期进程造成影响。
作者使用不同药物处理S期同步的IMR-32细胞,观察到DMSO处理的细胞在细胞周期阶段之间变化,BRM014处理的细胞成功完成S、G2和M期,但阻滞在G1期,而DNA损伤诱导剂处理后的细胞完成了S期,阻滞在G2/M期(图3G)。结果表明SWI/SNF失活对细胞周期进程的作用方式不同于DNA损伤造成的G2/M期阻滞,在G1期和G1-S转换中起着至关重要的作用。
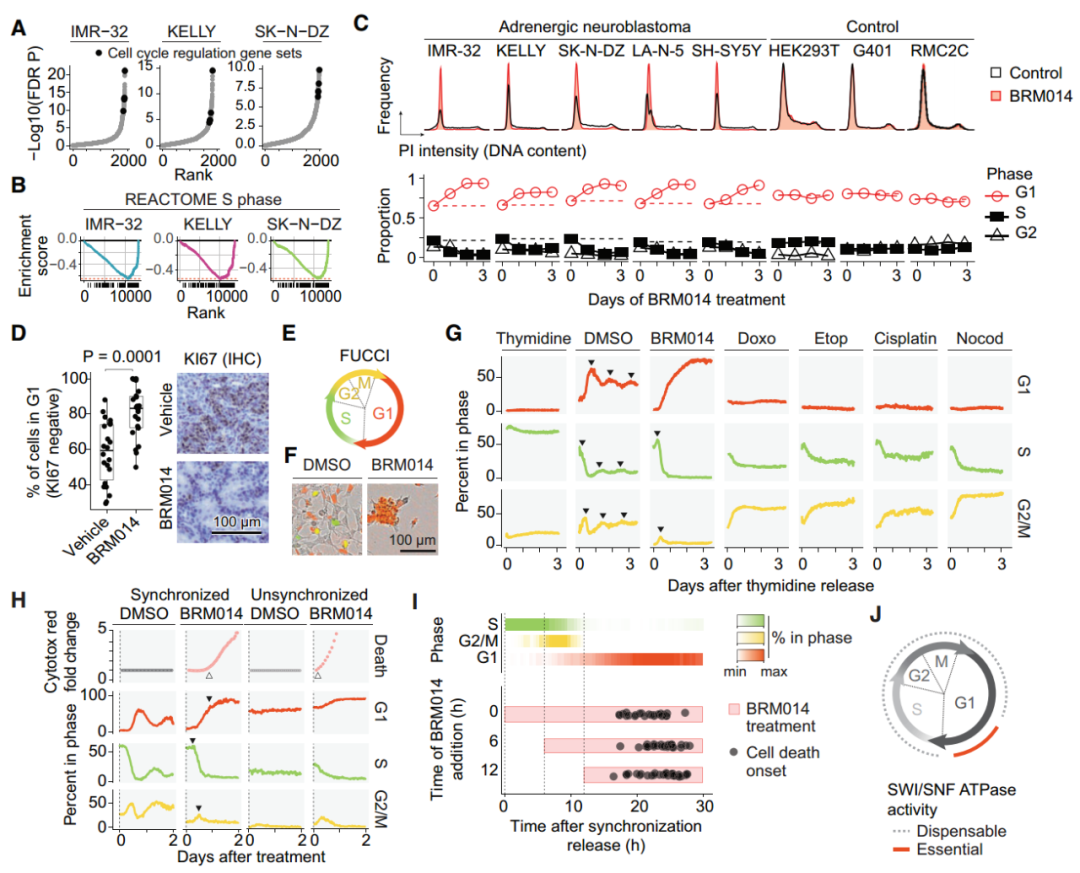
图3. G1-S转变代表了SWI/SNF抑制的敏感性窗口。
接下来作者通过绘制细胞周期中SMARCA4结合位点全基因组可及性的时间变化,发现经鉴定的14436个SMARCA4结合位点中,13289个位点至少在一个细胞周期阶段与DNA可及性峰重叠,对SMARCA4靶向位点聚类分析,发现存在3个具有不同时间模式的聚类,簇1中的位点在G1期可及性最高,而簇2在S期达到峰值,簇3在G2期可及性升高。经过BRM014处理,簇1在SWI/SNF催化抑制作用下DNA可及性降低幅度最大。对每个簇的基因组区域的注释显示,簇1在基因间区域富集,与增强子一致,在SWI/SNF催化抑制作用下DNA可及性降低幅度最大(图4A-D),这表明对SWI/SNF活性依赖最高的位点是G1期可及性达到峰值的增强子,再次说明SWI/SNF活性在G1-S转变中是至关重要的。
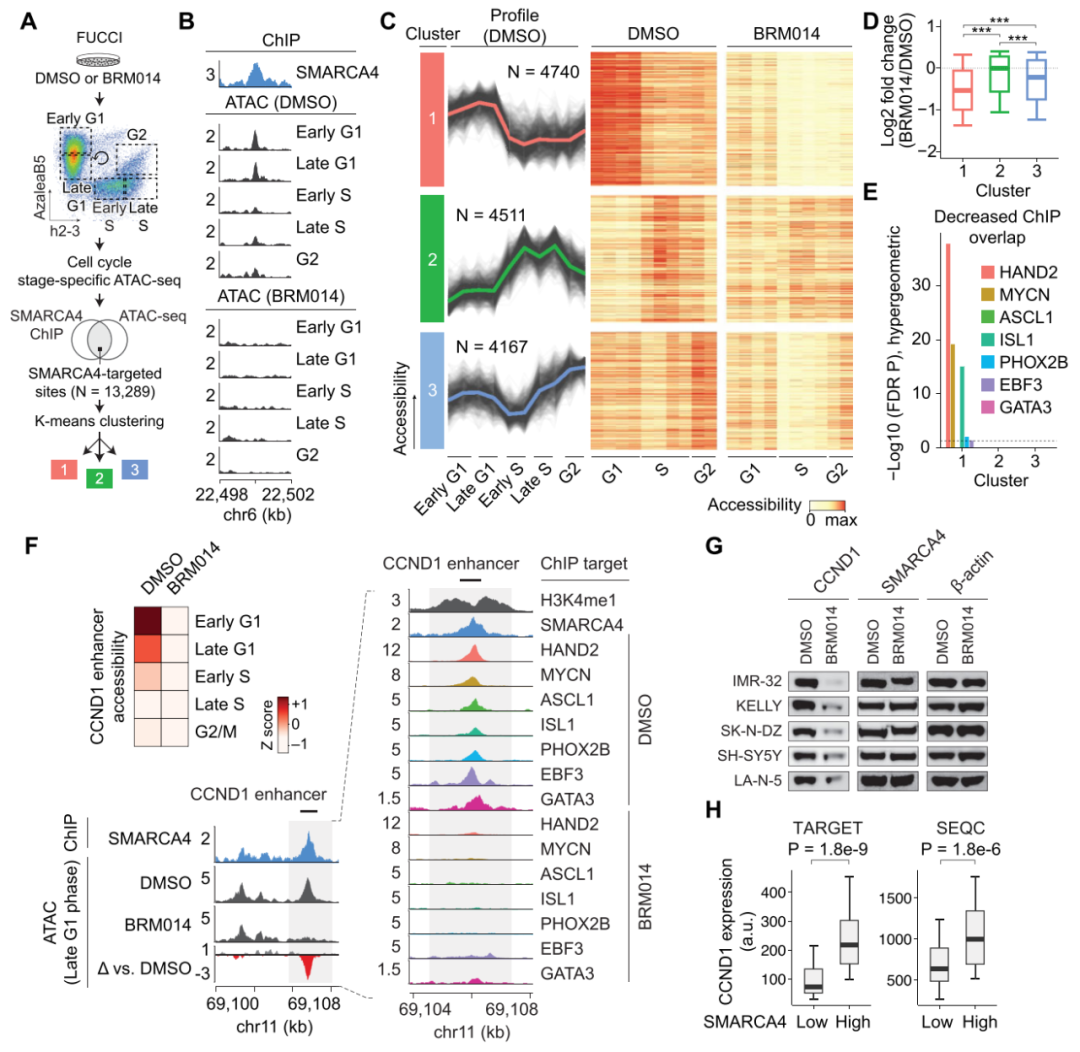
图4. 对SWI/SNF活性依赖性最高的位点是G1期可及性达到峰值的增强子。
异维甲酸是神经母细胞瘤中使用最广泛的神经分化诱导剂之一,可以诱导细胞G1期阻滞,进而使神经母细胞瘤分化以达到治疗肿瘤的作用(图5A)。同时使用BRM014和异维甲酸后,通过药物协同作用的Loewe相加性和等值线图分析发现BRM014处理增加了细胞对异维甲酸的敏感性(图5F-H),但是与使用抑制靶向S期或G2/M期的药物未观察到协同作用(补充图11C),这表明SWI/SNF失活可促进G1期分化,并增强异维甲酸诱导细胞周期退出的能力。
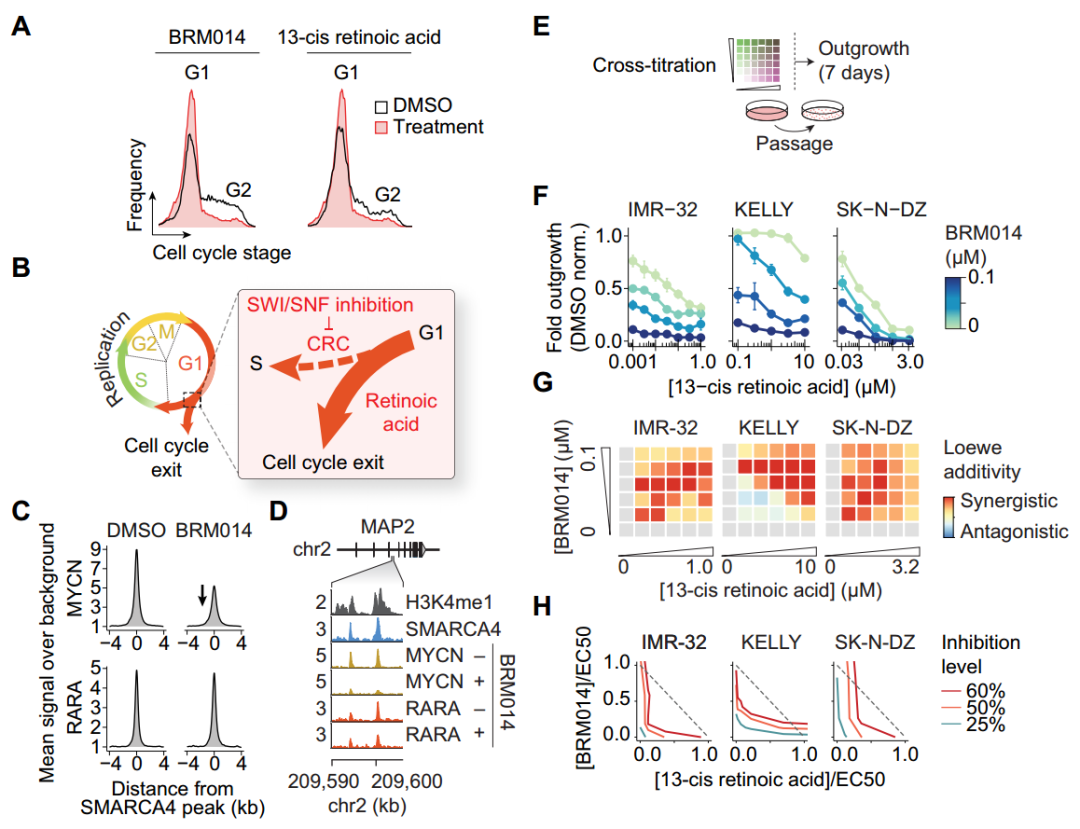
图5. SWI/SNF抑制与异维甲酸协同作用,促进G1期细胞周期退出。
除神经母细胞瘤外,SWI/SNF ATP酶活性已成为急性髓性白血病(AML)、前列腺癌(PRAD)和葡萄膜黑色素瘤(UVM)等其他几种癌症的关键致癌依赖因素,与神经母细胞瘤中的发现一致,经BRM014处理使SWI/SNF失活后,细胞系在G1期阻滞(图6A),而在不需要SWI/SNF的细胞系中未观察到类似结果(图6B)。通过分析人AML、PRAD和UVM肿瘤队列的数据,发现SMARCA4的低表达与G1增加和G2特征减少相关(图6C-D),这表明SWI/SNF活性在SWI/SNF成瘾癌症中起着至关重的作用。此外作者在AML、PRAD和UVM细胞系中也发现BRM014增强了癌细胞对异维甲酸的敏感性(图6E),证实了SWI/SNF在不同对其依赖的癌症中调控细胞周期的普遍性。正如Dr. Hodges所言,“我们在这些不同的癌症环境中发现了一个惊人的共同特点,即G1期的细胞周期控制是SWI/SNF驱动这些不同癌症的主要原因,并且许多受SWI/SNF调控的位点仅在G1期激活,这表明染色质重塑远比我们之前认为的更加复杂。”
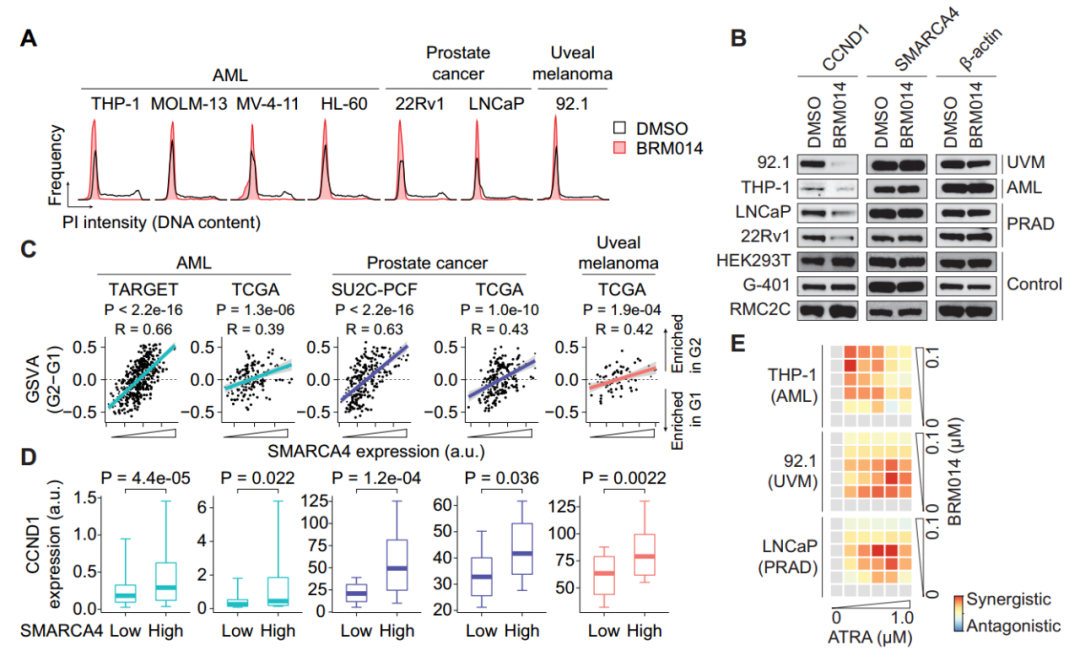
图6. SWI/SNF抑制增强视黄酸治疗G1成瘾癌症。
综上,这项研究揭示了SWI/SNF通过特异性调控G1期促进肿瘤生长,抑制SWI/SNF活性可改善临床上异维甲酸的治疗效果。本文合作者,复旦大学青年研究员陶灵认为,该研究为神经母细胞瘤和其他SWI/SNF依赖性癌症的治疗提供了新思路,有助于未来更好地靶向应对这类癌症。
DOI: 10.1093/nar/gkad1081


