读书报告 | 从单细胞组学了解肿瘤内皮细胞的异质性和功能
时间:2023-12-14 18:41:56 热度:37.1℃ 作者:网络
导读
肿瘤内皮细胞(tumor endothelial cells,TECs)是肿瘤微环境内促进肿瘤进展和转移的关键部分。抗血管生成疗法通过抑制血管生成和内皮细胞,给多种类型的癌症患者中带来临床和生存益处。然而,在不同患者间,抗血管生成疗法存在显著的疗效差异和耐药问题,提示肿瘤内皮细胞具有明显异质性。
作者综述了迄今为止所有在单细胞水平上研究过的人类TECs的异质性。其中,大多数人类肿瘤中仅包含一小部分血管生成相关TECs,即被认为是AATs的靶点的TECs,这可能是导致抗血管治疗疗效有限和耐药性的原因之一。总体而言,TECs在所有肿瘤类型内和不同肿瘤类型之间都存在异质性,但由于缺乏统一的内皮细胞命名法和一致的单细胞分析方案,目前比较肿瘤间的TEC表型具有较大挑战性,需要对方法进行统一。
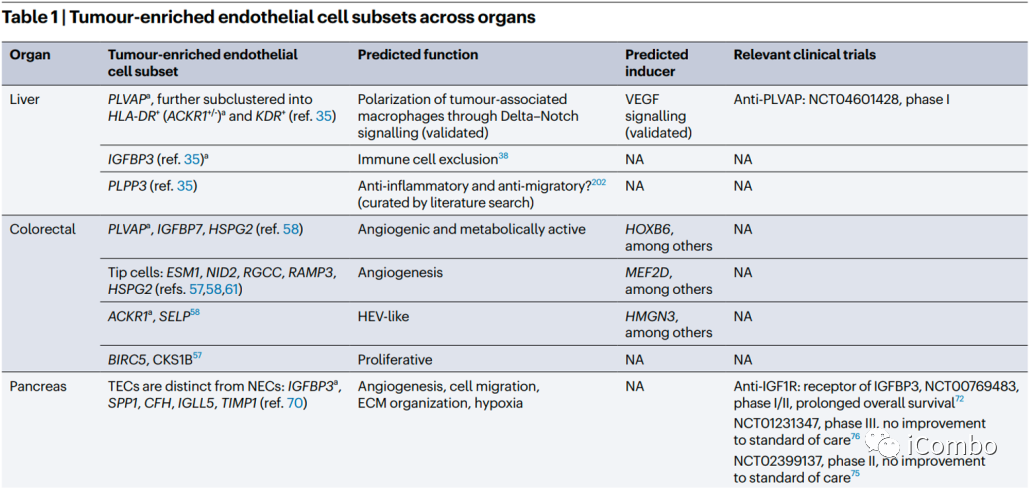
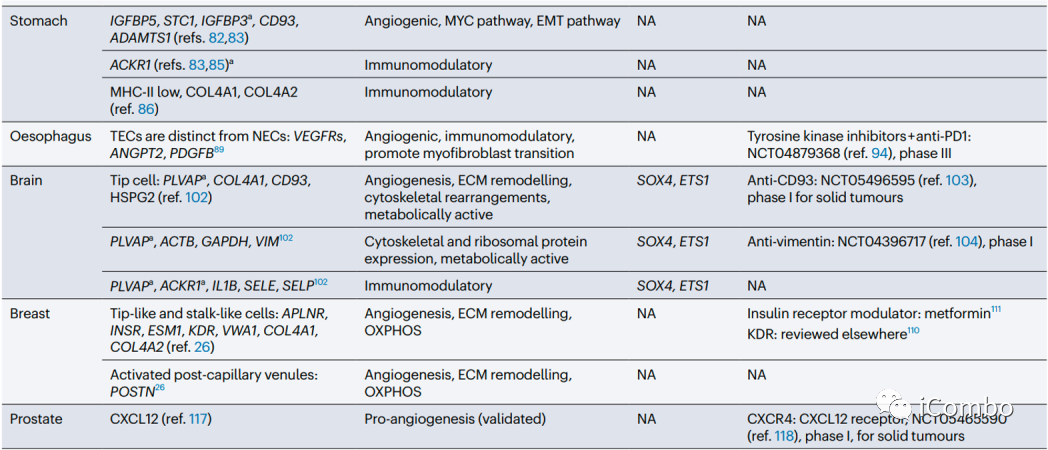
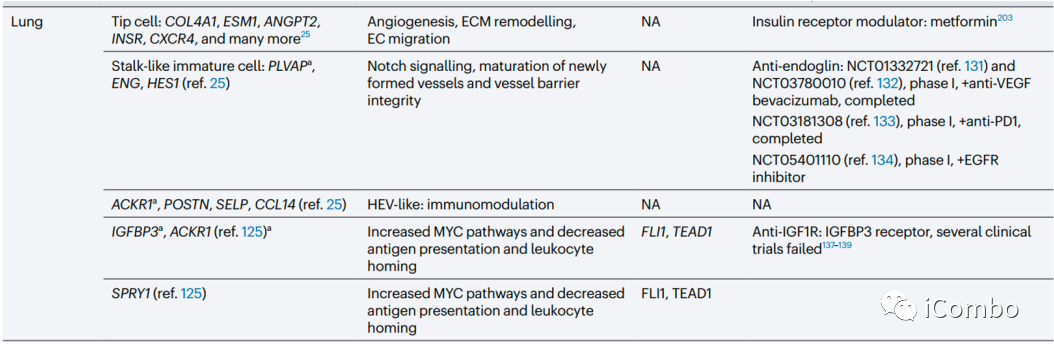
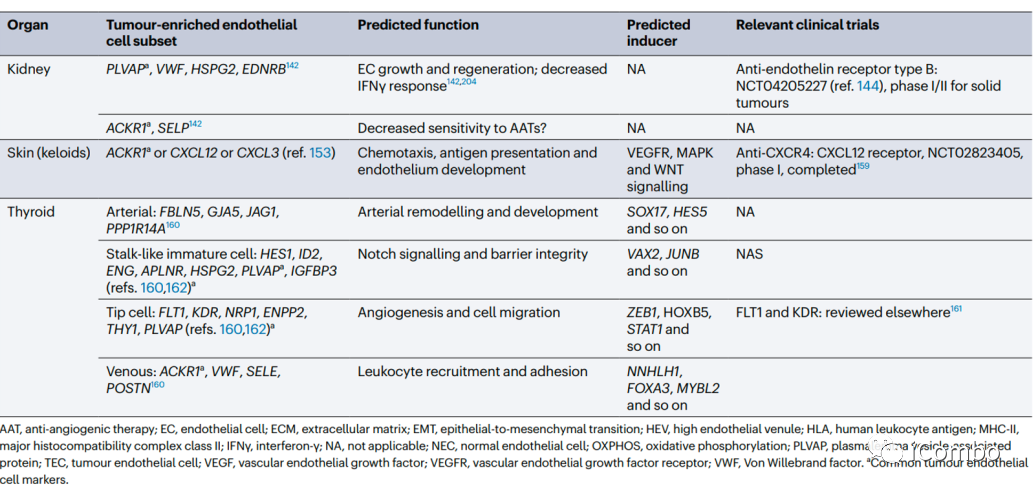
在大多数肿瘤中,ACKR1、PLVAP和IGFBP3是可以确定为通用的TEC标记物。除了血管生成,其他生物学过程如免疫调节和细胞外基质构成等是不同肿瘤类型中TECs预测富集的常见特征。靶向血管生成和细胞外基质已被考虑用于抗血管生成疗法(但未能如愿成功),TECs的免疫调节特性尚未被充分考虑作为一种新的抗肿瘤治疗方法。综述后续还讨论了抗血管生成疗法发展的进展、限制、利用单细胞组学寻找解决方案和新的靶点的可能(Nat Rev Cancer.2023 Aug;23(8): 544-564. doi: 10.1038/ s41568-023-00591-5)。
Background

肿瘤内的EC异质性
治疗和联合治疗的指导意义
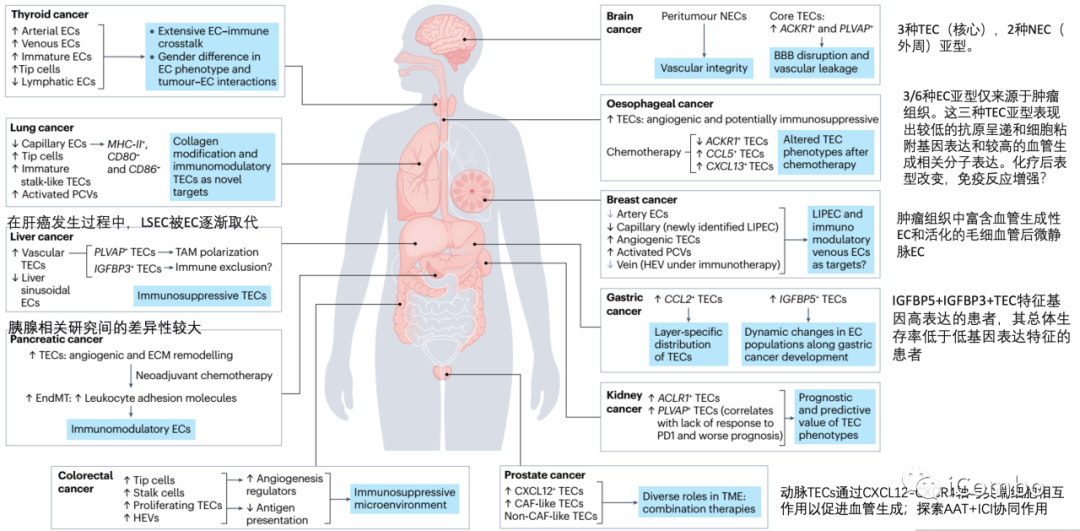
跨器官比较
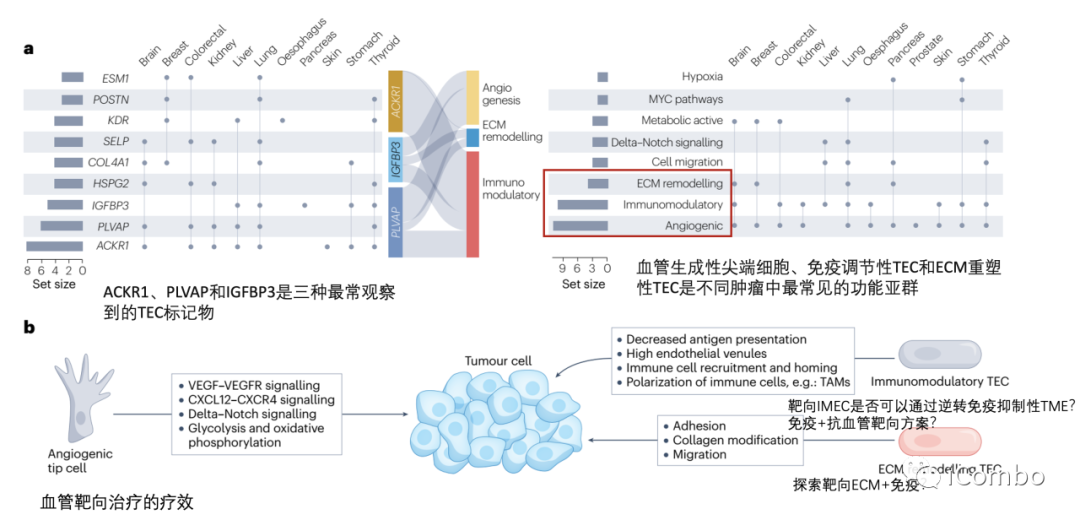
展望
利用TEC单细胞组学数据的策略
TEC图集 许多研究没有对 EC 进行足够详细的研究,限制了本文的回顾性分析。另外,现有研究对EC的命名不同,这使跨研究甚至跨器官的比较与分析具有挑战性。可以通过对所有公开的肿瘤研究进行联合分析,扩大EC 单细胞数据集的规模,解决上述问题。
靶向内皮细胞免疫调节 越来越多的证据表明,内皮细胞参与免疫反应,即IMECs。临床中,抗血管靶向治疗可以增强肿瘤免疫细胞的浸润,并与ICB等免疫增强疗法协同作用。scRNA-seq的最新进展进一步强化了内皮细胞亚群具有免疫调节作用的观点。
确定靶点的优先次序 利用scRNA-seq数据为选择可用于癌症治疗的基因。综合不同组学及跨物种分析,确定候选基因/蛋白的优先级。
未来TEC研究的新技术
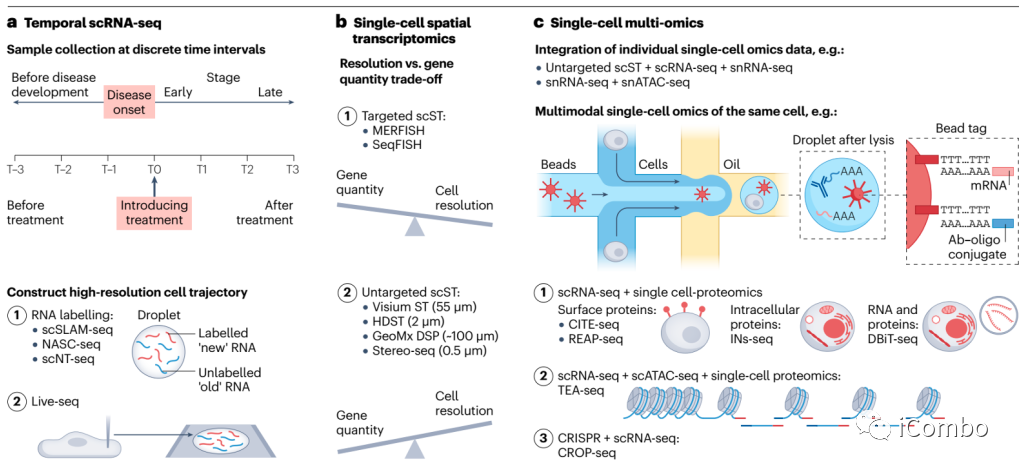
同一细胞多维度:基因组(DNA拷贝数)、表观基因组(染色质可及性和DNA甲基化)、转录组学、蛋白质组学、代谢组学。
结合算法及采样时间、分析技术,时间+空间单细胞组学。
总结
研究不充分:单细胞组学技术在回答异质性问题方面非常强大。几乎所有类型的癌症都已通过scRNA-seq进行了分析。然而,由于肿瘤组织中EC的稀缺性,以及与肿瘤浸润性免疫细胞相比,非免疫基质细胞的回收率较低,许多scRNA-seq研究未能充分详细地表征部分EC。
认知不深入:现有数据表明,癌症中的EC是异质的,TEC与NEC相对异质。TEC簇表达具有促肿瘤特性的显著改变的基因特征,特别是与血管生成、ECM重塑和免疫调节有关。(TECs在不同类型的肿瘤中的特征不太一致,部分原因是命名不同)TEC在肿瘤发生发展,及在肿瘤治疗中的潜在作用?进一步探索与回答!
角度不全面:RNA水平不一定反映功能或与功能相关,需要多组学和功能验证的结合。包括来自患者治疗前后的时间和空间维度的额外单细胞组学数据,以及临床疗效相关数据。


