【BCJ】CAR-T细胞输注前减少和控制代谢活性肿瘤体积可改善LBCL生存结局
时间:2024-03-15 18:00:28 热度:37.1℃ 作者:网络
CAR-T
对于复发或难治性大B细胞淋巴瘤(r/r LBCL)患者,CD19 CAR-T细胞疗法显著改善了患者的结局。但从确定CAR-T治疗到细胞输注之间的总时间可能长达4-6周,因此许多患者可能需要在单采和输注之间接受桥接治疗,以限制疾病进展、减轻淋巴瘤相关症状和/或缩小肿瘤体积。
桥接治疗是可行、安全、有效的,包括全身性治疗(如化疗、靶向治疗或类固醇)、放疗或两种方法联合。为精确确定桥接治疗反应的特征,还需要确定不同桥接后的肿瘤体积缩小与CAR-T细胞治疗结局之间的关系。利用18F-FDG PET/CT测量代谢活性肿瘤体积(metabolic active tumor volume,MATV)可对肿瘤体积进行量化,MATV是疾病负荷的指标且可指示整个身体的总代谢活性肿瘤体积。基线时和清淋化疗(LD)前确定的MATV可获得关于桥接治疗疗效的精确和客观信息,因此学者开展一项研究,旨在研究MATV和MATV动力学(从基线至LD前)与CAR-T细胞治疗结局和毒性之间的关系,以及不同的桥接策略对r/r LBCL患者MATV和CAR-T结局的影响。研究结果近日发表于《Blood Cancer Journal》。

研究结果
患者和治疗特征
该研究纳入荷兰格罗宁根大学医学中心接受axicabtagene ciloleucel (axi-cel)治疗的74例r/r LBCL患者(排除CNS受累),在基线(单采前)和LD前(桥接治疗后,清淋化疗前)进行18F-FDG-PET扫描。患者特征见表1。
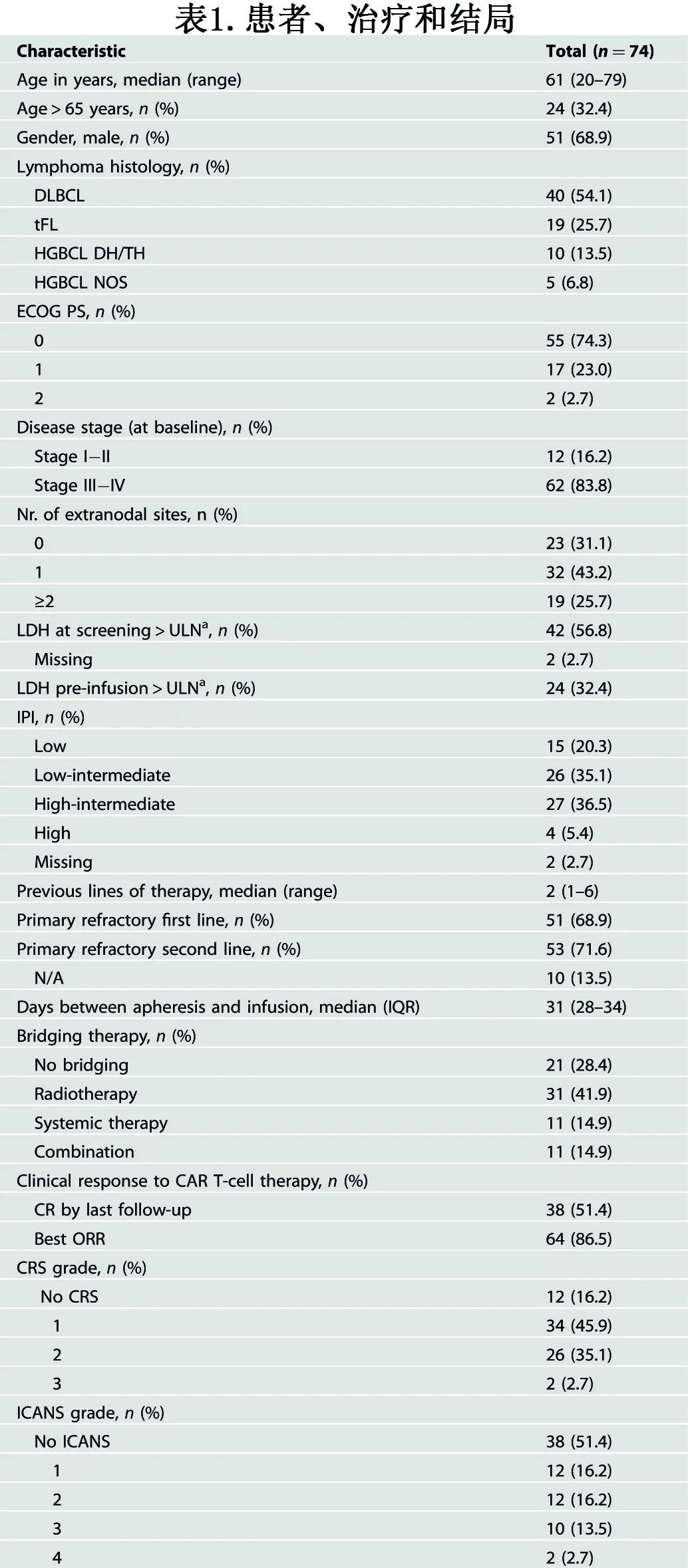
中位年龄61岁,大多数患者为III/IV期(83.8%)、结外部位受累(68.9%)、ECOG体能状态0~1分(97.3%)。基线时27例(36.5%)患者为IPI为高-中危,4例(5.4%)为高危。筛选时中位LDH为275 U/L,输注时为219 U/L。大多数患者为化疗难治性疾病,包括一线治疗(68.9%)和二线治疗(71.6%)原发难治。
大多数患者接受CAR-T作为三线治疗(93.2%)。从单采到CAR-T细胞输注的中位间隔时间为31日。53例(71.6%)接受桥接治疗,其中最常应用的是放疗(31例;41.9%),此外11例(14.9%)接受全身治疗,11例(14.9%)接受联合治疗。CAR-T细胞疗法的总缓解率(ORR)为56.8%,单采后的中位随访时间为12.0个月;最佳ORR为86.5%,其中CR 73.0%,PR 13.5%,13.5%的患者疾病进展为最佳缓解。CAR-T细胞输注后21例患者出现疾病进展,22例患者死亡,多数死亡原因为输注CAR-T细胞后疾病进展或复发(n=21),此外1例患者因重度ICANS死亡。中位TTP和OS均未达到,2年TTP率为71.6%,2年OS率为70.3%。62例(83.8%)发生所有级别CRS,其中≥2级有28例(37.8%),≥3级CRS有2例(2.7%);36例(48.6%)患者发生ICANS,其中24例(32.4%)为≥2级ICANS, ≥3级ICANS有12例(16.2%)。
基线和清淋化疗前的MATV特征
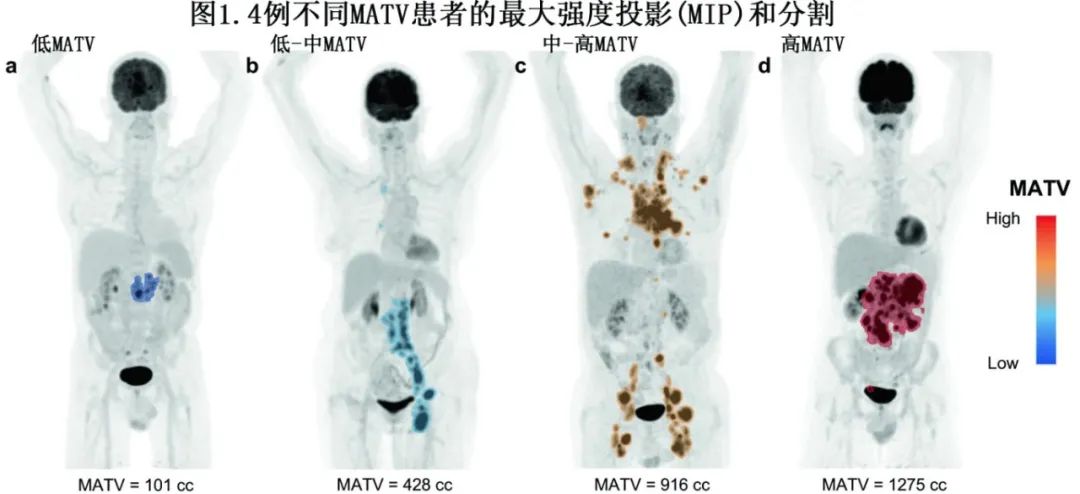
从基线18F-FDG-PET到单采的中位时间为12天,而从LD前18F-FDG-PET到输注的中位时间为6天。所有患者(n=74)均接受基线18F-FDG-PET扫描,其中68例有LD前扫描。图1描绘了不同病变程度患者的分割和MATV值,以说明低MATV值和高MATV值的视觉差异。
全组74例患者的基线中位MATV为180 cc,LD前增加到241 cc,但与基线无显著差异(p=0.795;68例;图2a)。未接受桥接治疗的患者MATV显著增加(p=0.008),基线中位MATV为62 cc,LD前为147 cc。接受放疗的患者MATV下降但不显著,基线MATV中位数300 cc,LD前下降到217 cc (p=0.193);接受全身治疗的患者也是如此,分别为341 cc 和268 cc (p=0.193);而接受联合治疗的患者的基线MATV中位数为398 cc,LD前中位数为675 cc,增加但不显著(p=0.577)。
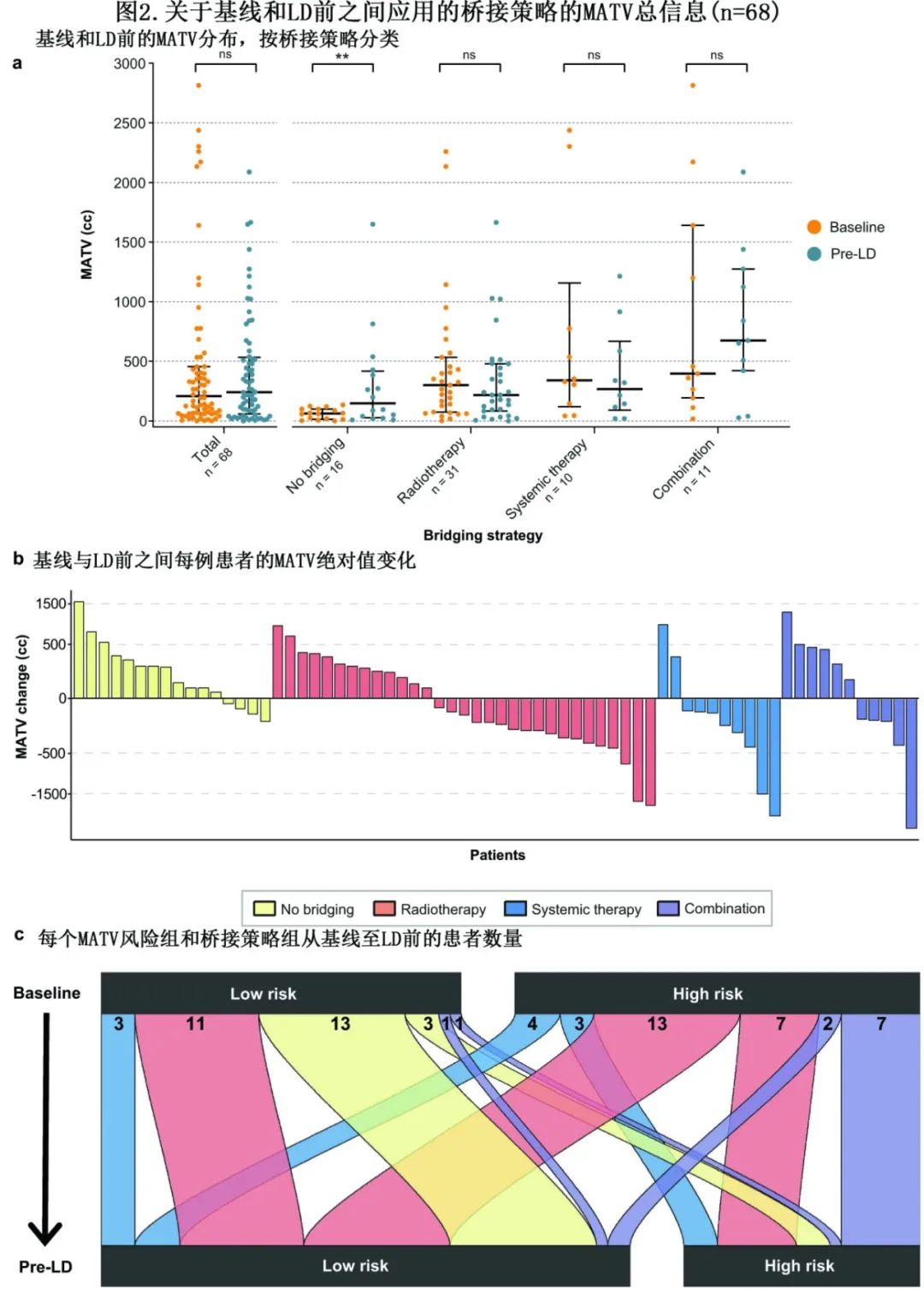
每例患者中桥接对MATV的影响如图2b所示。桥接放疗的患者多实现MATV;当患者出现外场(outfield)进展时则MATV增加。全身性治疗和联合治疗的缓解情况比较复杂,而未接受桥接治疗的患者总体呈增加(因此进展),与图2a一致。
MATV与TTP和OS的关系
基线和LD前预测2年TTP的MATV最佳界值分别为190 cc和480 cc。基线时低MATV患者的TTP(86.9%)显著优于高MATV患者(51.7%;p<0.001) (图3a);总生存率同样如此,分别为85.0%和 38.5% (p<0.0001) (图3d)。
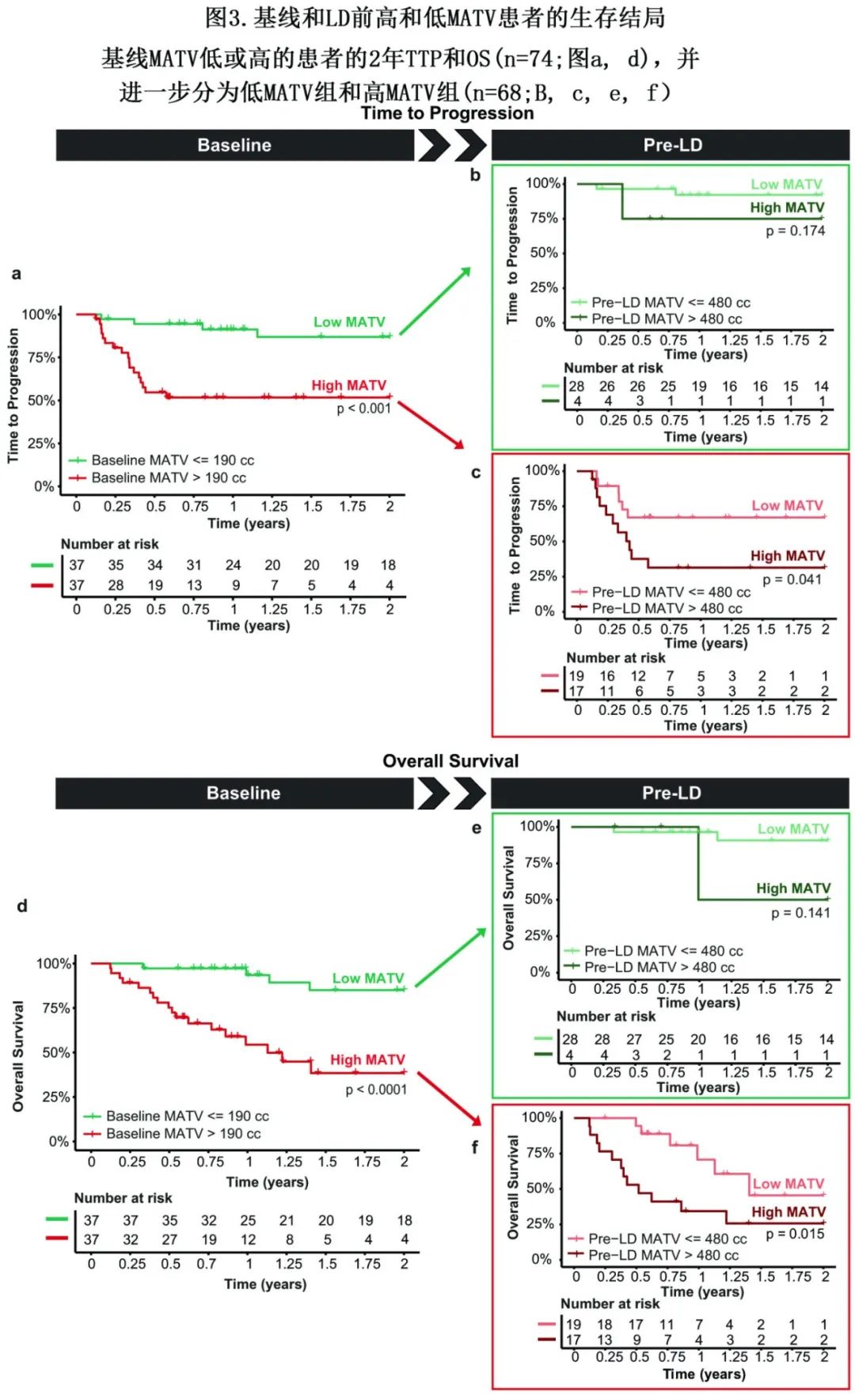
桥接期后,相对于整个桥接过程中保持较高MATV的患者(2年OS率31.4%;图3c下线),最初基线为高MATV (图3a下线)的患者如果成功桥接到低MATV(2年OS率67.1%;图3c上线),则TTP显著改善(p=0.041)。在OS中也观察到类似的趋势(图3f;P=0.015)。相对于此,基线MATV和LD前MATV均高的患者中位TTP和OS分别低至5.1个月和6.2个月,2年OS率分别为31.4%和25.7%。这表明,对于初始MATV基线值较高的患者,通过桥接治疗有效控制MATV后可显著改善TTP和OS。
基线时低MATV (图3a上线, 图3d上线)且在LD前保持低MATV的患者具有最佳的TTP (92.2%;图3b上线)和OS (90.8%;图3e上线)。但如果基线低MATV患者进展为LD前高MATV,则具有较差的TTP率(75.0%;图3b下线)和OS率(50.0%;图3e下线),但只有4例患者,导致差异不显著(p>0.1)。
高MATV和低MATV组患者的桥接治疗
为进一步研究在MATV患者组中应用的桥接策略,患者从基线到LD前的风险路径如图2c所示。对于接受放疗且基线高MATV的患者,大多数在LD前转变为低MATV (n=13)。此外,接受放疗的基线低MATV患者(n=11)在LD前仍然较低,大多数未接受任何桥接治疗的患者也是如此(n=13)。此外,全身治疗和联合治疗的结果不一。
高MATV和低MATV组患者的特征
以基线MATV(高和低)和LD前MATV(高和低)形成4个风险组,4组在筛查时和输注前的LDH均不同(p=0.002),最高危组的中位LDH最大(筛查时的中位LDH为451;输注前LDH中位数315)。此外,性别、随访时间和最佳ORR在不同风险组间也存在差异;其他患者和治疗特征则无显著差异,包括年龄、IPI评分、结外部位数量、疾病分期、ECOG体力状态和一二线治疗原发难治。
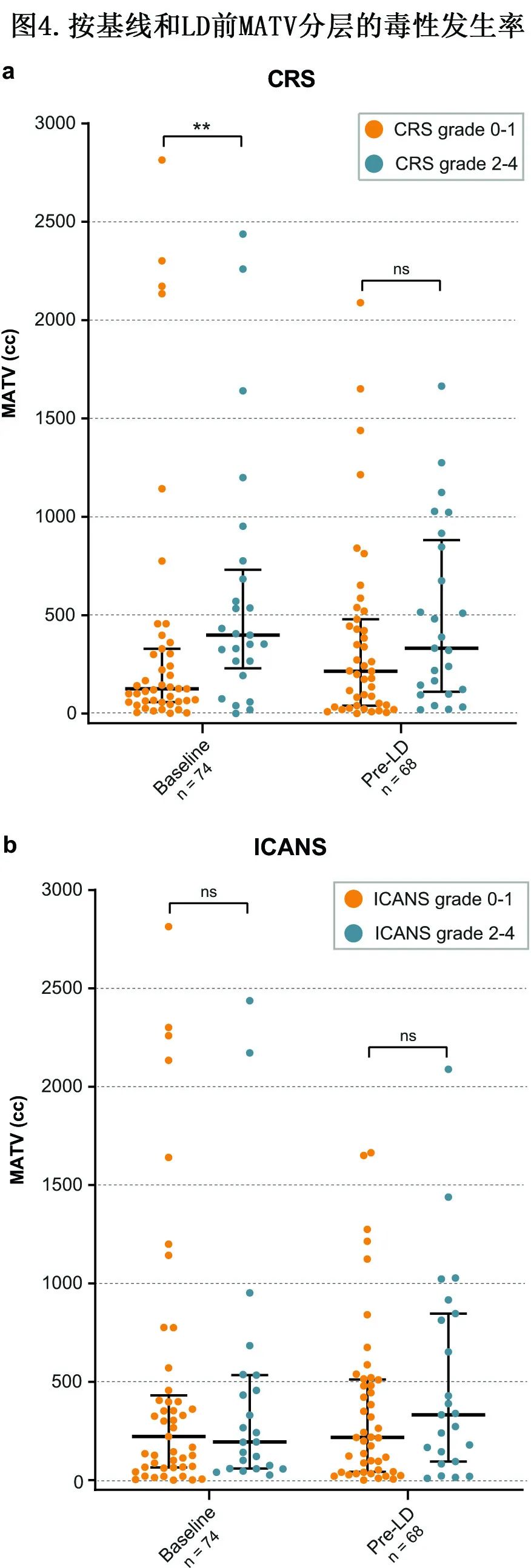
MATV与毒性的关系
与0-1级CRS患者(中位数125 cc)相比,CRS≥2级患者(中位数398 cc)基线MATV显著较高(p=0.008)(图4a);CRS≥2患者LD前MATV中位数也高于0-1级CRS患者(332 cc vs 215 cc)但无显著差异(p=0.131)。对于ICANS≥2级的患者,中位基线MATV (194 cc)低于ICANS 0-1级的患者(222 cc;P=0.827);LD前同样如此(217 cc vs 332 cc;p=0.374)(图4b),但差异不显著。
生存和毒性的单因素分析
单变量Cox回归分析显示,与基线低MATV相比,基线高MATV与较差的TTP相关(HR=5.97 ;P=0.001;表2),表明肿瘤体积较大的患者预后较差。高MATV基线和OS之间也观察到类似关联(HR=6.90;p<0.001)。此外,LD前高MATV与TTP(HR=4.56 ;p<0.001)和OS (HR=5.80;p<0.001) 具有相当的相关性。其他与TTP和OS显著相关的标记物包括LD前LDH (>ULN)、性别(仅适用于OS)和桥接治疗(仅适用于OS)。
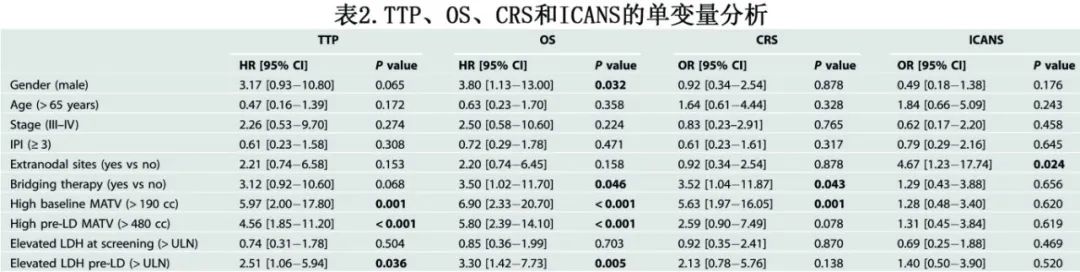
CRS≥2与基线高MATV (OR=5.63;p=0.001)和桥接治疗(OR=3.52;P=0.043) 显著相关,而ICANS≥2只与结外部位显著相关(OR=4.67;P=0.024)。
总结
对于CD19 CAR-T细胞治疗的r/r LBCL患者,与使用MATV测量的高基线肿瘤体积患者相比,低基线肿瘤体积患者有更好的TTP和OS,以及更低的重度CRS发生率。此外,对于基线肿瘤体积高的患者,通过桥接治疗有效缩小和控制肿瘤体积可改善生存结局,从而为采用更积极的桥接治疗方案提供依据。
参考文献
Keijzer, K., de Boer, J.W., van Doesum, J.A. et al. Reducing and controlling metabolic active tumor volume prior to CAR T-cell infusion can improve survival outcomes in patients with large B-cell lymphoma. Blood Cancer J. 14, 41 (2024). https://doi.org/10.1038/s41408-024-01022-w


