西南大学肖波/石潇潇团队《Biomaterials》:口服磁性植物脂质纳米药物系统协同治疗结直肠癌
时间:2024-03-16 20:00:40 热度:37.1℃ 作者:网络
结直肠癌(CRC)是世界第三大常见癌症,发病率和死亡率呈现逐年上升趋势,已成为严重威胁人类健康的公共卫生问题。免疫治疗作为继手术、放疗、化疗和靶向治疗之后的一种新型肿瘤治疗方法,在CRC治疗中显示出积极的抗肿瘤效果。口服给药具有病人依从性好、生物安全性高和生产成本低等优点。然而,口服药物对CRC的治疗效果受到药物在肿瘤组织富集有限、结肠肿瘤免疫抑制微环境和肠道微生物群失衡等限制,这为CRC的有效治疗带来了挑战。
最近,西南大学肖波/石潇潇团队在Biomaterials发表题为“Magnetic natural lipid nanoparticles for oral treatment of colorectal cancer through potentiated antitumor immunity and microbiota metabolite regulation”的研究论文。研究人员构建了负载6-姜辣素(Gin)的磁性介孔硅纳米颗粒,并用可食用植物来源脂质分子对其表面进行了功能化。所构建的P127-MLL@Gins经口服后,能稳定穿越胃肠道,并达到结肠腔。随后,在交变磁场作用下,该纳米药物系统的运动性能提高,有效穿越黏液屏障,钻入结直肠肿瘤组织深部。不仅如此,交变磁场还能促使P127-MLL@Gins诱导结肠肿瘤细胞发生免疫原性死亡,激活特异性抗肿瘤免疫,抑制肿瘤生长。同时,我们发现该治疗方式显著增加了有益细菌的丰度,减少了有害细菌的比例,并增加了脂质氧化代谢物的含量。进一步的研究发现,联合免疫检查点阻断剂(αPD-L1)可以提高P127-MLL@Gins (+ AMF)对原位和远处结直肠肿瘤的抑制效果,并显著延长CRC模型小鼠的寿命。

【文章要点】
本研究将磁热疗法和免疫疗法相结合。磁热疗法是一种物理抗肿瘤治疗手段,主要利用磁性纳米颗粒在交变磁场作用下的产热效应以及肿瘤细胞比正常细胞热耐受性差的特性。本研究选用的基础治疗药物为Gin,该化合物是一种从生姜中提取的疏水抗肿瘤药物,具有多种生物医学功能,包括诱导细胞凋亡、抑制肿瘤细胞增殖、促进M2型巨噬细胞向M1型分化,是作为免疫抗肿瘤药物的优选。
在本研究中,研究者合成了具有最佳尺寸的P127-MLL@Gins,P127功能化和交变磁场能有效促进P127-MLL@Gins被结直肠肿瘤细胞吞噬,并成功从溶酶体逃逸。体外实验证明该纳米药物系统不仅能够直接导致肿瘤细胞凋亡,而且能够阻滞肿瘤细胞的细胞周期进程,从而抑制肿瘤细胞增殖(图1)。此外,P127-MLL@Gins还可通过Gin和亚铁离子诱导的氧化应激和磁热效应,从而诱导其凋亡/铁死亡,同时能够刺激肿瘤细胞发生ICD。除此之外,P127-MLL@Gins可通过半乳糖受体介导的内吞作用被巨噬细胞高效吞噬,诱导巨噬细胞从M2型极化为M1型,进一步发挥抗肿瘤效果(图2)。在交变磁场的作用下,P127-MLL@Gins的运动速率提高,从而跨越口服药物递送屏障,富集于结肠肿瘤组织并产生大量热能(图3),促使肿瘤细胞发生免疫原性死亡,为解除肿瘤微环境的免疫抑制提供了必要的前提条件。

图1. P127-MLL@Gins的肿瘤细胞摄取、溶酶体逃逸和抗肿瘤活性。
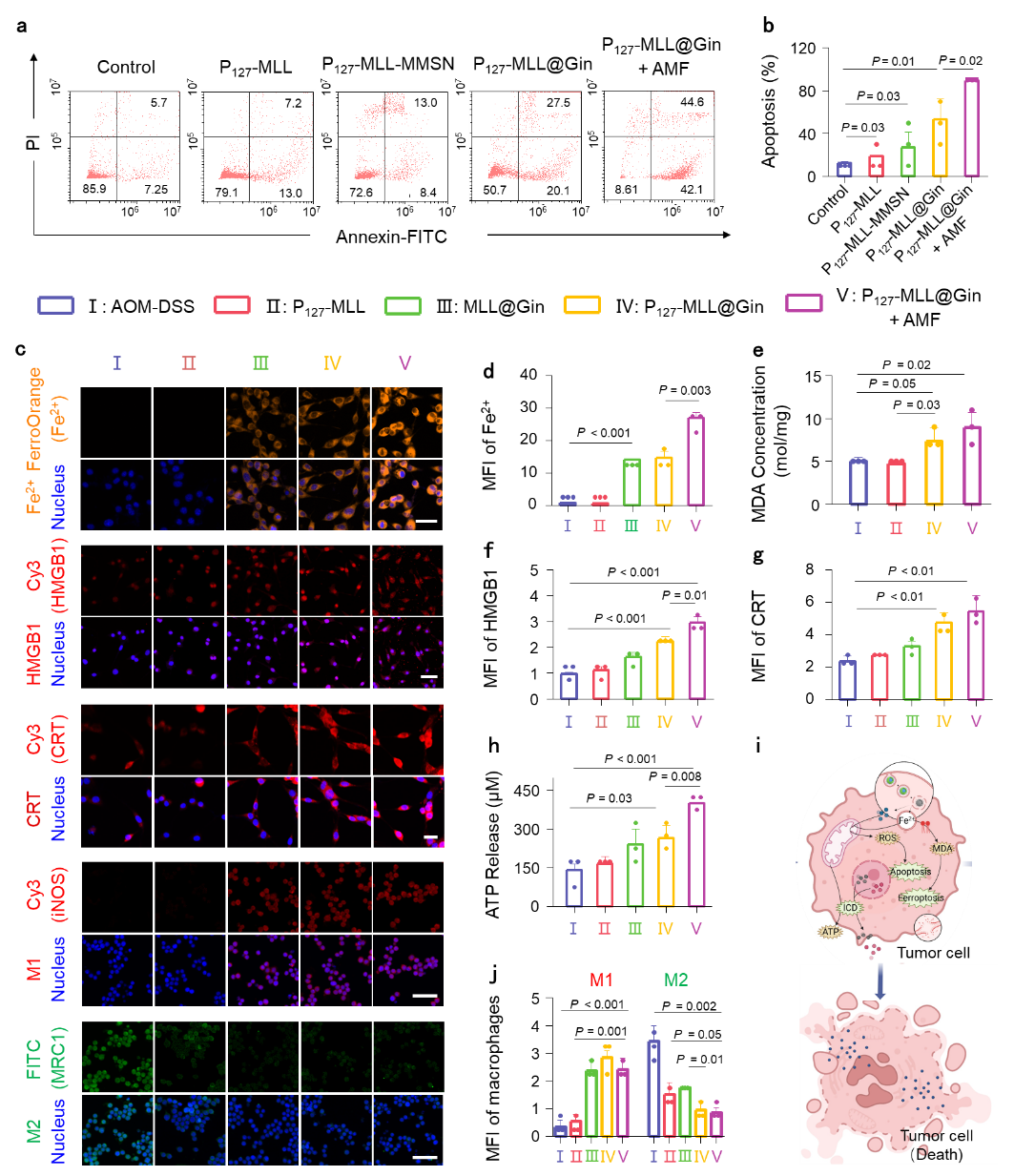
图2. P127-MLL@Gins诱导细胞凋亡、铁死亡、ICD和巨噬细胞极化。
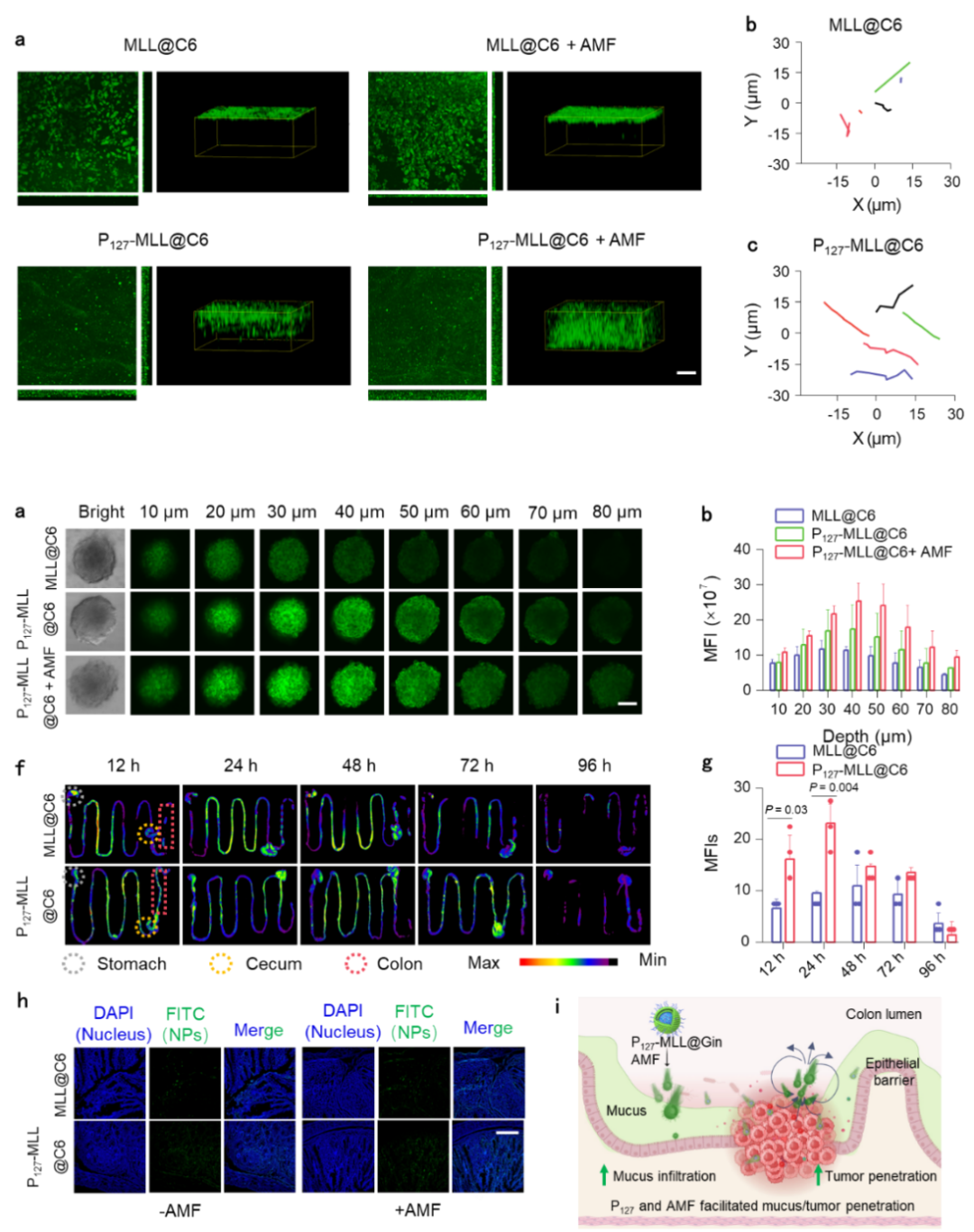
图3. P127-MLL@Gins穿越结直肠黏液和增强肿瘤组织渗透的性能评价。
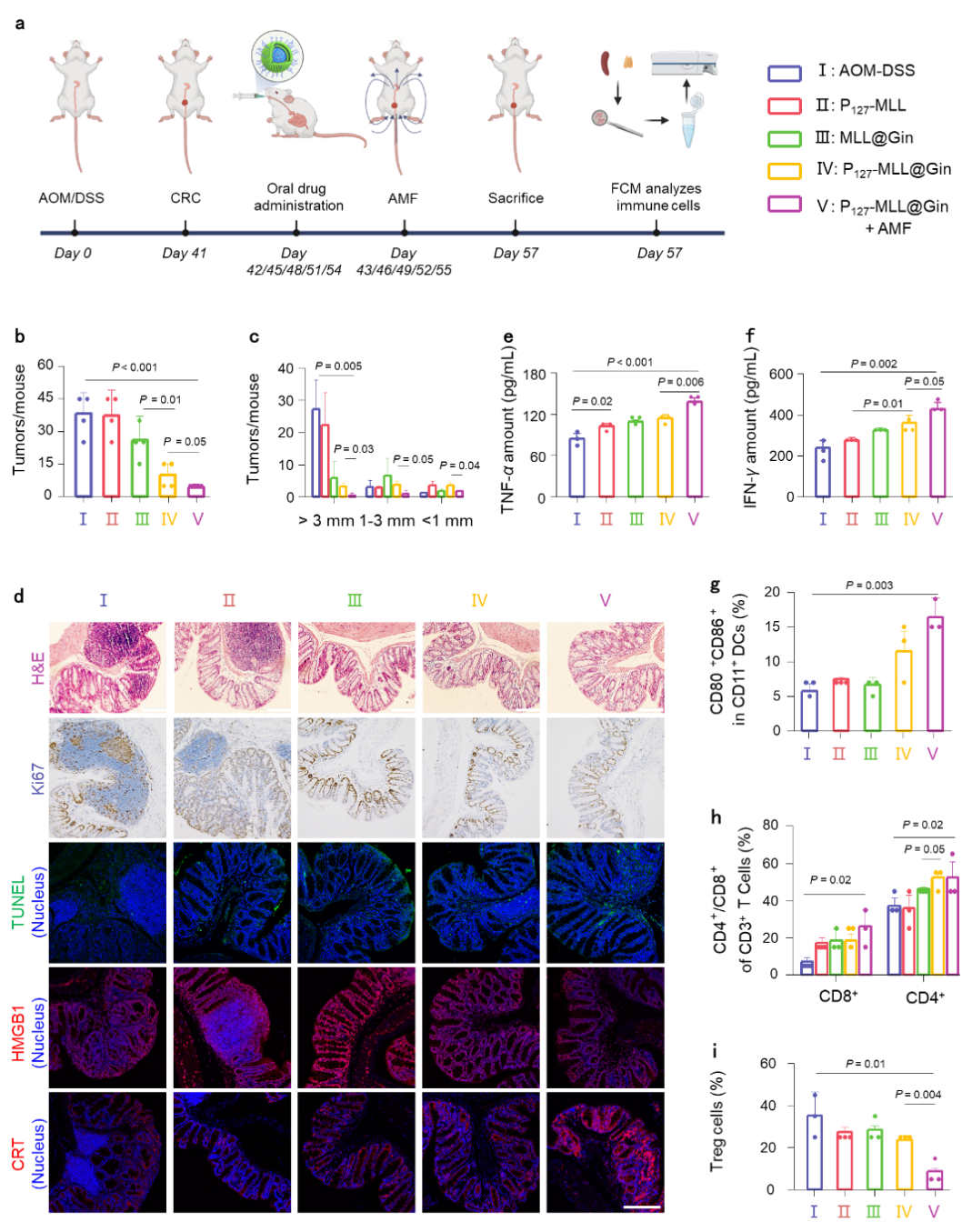
图4. 口服P127-MLL@Gins治疗原位结直肠肿瘤的效果。
CRC模型小鼠经口服P127-MLL@Gins,在交变磁场辅助下,探究了对原位CRC生长的抑制效果。结果表明,P127-MLL@Gins结合AMF能显著提升TNF-α和IFN-γ的表达水平,提高胸腺成熟DC细胞的比例,促进CD4+和CD8+细胞的活化,并降低Treg细胞的含量。表明P127-MLL@Gins可激发抗肿瘤免疫,并经T细胞介导免疫应答(图4)。
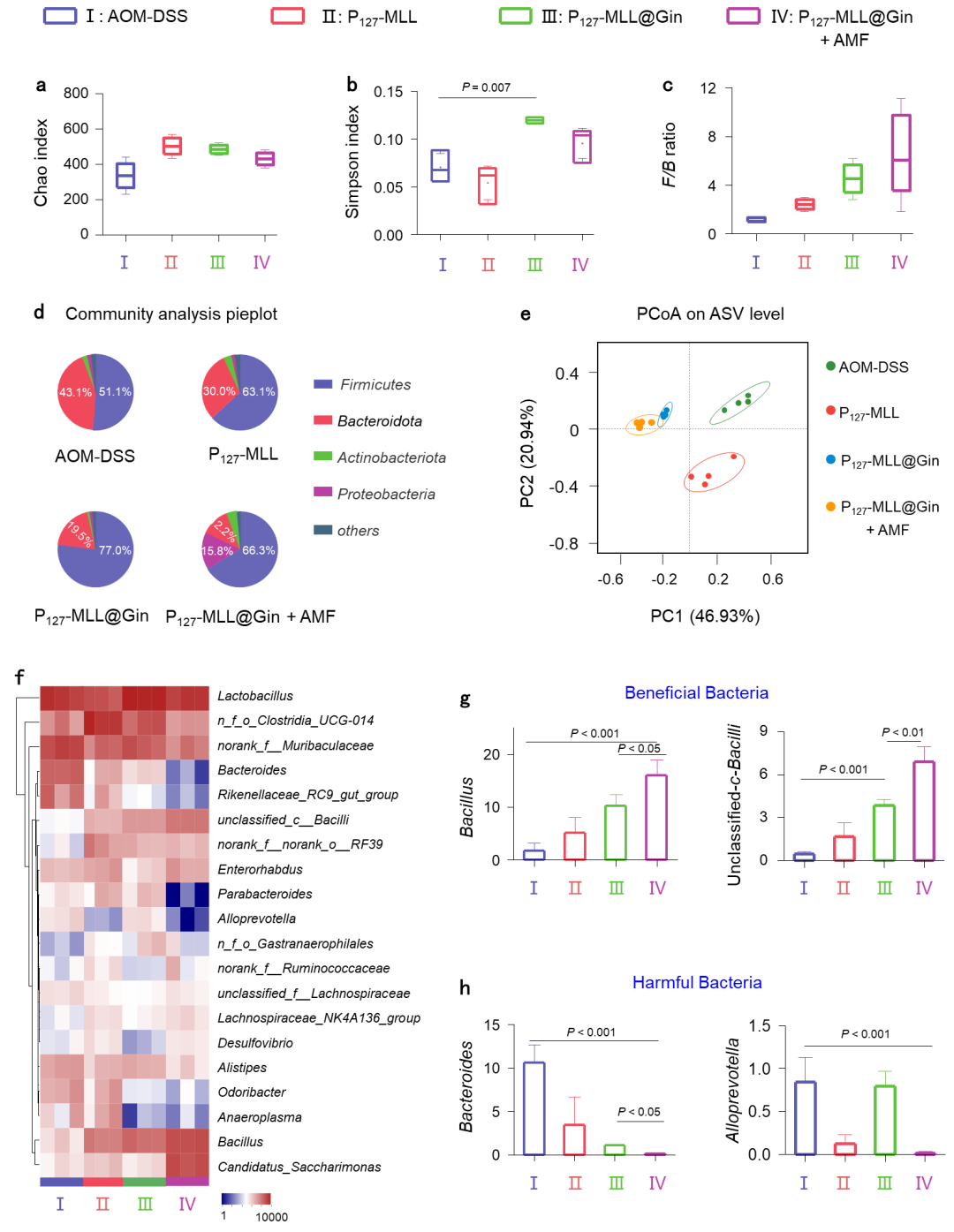
图5. 口服P127-MLL@Gins对肠道微生物的影响。
肠道菌群动态变化与CRC的进展密切相关。为了验证口服纳米药物是否影响肠道菌群的丰度和组成,该研究系统评价了不同治疗方法对肠道微生物的影响,实验数据显示P127-MLL@Gins能显著增加有益菌的多样性和丰度,减少有害细菌的数量,以此调节肠道微生物稳态和抑制结直肠肿瘤生长(图5)。
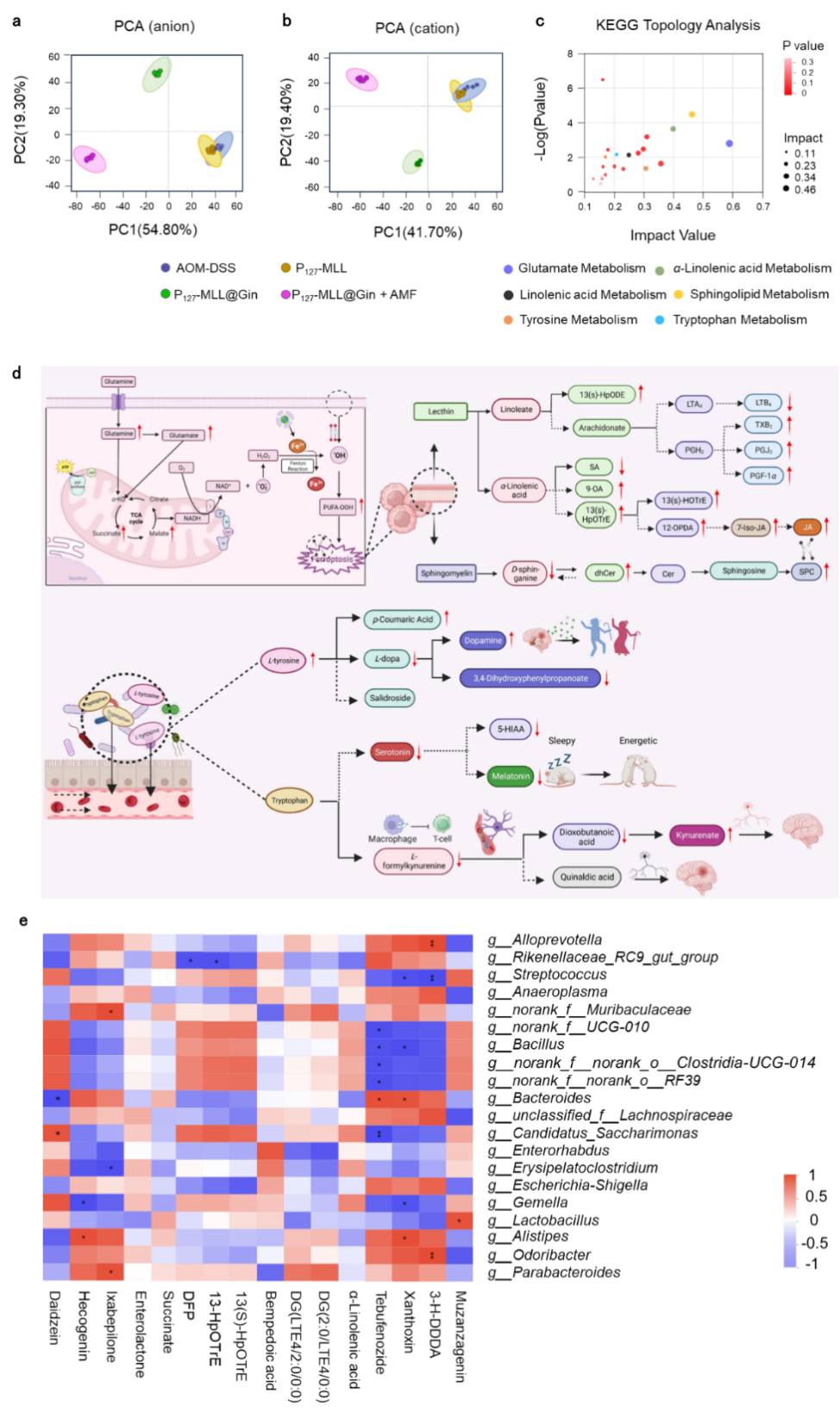
图6. 口服P127-MLL@Gins对肠道代谢产物的影响。
为阐明P127-MLL@Gins的抗肿瘤机制,研究者使用超高效液相色谱-傅立叶变换质谱(UHPLC-QTOF-MS)对小鼠粪便中的代谢产物进行了液相色谱-质谱分析。结果表明,经口服给药后,多种代谢产物的丰度发生改变,并激活多种与肿瘤相关的代谢通路(如亚麻酸代谢、鞘脂代谢等)(图6)。
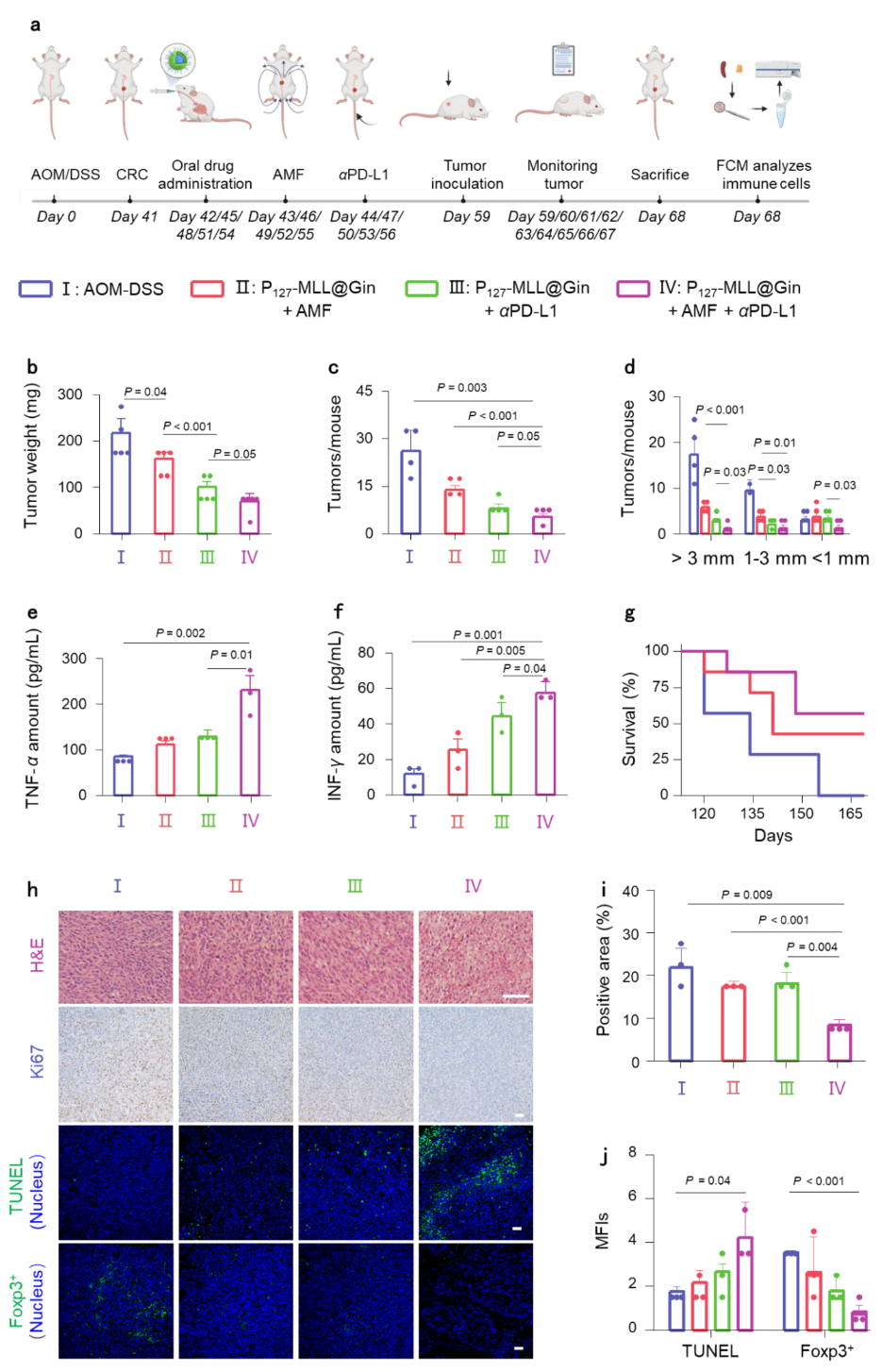
图7. 抗体阻断剂(αPD-L1)联合P127-MLL@Gins(+ AMF)对原位结肠癌及远端肿瘤的抑制效果。
为了在小鼠体内进一步验证PD-L1阻断剂联合磁热疗法对CRC的治疗效果,研究者构建了原位+远端CRC小鼠模型,通过静脉注射αPD-L1结合口服纳米药物,发现P127-MLL@Gins (+ AMF) + αPD-L1可激活全身抗肿瘤免疫反应,从而有效抑制结直肠肿瘤的生长(图7)。
【结论与展望】
在本研究中,该团队开发了一种基于P127和交变磁场的口服药物递送平台,可促进黏液渗透并实现肿瘤富集。所获得的纳米药物(P127-MLL@Gins)在磁热效应下穿越黏液屏障,到达结直肠肿瘤组织深部,诱发肿瘤细胞的免疫原性死亡,刺激DC细胞成熟,从而抑制原位结直肠肿瘤生长并恢复肠道菌群及代谢稳定。联合免疫检查点阻断剂(αPD-L1)可进一步增强全身抗肿瘤免疫,高效抑制原发性和远端结肠肿瘤。该项研究为恶性CRC的治疗提供了一种新策略(图8)。
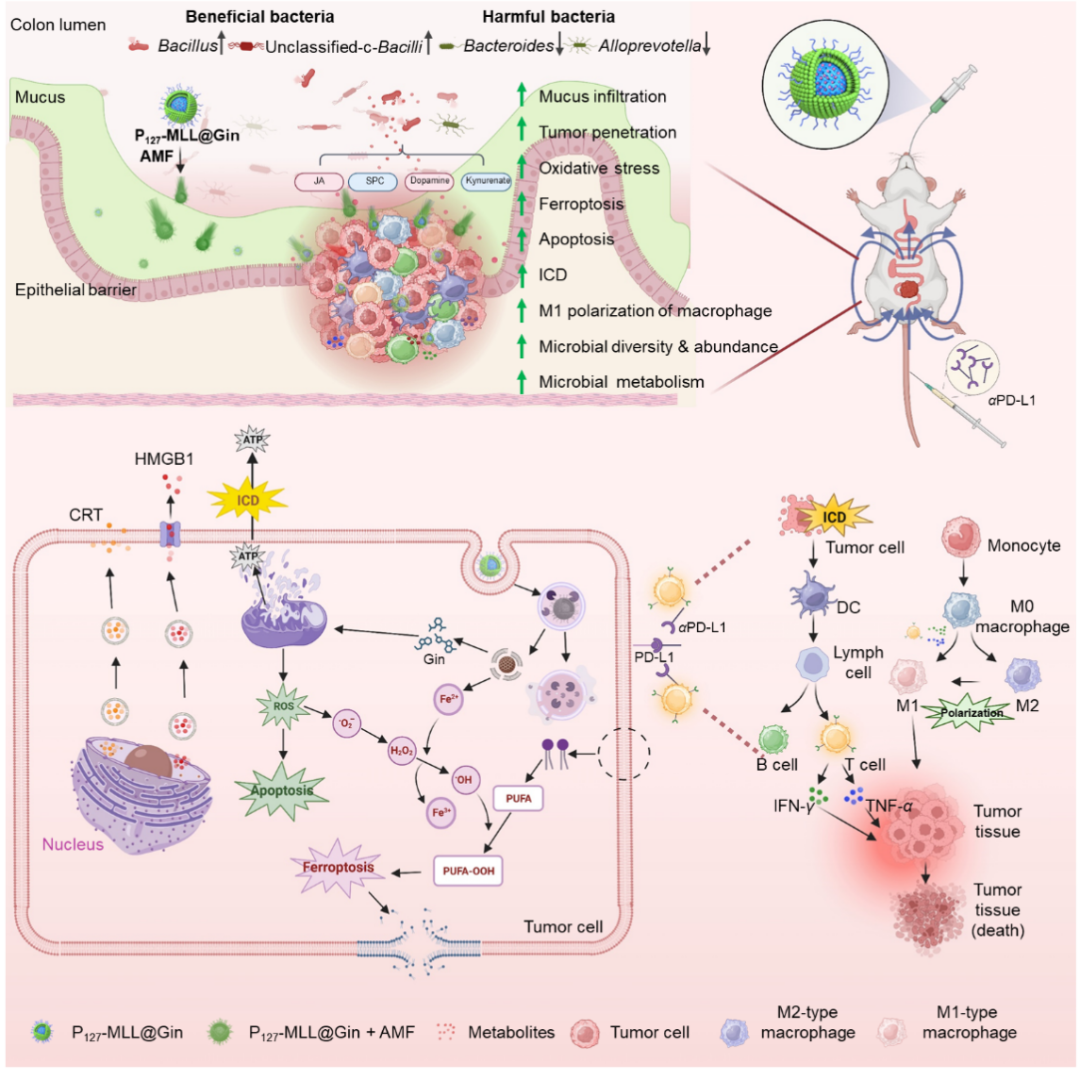
图8. 口服P127-MLL@Gins实现结直肠黏液穿越、肿瘤组织渗透和激活特异性抗CRC免疫应答的示意图。
西南大学硕士生李宝仪为论文第一作者,西南大学肖波教授和石潇潇副教授为论文的共同通讯作者。本研究受国家级青年人才项目、国家自然科学基金和重庆市杰出青年基金项目等资助。
原文链接:
https://www.sciencedirect.com/science/article/pii/S0142961224000644


