NEJM:Belantamab Mafodotin、硼替佐米和地塞米松治疗多发性骨髓瘤
时间:2024-06-06 06:01:03 热度:37.1℃ 作者:网络
Belantamab mafodotin 对复发/难治性多发性骨髓瘤患者具有单药活性,这一发现支持进一步评估该药物与标准治疗相结合的效果。B 细胞成熟抗原 (BCMA) 是治疗多发性骨髓瘤的既定靶点。Belantamab mafodotin 是一种靶向 BCMA 的抗体-药物偶联物,具有多种抗肿瘤活性机制。我们报告了 DREAMM-7 试验的结果,该试验评估了 Belantamab mafodotin、硼替佐米和地塞米松 (BVd) 与达雷木单抗、硼替佐米和地塞米松 (DVd) 相比对复发或难治性多发性骨髓瘤患者的疗效和安全性。
我们正在进行一项正在进行的 3 期开放标签全球随机试验,试验对象为接受过至少一线治疗且在最近一次治疗期间或之后病情进展的多发性骨髓瘤患者。如果患者患有对抗 CD38 治疗具有耐药性的疾病或曾接受过抗 BCMA 治疗,则将被排除在试验之外。有关资格标准的详细信息见补充附录,可在 NEJM.org 上与本文全文一起获取。
患者以 1:1 的比例随机分配接受 BVd 或 DVd 治疗。随机化是集中进行的。两个治疗组均在前 8 个周期接受硼替佐米(皮下注射,剂量为 1.3 mg/m2 体表面积,21 天为一个周期,第 1、4、8 和 11 天)和地塞米松(口服或静脉注射,剂量为 20 mg,硼替佐米给药当天和次日)。BVd 组接受贝兰他单抗马福多丁(静脉注射,剂量为 2.5 mg/kg 体重,21 天为一个周期 [每 3 周一次])直至出现疾病进展。贝兰他单抗马福多丁剂量可降至 1.9 mg/kg 或延迟给药以控制不良事件。 DVd 组接受达雷木单抗治疗(第 1 至 3 个周期每周静脉注射 16 mg/kg,第 4 至 8 个周期每 3 周静脉注射 1 次,第 9 个周期及以后每 4 周静脉注射 1 次),直至出现疾病进展。治疗持续至出现疾病进展、不可接受的毒性作用、患者撤回同意或死亡(以先发生者为准)。患者根据筛选时的修订国际分期系统分期(I 期 vs. II 或 III 期)、之前是否接触过硼替佐米(是 vs. 否)和之前接受过的治疗线数(一线 vs. 二线或三线 vs. 四线或更多线)进行分层。多达 50% 的患者可能接受过两种或更多种之前的治疗。不允许治疗组之间交叉。
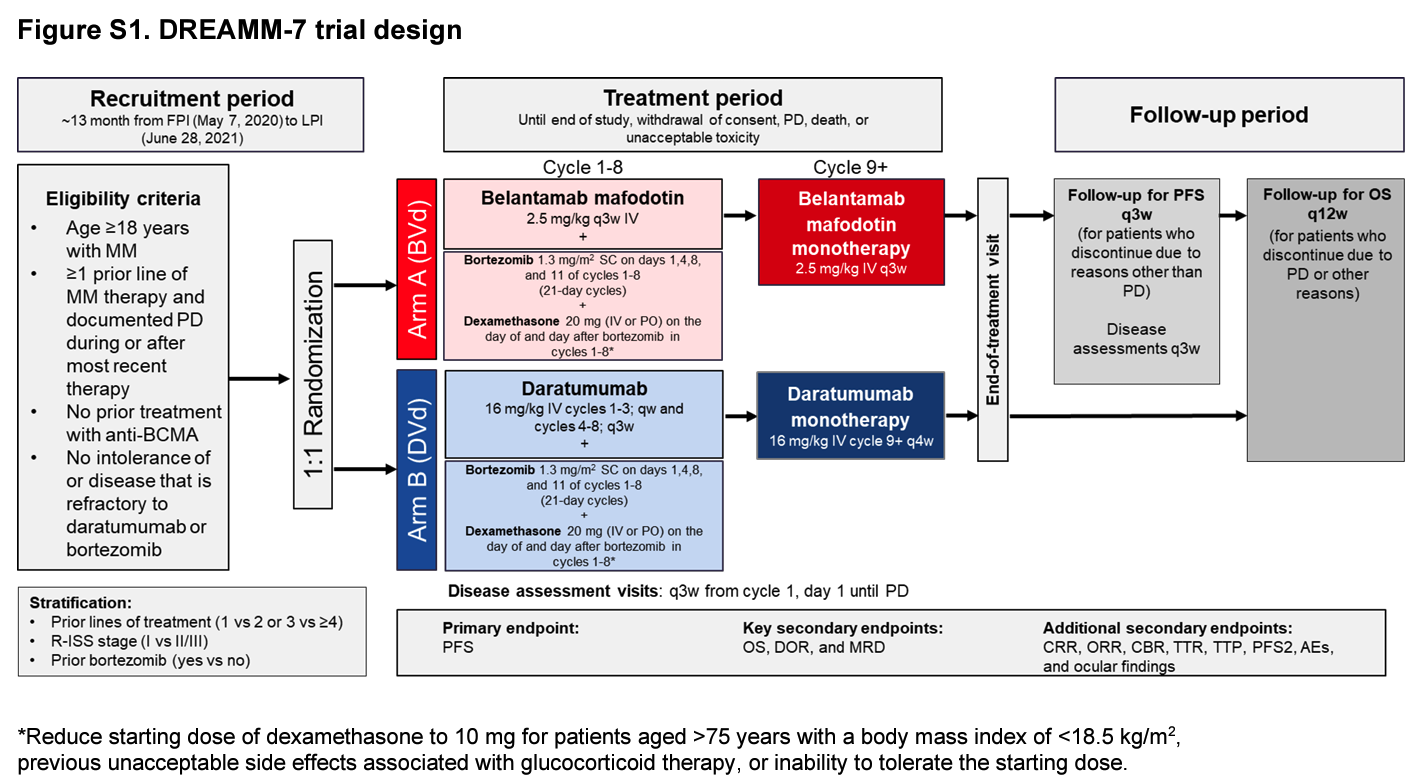
主要终点是无进展生存期,定义为从随机分组到出现记录的疾病进展或因任何原因死亡的时间。疾病进展由独立审查委员会根据国际骨髓瘤工作组标准进行评估。13 进行了事后补充分析,其中任何疾病进展或死亡的发生均被视为事件,无论患者是否已开始新的抗骨髓瘤治疗或随访失访时间延长。关键次要终点是总生存期、缓解持续时间和微小残留病 (MRD) 阴性状态,后者通过下一代测序以 10−5 或更低的灵敏度进行评估。其他次要终点是不良事件(根据美国国家癌症研究所《不良事件常用术语标准》第 5.0 版进行分级)和眼部检查结果(使用角膜病变和视力 (KVA) 量表进行分级)。 KVA 等级是一种综合等级,基于角膜检查结果和最佳矫正视力 (BCVA) 的变化。14 在 BVd 组中,在筛选时、治疗前每 3 周进行一次眼科检查,直至至少服用第六剂 belantamab mafodotin,如果没有眼科发现,则每 3 个月进行一次。在 DVd 组中,在筛选时、第 6 个周期进行一次眼科检查,然后每 6 个月进行一次。为了评估健康相关生活质量相对于基线的变化,每次访视时都获取欧洲癌症研究与治疗组织核心生活质量问卷的全球健康状况和生活质量领域的评分。
从 2020 年 5 月 7 日至 2021 年 6 月 28 日,共有 494 例患者被随机分配接受 BVd(243 例患者)或 DVd(251 例患者)治疗;这些患者被纳入意向治疗人群。在数据截止时,所有患者均处于单药治疗期。总体而言,BVd 组 243 例患者中有 81 例(33%)和 DVd 组 251 例患者中有 51 例(20%)正在接受试验治疗(图 S3);161 例患者(66%)已停用 belantamab mafodotin,195 例患者(78%)已停用达雷木单抗。BVd 组 1 例患者和 DVd 组 5 例患者已接受随机分组,但未接受试验治疗。疾病进展是停用 belantamab mafodotin 或达雷木单抗的最常见原因; BVd 组 24% 的患者停用了 belantamab mafodotin,DVd 组 59% 的患者因此停用了 daratumumab。
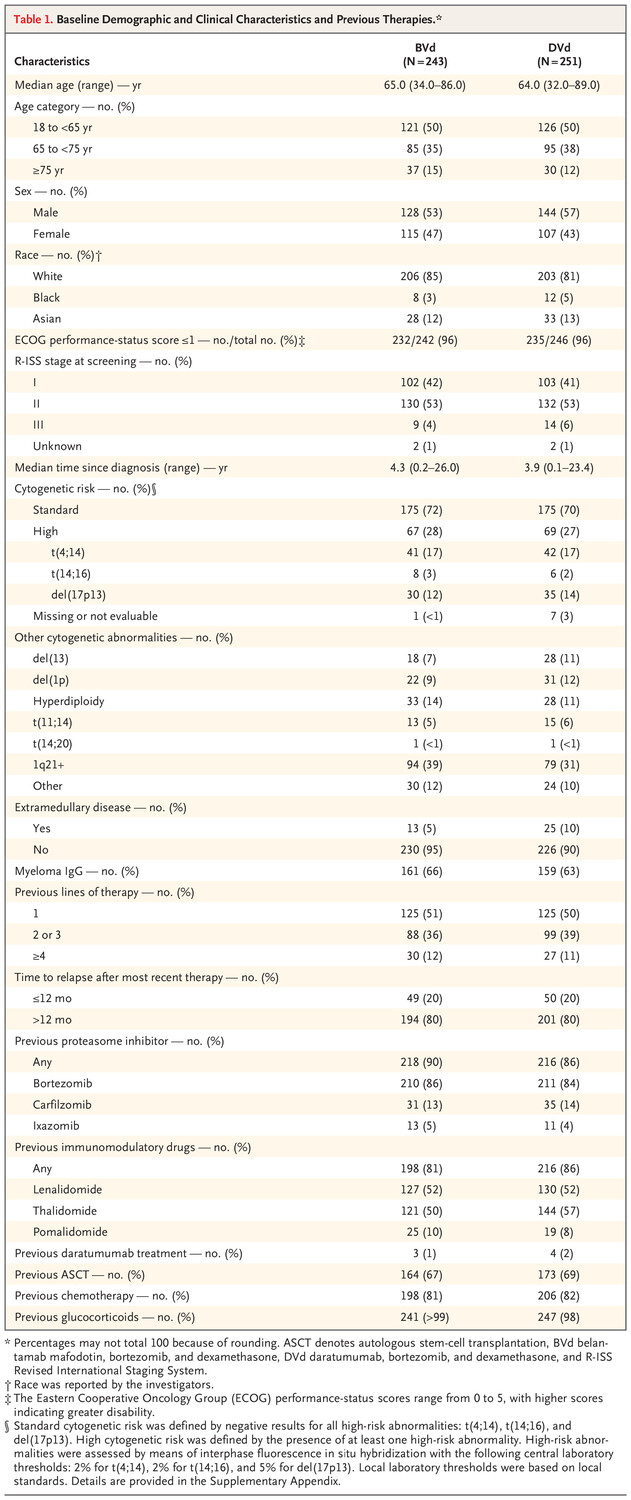
试验人群在性别和年龄分布方面与多发性骨髓瘤患者人群非常接近。然而,试验人群中的白人患者多于其他种族群体的患者,黑人患者比例较低(表 S5)。治疗组之间的患者特征和基线既往治疗均衡(表 1)。总体而言,494 名患者中有 250 名(51%)接受过一线治疗,257 名(52%)曾接触过来那度胺,166 名(34%)患有对来那度胺有抵抗力的疾病(表 S6),136 名(28%)具有高细胞遗传学风险。
中位随访时间为 28.2 个月(范围,0.1 至 40.0),BVd 组的中位无进展生存期为 36.6 个月(95% 置信区间 [CI],28.4 至未达到 [NR]),DVd 组为 13.4 个月(95% CI,11.1 至 17.5)(疾病进展或死亡的风险比为 0.41;95% CI,0.31 至 0.53;P<0.001)(图 1A)。
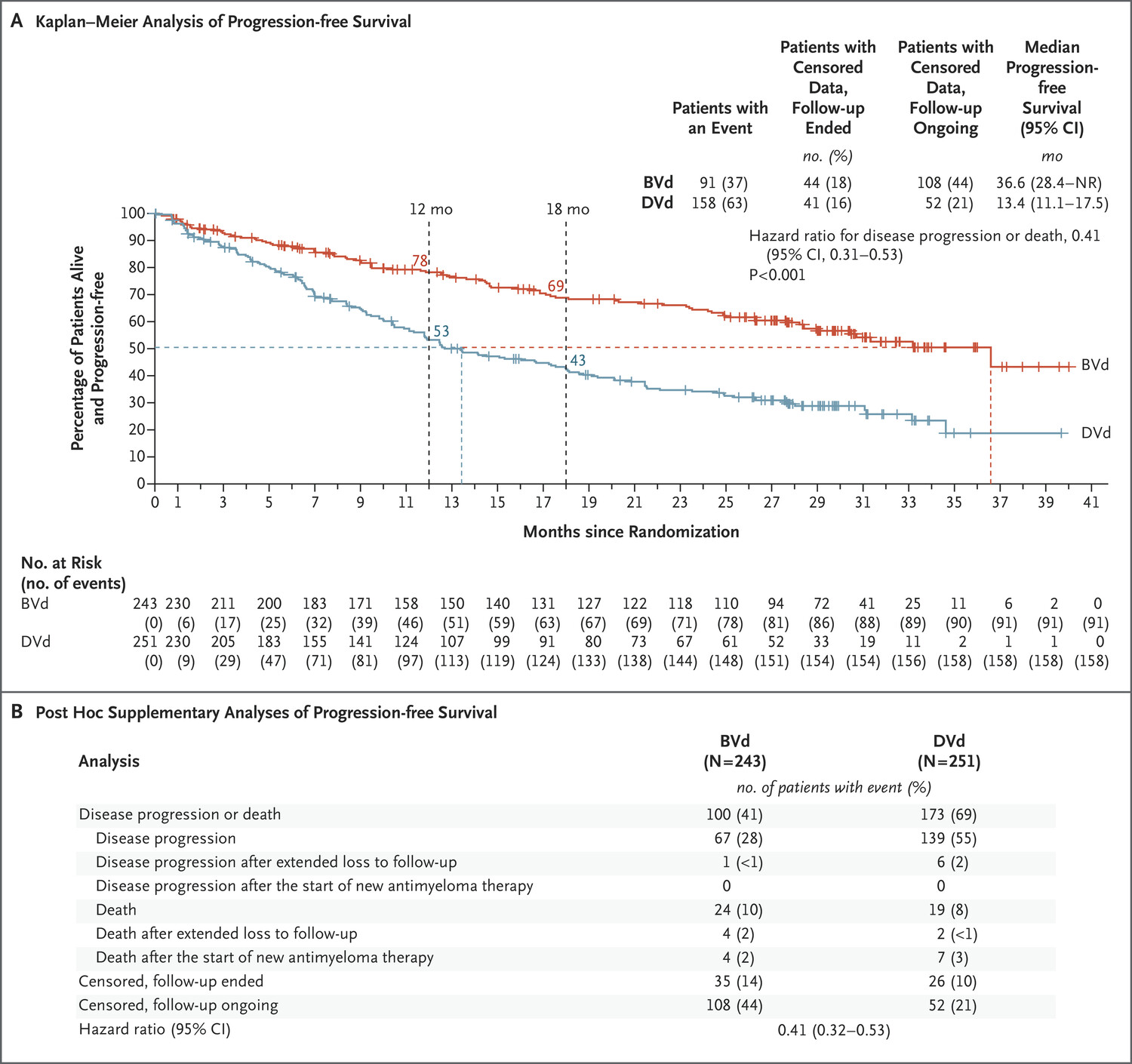
图:PFS曲线
在总共 249 起事件(疾病进展或死亡)中,91 起(37%)发生在 BVd 组,158 起(63%)发生在 DVDd 组。研究人员和独立审查委员会对进展疾病的评估基本一致(表 S7)。
事后分析显示,对于有删失数据的患者的随访在各治疗组之间是平衡的(表 S9)。图 S4 显示了无进展生存期的预先指定的亚组分析结果。图 1B 显示了事后补充分析的结果,其中任何疾病进展或死亡的发生都被视为事件,无论患者是否已开始新的抗骨髓瘤治疗或长期失访。
在数据截止时,BVd 组有 54 名患者(22%)和 DVd 组有 87 名患者(35%)死亡。18 个月时 BVd 组的总生存率为 84%,DVd 组为 73%(图 2)。 BVd 组总生存期分布的第 25 个百分位数为 33.9 个月(95% CI,21.9 至 NR),DVd 组为 15.2 个月(95% CI,12.3 至 21.1)。在数据截止时,总生存期结果未达到显著性标准;总生存期的随访仍在进行中。
BVd 组对治疗有反应(部分反应或更好)的患者百分比为 83%(95% CI,77 至 87),DVd 组为 71%(95% CI,65 至 77)(表 2 和图 S5)。BVd 的反应深度大于 DVd;BVd 组有 35% 的患者完全反应或更好,而 DVd 组只有 17%。 BVd 组 25% 的患者和 DVd 组 10% 的患者达到完全缓解或更佳且 MRD 阴性状态。BVd 组的中位缓解持续时间为 35.6 个月(95% CI,30.5 至 NR),DVd 组为 17.8 个月(95% CI,13.8 至 23.6);缓解持续时间分布的第 25 百分位数为 BVd 组 18.8 个月(95% CI,13.2 至 23.5),DVd 组为 9.0 个月(95% CI,6.4 至 10.4)(图 S6)。然而,由于在中期分析时 BVd 组中超过一半的缓解仍在进行中,因此有关中位缓解持续时间的数据尚未完全成熟。对限制平均反应持续时间的单独分析表明 BVd 优于 DVd(P<0.001);详细信息见补充附录。
DVd 后最常用的治疗方法是糖皮质激素、免疫调节剂和蛋白酶体抑制剂;BVd 后最常用的治疗方法是糖皮质激素、免疫调节剂和单克隆抗体。在事后分析中,在 DVd 组接受过任何后续抗骨髓瘤治疗的 110 名患者中,DVd 后的第一种治疗是来那度胺(32 名患者(29%))、卡非佐米(30 名患者(27%))、泊马度胺(24 名患者(22%))和贝兰他单抗(15 名患者(14%))。在 BVd 组接受过任何后续抗骨髓瘤治疗的 62 名患者中,BVd 后的第一种治疗是达雷木单抗(25 名患者(40%))、泊马度胺(18 名患者(29%))和来那度胺(13 名患者(21%))。 BVd 治疗的益处得以维持,这一点可以通过后续抗骨髓瘤治疗后出现疾病进展或因任何原因死亡的时间看出
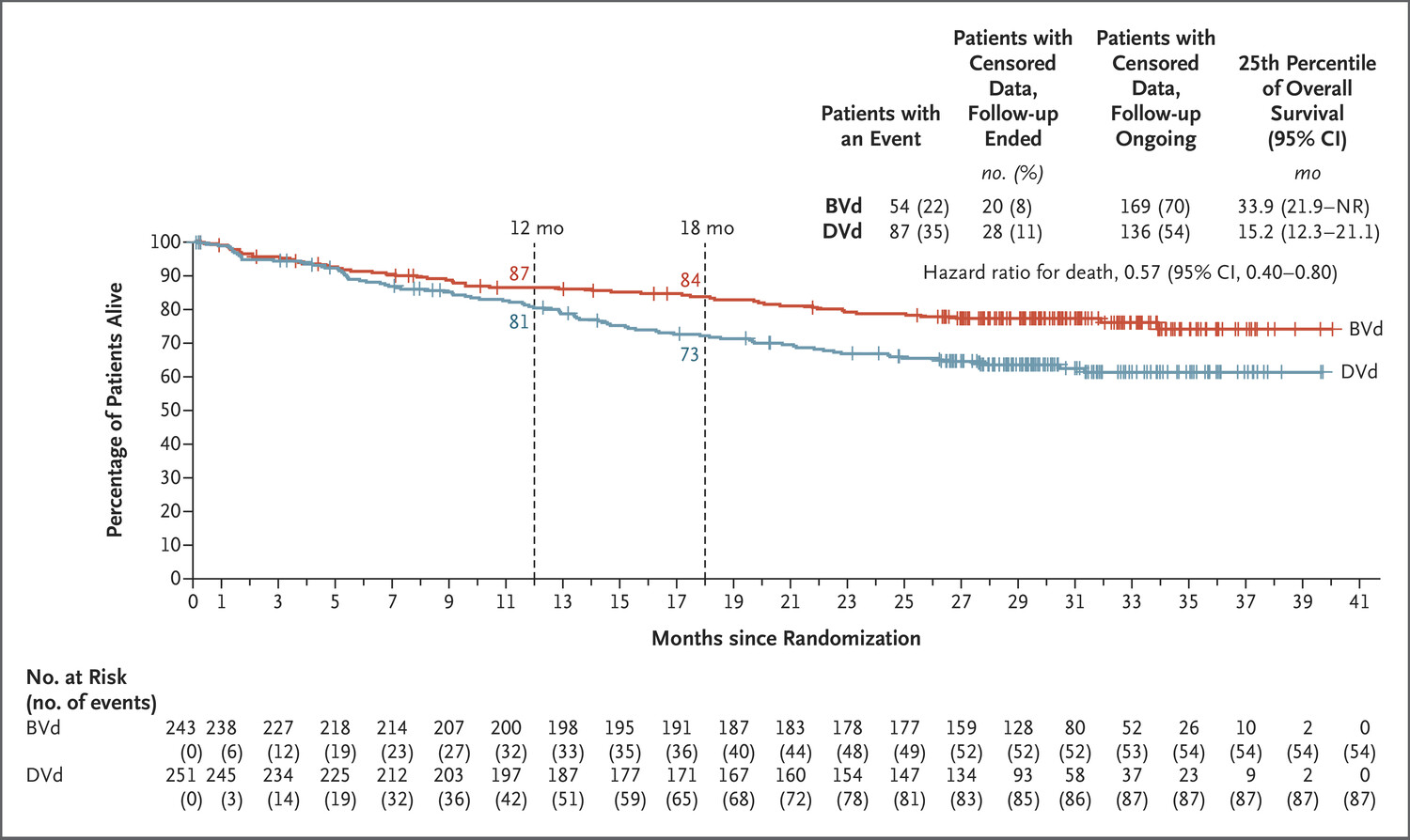
图:总生存期曲线
安全性人群包括 488 名接受过至少一剂任何试验药物的患者(BVd 组 242 名,DVd 组 246 名)。BVd 组接受任何试验药物治疗的中位持续时间为 15.9 个月(范围,0.7 至 40.2 个月),DVd 组为 12.9 个月(范围,0.2 至 40.5 个月)。所有患者均发生过至少一次不良事件(表 3)。BVd 组 95% 的患者和 DVd 组 78% 的患者发生 3 级或更高级别的不良事件,50% 和 37% 的患者发生严重不良事件(表 S13)。
两组中至少 15% 的患者报告的不良事件(安全性人群)。
BVd 组 64 例患者(26%)和 DVd 组 36 例患者(15%)因研究者认为与治疗相关的不良事件而停用任何试验药物。以下不良事件导致两组至少 2% 的患者停用任何试验药物:周围感觉神经病变(BVd 组 5% 和 DVd 组 2%)、周围神经病变(分别为 2% 和 4%)、多发性神经病变(3% 和 2%)、肺炎(4% 和无)、2019 年冠状病毒病 (Covid-19)(1% 和 2%)、Covid-19 肺炎(<1% 和 2%)、血小板减少症(2% 和 <1%)以及视力模糊(2% 和无)(表 S13)。此外,BVd 组 23 例患者(10%)和 DVd 组 19 例患者(8%)死于严重不良事件;导致死亡的严重不良事件分别有 7 名患者(3%)和 2 名患者(1%)被认为与治疗有关(表 S14)。
DREAMM-7 试验的中期分析显示,与 DVd 疗法相比,BVd 疗法在接受至少一线疗法后复发或难治性多发性骨髓瘤患者的无进展生存期方面具有显著优势。疾病进展或死亡的风险比为 0.41(95% CI,0.31 至 0.53;P<0.001)。BVd 疗法与比 DVd 疗法更大的反应深度和持久性相关;BVd 组中完全缓解、完全缓解和 MRD 阴性状态的患者百分比高于 DVd 组,且反应持续时间更长。BVd 组中 95% 的患者发生了 3 级或更高级别的不良事件,一半的患者发生了严重不良事件。BVd 组中约四分之一的患者因治疗相关的毒性作用而停止使用 BVd 中的三种药物中的任何一种。
与 DVd 相比,BVd 在复发或难治性多发性骨髓瘤患者接受至少一线治疗后,在无进展生存期方面具有显著优势。此外,50% 的患者在接受 BVd 治疗后出现严重不良事件。然而,BVd 在无进展生存期方面的强劲结果以及深度持久的反应支持了 BVd 有可能成为多发性骨髓瘤患者在首次复发时或复发后的一种治疗选择。
原始出处:
Dimopoulos MA, Beksac M, Pour L, Delimpasi S, Vorobyev V, Quach H, Spicka I, Radocha J, Robak P, Kim K, Cavo M, Suzuki K, Morris K, Pompilus F, Phillips-Jones A, Zhou XL, Fulci G, Sule N, Kremer BE, Opalinska J, Mateos MV, Trudel S; DREAMM-8 Investigators.Belantamab Mafodotin, Pomalidomide, and Dexamethasone in Multiple Myeloma.N Engl J Med. 2024 Jun 2. doi: 10.1056/NEJMoa2403407


