罕见病例:我从来没见过这样的疾病!依托市一医院强大综合实力解决了问题
时间:2024-06-29 10:02:07 热度:37.1℃ 作者:网络
前言:外科医生的挑战是伴随从业的一生的,因为永远不知道接下来的手术病例会是什么样的情况,术前做过许多预案,可能到时候也用不上,最后需要术中随机应变。这也是对于少见疾病综合性医院或大型医院为什么经验更为丰富的原因,毕竟总量大了,碰到的病例多了,各种情况有见过,所以术中的应变能力就会强些。我自己网络咨询的病例比较多,也得以见识到许多罕见或少见的疾病,也积累了更多临床经验以弥补原来所处医院平台的不足。但手术例数毕竟比不上省级大医院多,所以在理念上我们或许比大医院同道在某些方面能多些思考,但在具体手术技术操作上,仍有需要学习与进步的地方。好在现在整合到杭州市第一人民医院总院后,不单有肺癌综合治疗的马胜林教授团队作为坚强的后盾,也有外科领域江洪主任为首的强大团队为后盾,真正术中需要讨论商议的时候,能集集体的力量,做出最合理的应变方案,保证患者的安全与治疗的有效。也就是说,当术中遇到意料之外的情况时,在原来较小的医院平台时,缺少商量的人,而在市一医院则有更多能合作、讨论与决策的胸外科高水平同道。今天分享的病例虽然在术前也做过规划或预案,但进胸后探查的情况仍有些出乎意料之外,正是有隔壁在手术的龚晓成主任以及胸外科江洪主任主持大局,术中讨论商量后采取了果断的措施,确保手术顺利完成并快速康复出院。这个疾病,我是从来没有见过!
病史信息:

患者检查发现肺部占位性病灶1年,复查没有好转,到门诊找我看后,我考虑虽然应该是良性的,但病灶比较大,患者年纪轻,还是建议外科手术切除为宜。
影像展示与分析:
先看CT影像:
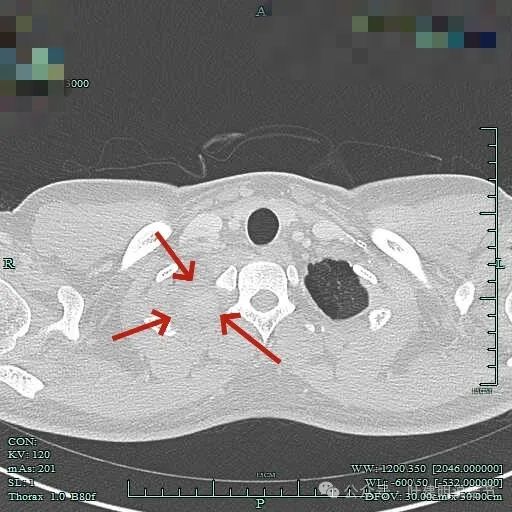
病灶位于右肺尖处。
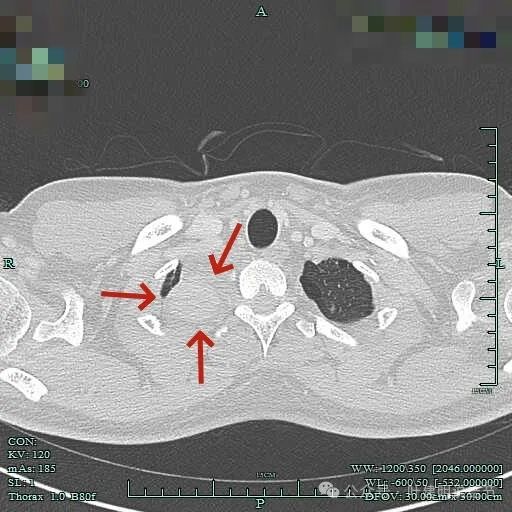
周围似乎仍有间隙,没有侵犯影响周围结构。
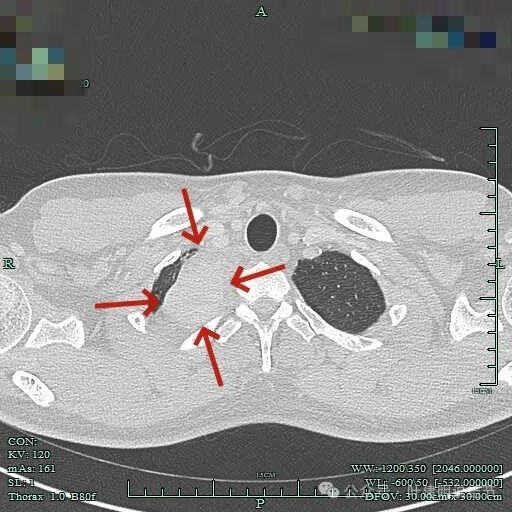
病灶长径应该有5厘米或以上。
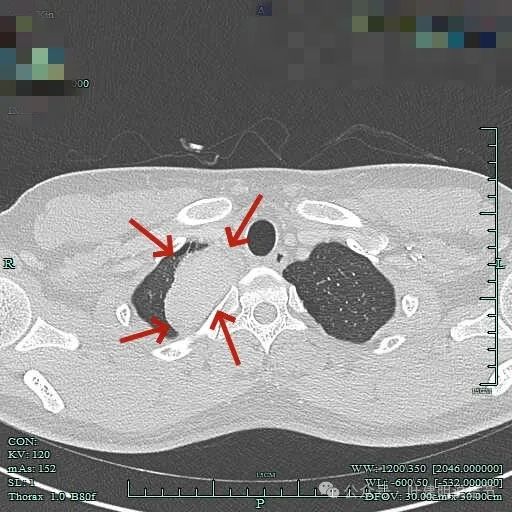
表面较不平整,内部密度较为均匀。
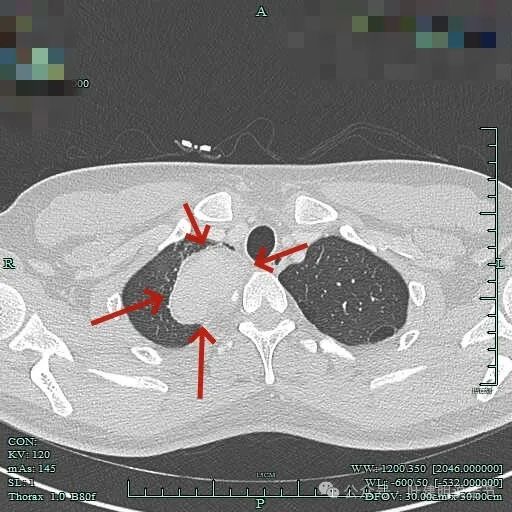
感觉似乎有层包膜的似的。
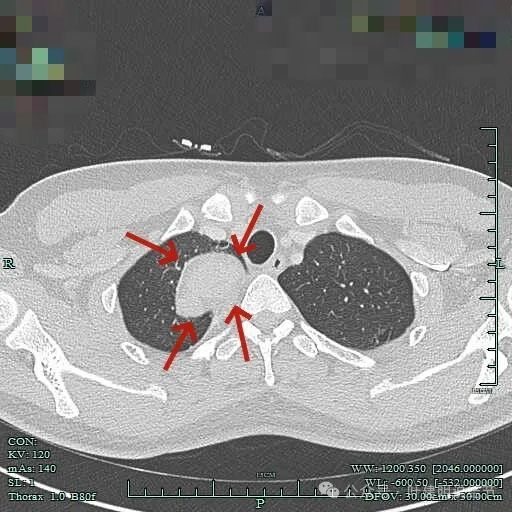
与胸壁紧贴,但侵犯是不明显的。
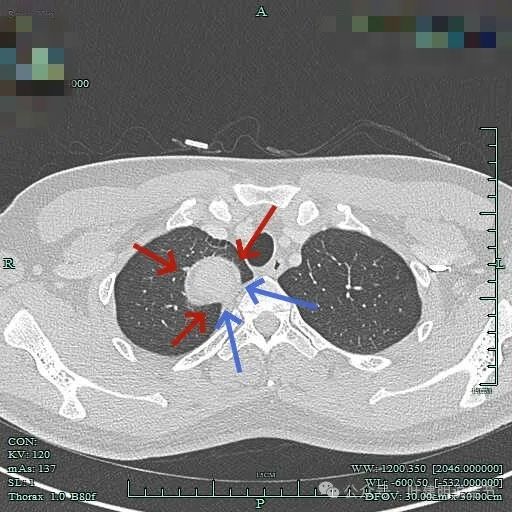
上图见包膜与肿瘤实质间似乎有低密度区。而且蓝色箭头所示胸膜是完整的。
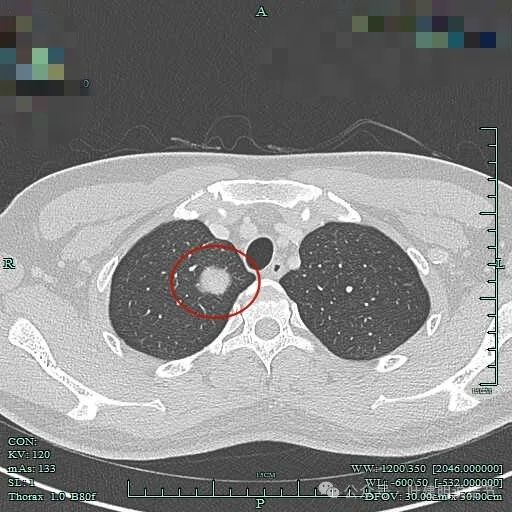
上图显得病灶下部的周围都是肺组织。
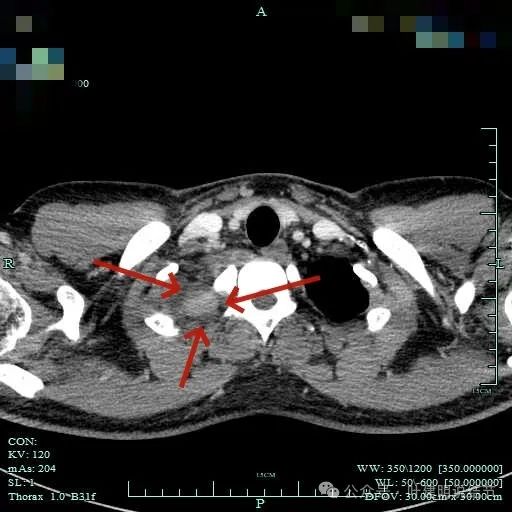
纵隔窗见肿瘤周围即使在最顶上也有低密度区。
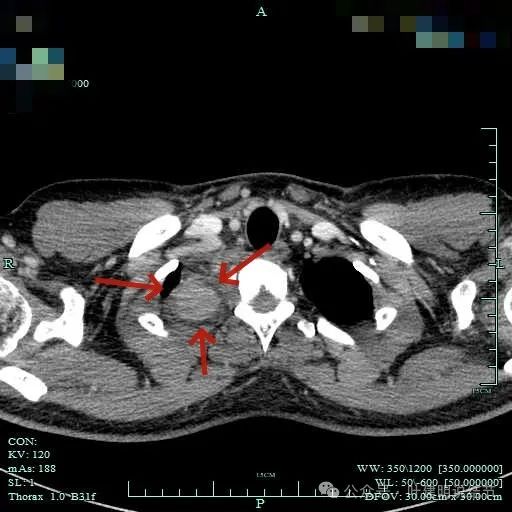
没有侵犯邻近结构,内部密度较为均匀。
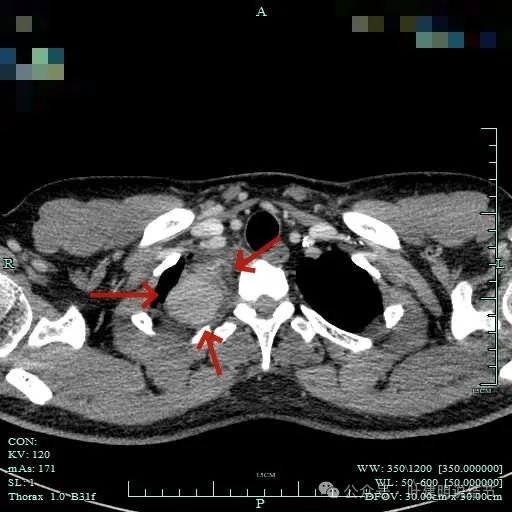
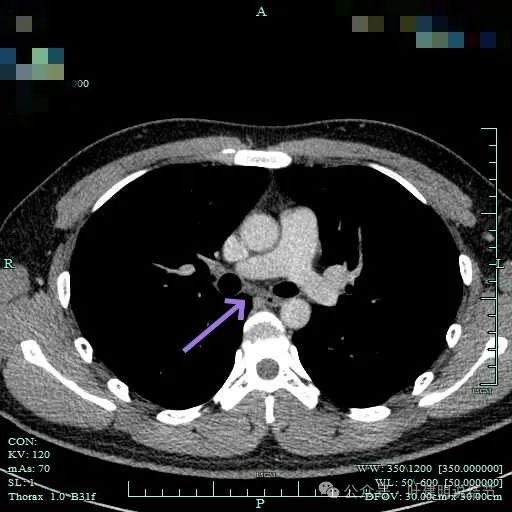
边界清楚,表面光滑,内部密度较为均匀。
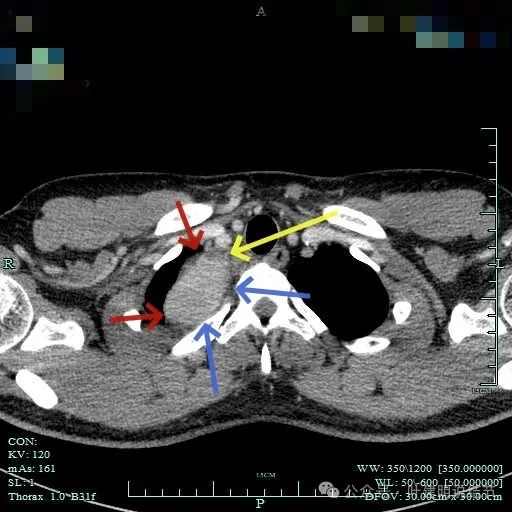
与邻近大血管之间有间隙存在,没有侵犯影响。与胸壁间也没有侵犯。
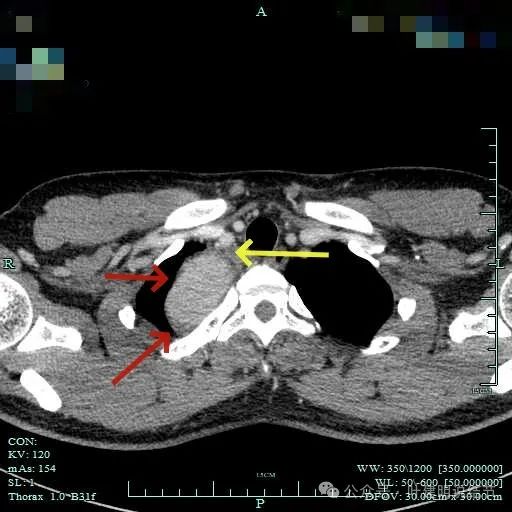
边缘光滑,与血管有间隙,与胸壁紧贴无侵犯。
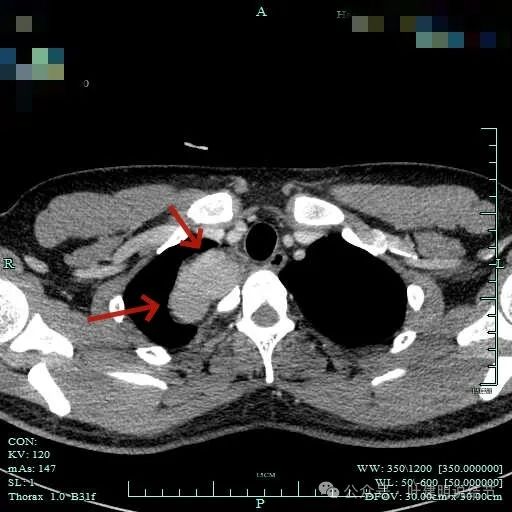
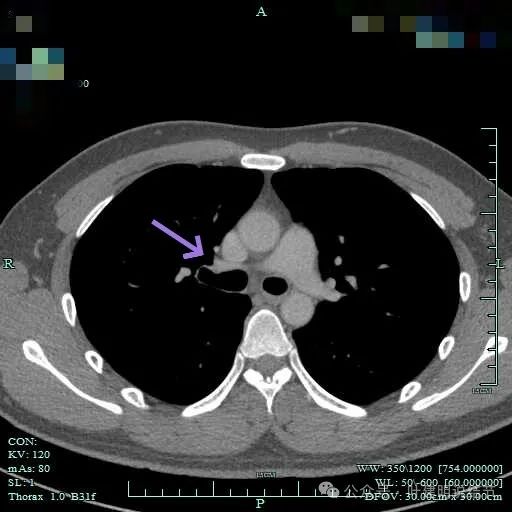
肿瘤较大,约5-6厘米许。
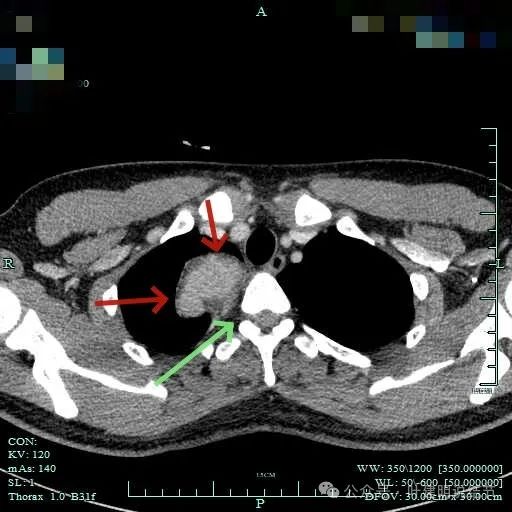
包膜内似乎有低密度区。绿色箭头示与脊髓侧好像也没有明显相连。
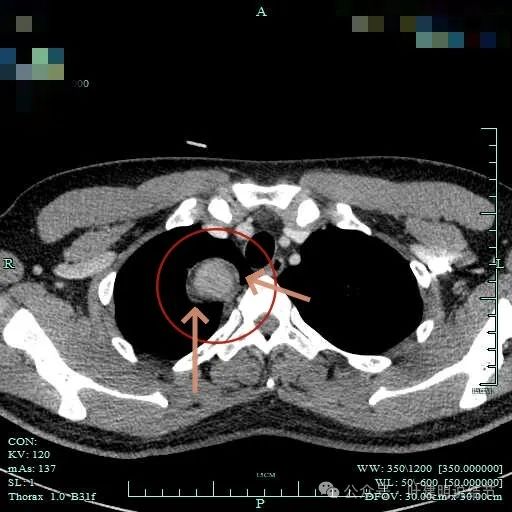
病灶明显有包膜,包膜与肿瘤间有低密度区。
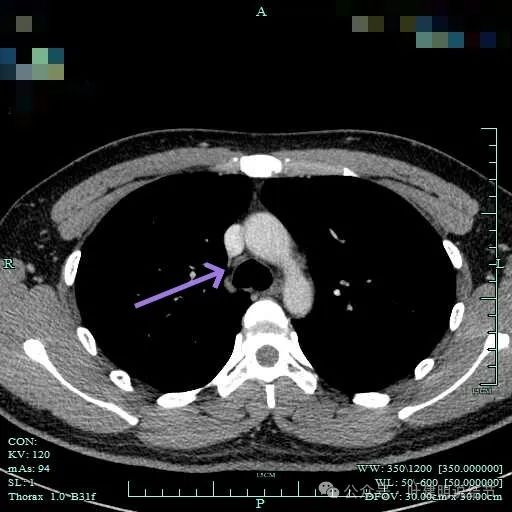
上腔静脉旁无明显肿大淋巴结。
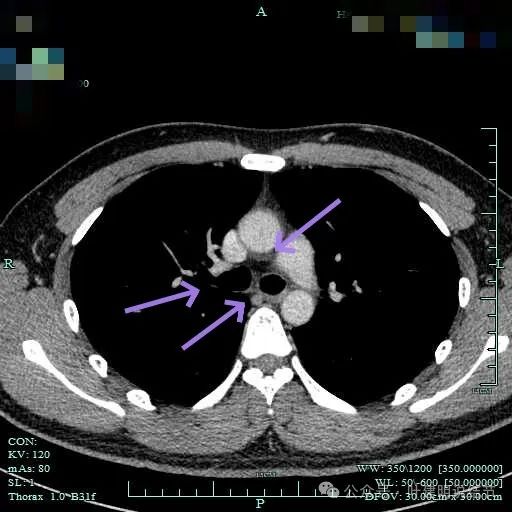
气管下段以及隆突下无明显肿大淋巴结。
隆突下小淋巴结。
肺门无明显肿大淋巴结。
再看磁共振影像:
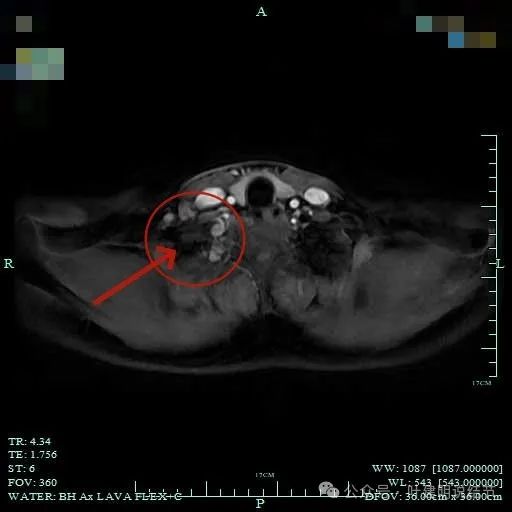
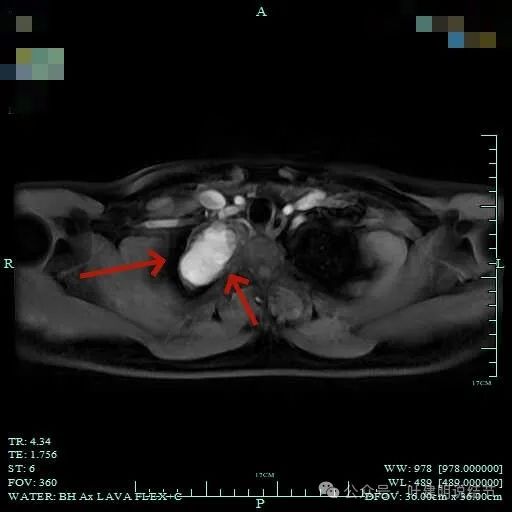
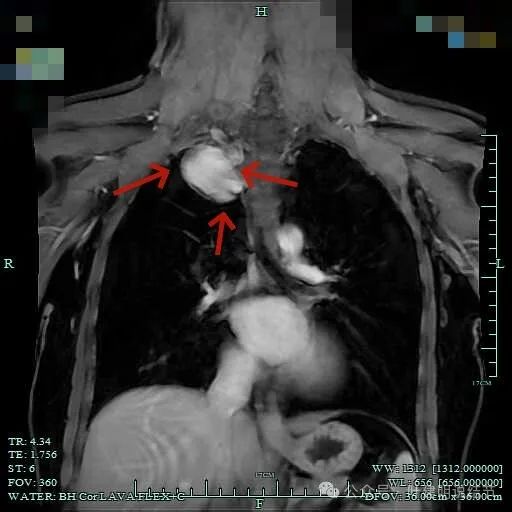
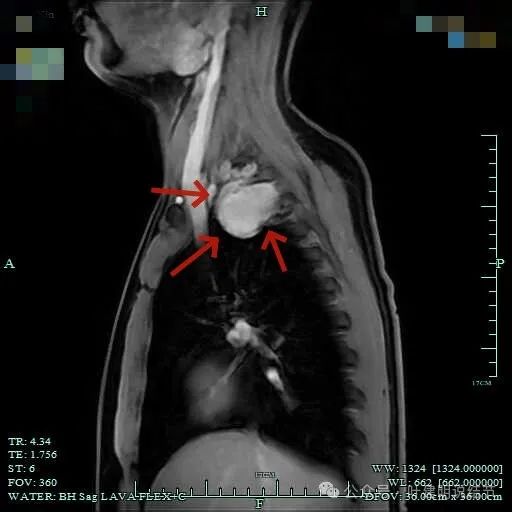
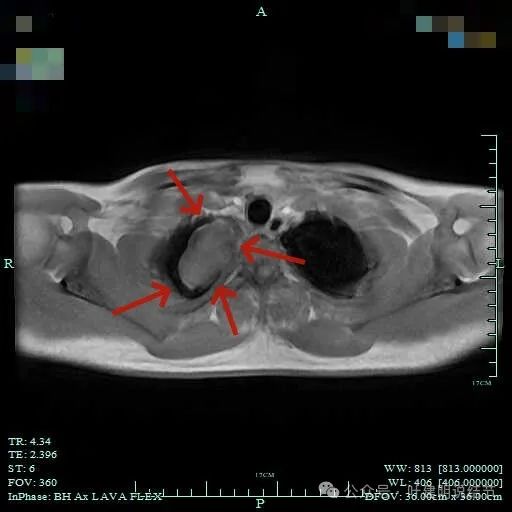
总体上肿瘤没有侵犯周围结构的影像表现。
术前考虑:
1、右上这个病灶不会是炎性,也不会是转移性肿瘤。考虑是良性肿瘤或交界性肿瘤可能性大。
2、由于肿瘤有包膜、表面光滑、较大且与周围结构紧贴却无明显侵犯影响、随访一年无明显增大进展、肺门与纵隔淋巴结无明显肿大淋巴结,所以基本不考虑恶性病变。主要的影响是缓慢增大产生压迫症状,以及过度随访后增加手术难度。所以虽考虑良性或交界性肿瘤,仍建议其手术切除为宜。
3、病灶大部分显得在肺内些,最理想的情况是位于肺间叶组织来源的含蒂的神经纤维瘤之类,进胸后比较游离,楔形切除就可以;若与肺接触面广,或术中快速示低度恶性肿瘤,也可考虑上叶切除;若纵隔神经源性肿瘤,则需要尚脊柱侧游离解剖,只要没有侵犯周围结构,仍应该不会很困难的操作的。
术中情况:
右侧单孔胸腔镜进胸后,发现病灶如下图的情况:’
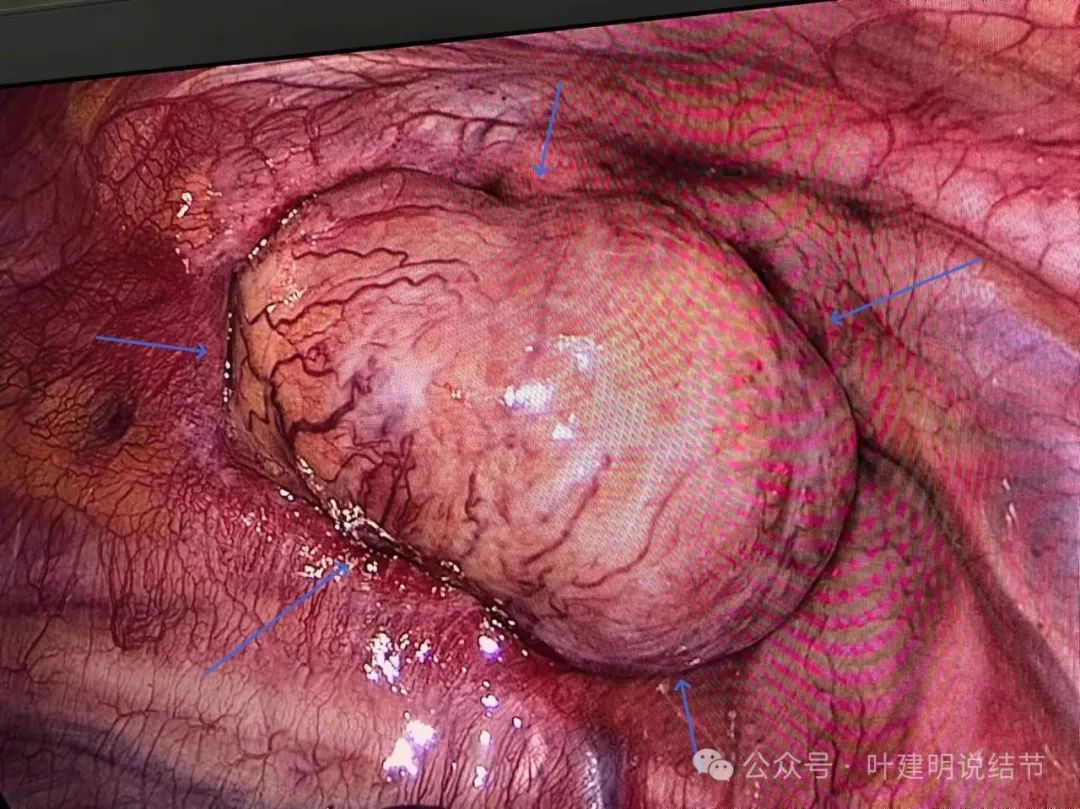
肿瘤虽然表面光滑,但紧紧卡在胸廓入口,既无法按术中最乐观的右上叶部分切除,也无法游离解剖脊柱侧,因为根本推不动,无法显露!我回想之前碰到过一例胸骨后甲状腺肿,也很难做,当时是术中调整体位,颈部切口与胸部切口联合加上部分盲目钝性游离最后才下的手术台。但这个病灶从胸腔侧根本推不动,没法游离,从术前影像上看,从颈部做,大概又比较深,也很难。
术中紧急请江洪主任以及在隔壁手术间开刀的龚晓成主任一起商量,考虑:肿瘤为良性,有包膜,可以试着切开包膜游离解剖。因为从术前影像上看,肿瘤并没有侵犯影响周围的血管与重要结构,所以包膜内游离是安全的,且术前影像上包膜与肿瘤实质之间有低密度区,所以大概率游离得开,并能“剥”出来。明确方向后,龚晓成主任一起上台协助,最后确实如讨论考虑的情况一样,包膜切开能游离得开,并顺利安全切除了肿瘤。
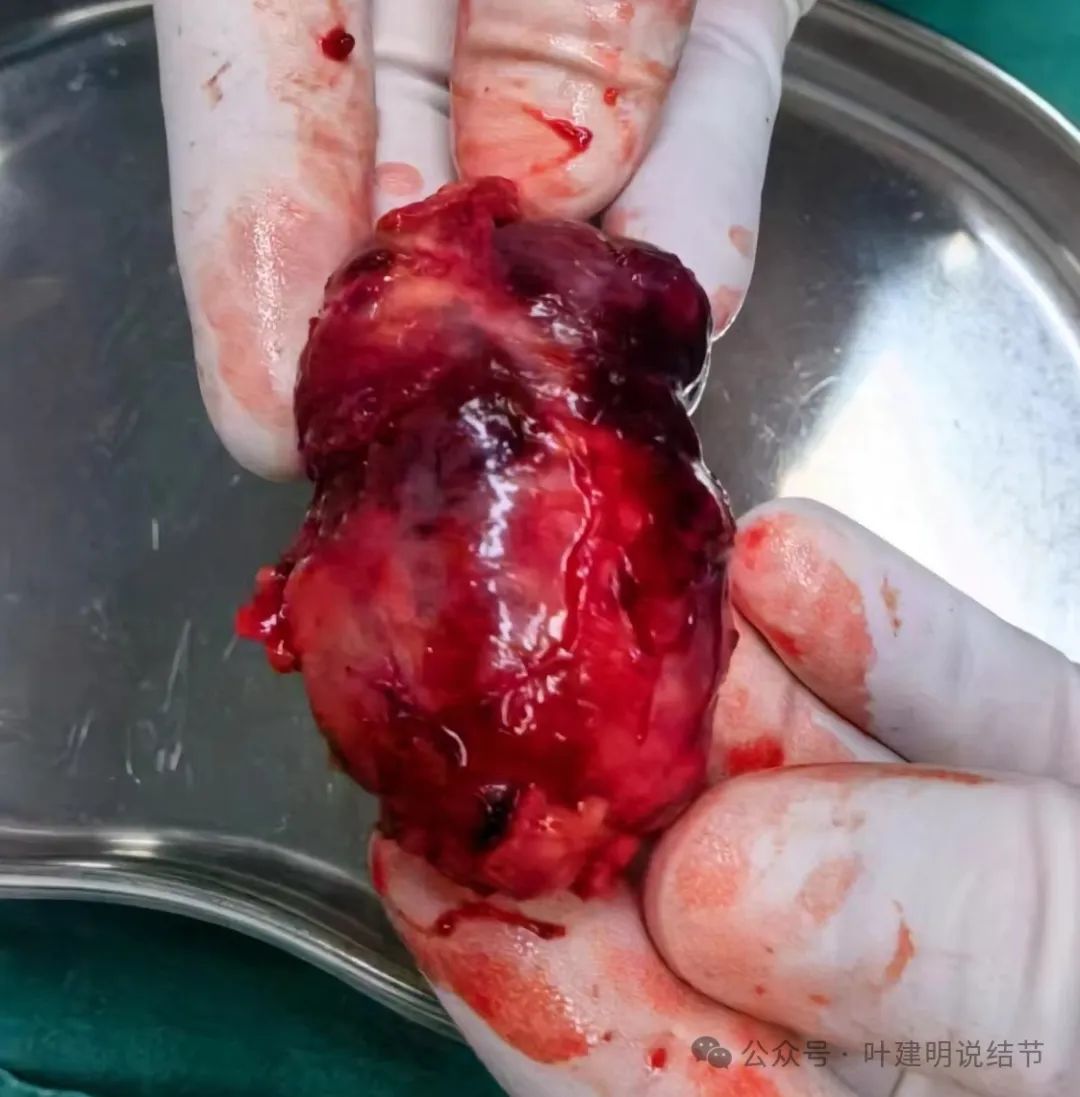
上图示肿瘤,包膜游离部分一并切除,顶上与周围结构粘连的地方安全起见不强求切除。
术后病理结果:

术中快速病理示:考虑胸腺源性肿瘤。这好像与临床不太符合,因为距离胸腺还有距离呢!要么异位胸腺?

常规石蜡病理示:淋巴结组织增生性病变,内见生成中心萎缩,生发中心内见嗜酸性物质沉积,形态首先考虑淋巴结造血系统疾病。

免疫组化最后证实是:符合Castleman病(透明血管型)
这是个什么病?我是第一次见!
延伸理论学习(来源:中国Castleman病诊断与治疗专家共识(2021年版)):
Castleman病(Castleman disease,CD)又称巨大淋巴结病或血管滤泡性淋巴结增生症。2018年CD入选国家卫健委发布的《第一批罕见病目录》。
一、CD的病理特征
淋巴结病理检查是CD诊断的金标准。病理形态上,CD可分为透明血管型CD(hyaline vascular subtype of CD,HV-CD)、浆细胞型CD(plasma cell subtype of CD,PC-CD)及混合型CD(mixed type of CD)。
1.HV-CD(透明血管型):
淋巴结体积通常较大(数厘米至十余厘米),有完整包膜和丰富血供。镜下形态改变主要包括淋巴滤泡增多、生发中心缩小、套细胞区增宽及滤泡间区血管增生。
2.PC-CD(浆细胞型):
肿大淋巴结的体积通常较小。镜下可见HV-CD样淋巴滤泡,但部分病例或部分病灶的滤泡生发中心萎缩不明显。
3.混合型CD:
形态特点兼具HV-CD及PC-CD的特征,可理解为两者的过渡形态或组合形式。
二、CD的临床分型
根据淋巴结受累区域的不同,可将CD分为单中心型CD(unicentric CD,UCD)和多中心型CD(multicentric CD,MCD)。
1.UCD(单中心型):
仅有同一淋巴结区域内一个或多个淋巴结受累的CD被定义为UCD。大多数UCD患者无伴随症状,少数UCD患者伴淋巴结压迫症状、全身症状(如发热、盗汗、体重下降、贫血等)或合并副肿瘤天疱疮、闭塞性细支气管炎、血清淀粉样蛋白A型(AA)淀粉样变等。
2.MCD(多中心型):
有多个(≥2个)淋巴结区域受累(淋巴结短径需≥1 cm)的CD为MCD。与UCD不同,除淋巴结肿大外,MCD患者往往还伴有发热、盗汗、乏力、体重下降、贫血、肝功能不全、肾功能不全、容量负荷过多(全身水肿、胸水、腹水等)等全身表现。
三、CD的诊断流程
有多种疾病(包括恶性肿瘤、感染性疾病及自身免疫性疾病等)也会伴发淋巴结的"Castleman样"病理改变。因此,诊断CD的第一步是排除可能会伴发类似CD淋巴结病理改变的相关疾病,包括(但不限于)感染性疾病(如HIV、梅毒、EB病毒感染,结核等)、肿瘤性疾病(如POEMS综合征、淋巴瘤、滤泡树突细胞肉瘤、浆细胞瘤等)、自身免疫性疾病(如系统性红斑狼疮、类风湿关节炎、自身免疫性淋巴细胞增生综合征等)。
诊断CD的第二步是根据全身查体及影像学检查明确淋巴结受累范围,将患者分型为UCD和MCD。
四、CD的预后及危险度分层
UCD的预后良好,5年生存率超过90%,几乎不影响远期生存。但合并副肿瘤天疱疮和闭塞性细支气管炎的UCD患者预后差。
iMCD预后较差,文献报道的5年生存率仅51%~77%。
五、CD的治疗
1.治疗前评估:
启动治疗前需对患者进行全面评估,相关检查至少应包括:①症状评估:评价有无发热、疲乏、厌食、体重下降、呼吸困难、皮疹、浆膜腔积液相关症状;评价有无肿瘤压迫相关症状;②影像学检查:颈部、胸部、腹部、盆腔(增强)CT检查或全身PET-CT检查,胸部高分辨CT;③鉴别诊断相关检查:病原学检测(HIV抗体及抗原,EB病毒DNA,梅毒抗体,HHV-8 DNA)、免疫相关检测(抗核抗体谱、类风湿因子、免疫球蛋白定量、IgG4)、M蛋白相关检测(血清蛋白电泳、血尿免疫固定电泳);④炎症状态及器官损伤评估:血常规、肝肾功能、红细胞沉降率、C反应蛋白、血清白蛋白、乳酸脱氢酶、IL-6、肺功能(通气+弥散)。
2.UCD的治疗:
无论UCD患者是否伴有高炎症状态或全身症状,对于有可能完整切除病灶的患者,首选外科手术完整切除病灶。
对于无法完整手术切除的病例,首先需要评估有无CD相关症状(如压迫相关症状、高炎症状态或副肿瘤天疱疮等)。对于无症状患者,可采用等待观察的策略。对于存在肿块压迫相关症状的患者,可首选利妥昔单抗±糖皮质激素或利妥昔单抗±化疗,对于用药后肿块体积缩小的患者,若可行完整手术切除,则建议手术切除,对于用药后仍难以完整手术切除病灶的患者,可考虑放疗或动脉栓塞治疗。
3.MCD的治疗:
(1)HHV-8阳性MCD:可以采用以利妥昔单抗为基础的治疗(如利妥昔单抗±脂质体阿霉素/阿霉素±糖皮质激素)。对于同时合并HIV感染的患者,可请相关科室协助制定抗HIV治疗方案。
(2)aMCD:观察随诊。
(3)iMCD:(略)
MCD的推荐治疗路径见图3。
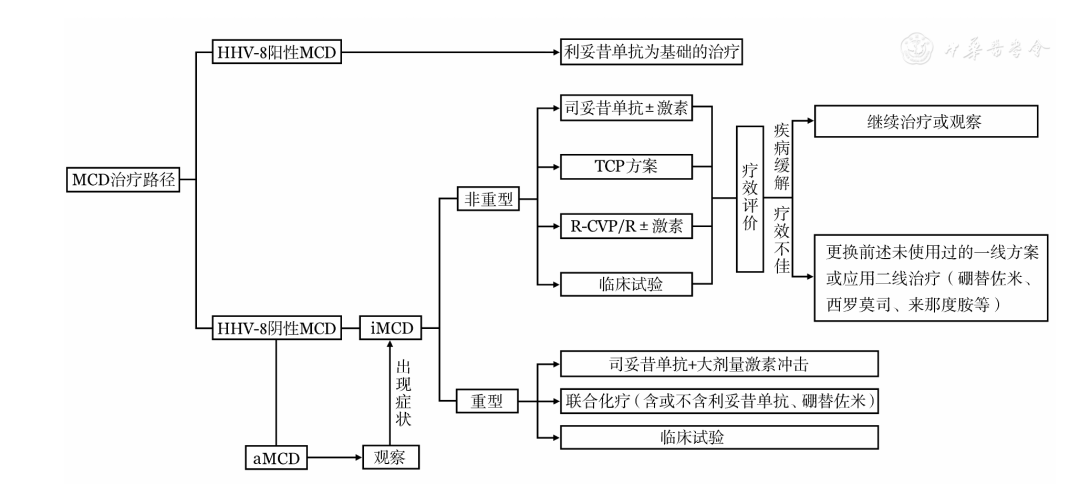
HHV-8:人类疱疹病毒-8;aMCD:无症状性MCD;iMCD:特发性MCD;TCP:沙利度胺+环磷酰胺+泼尼松;R-CVP:利妥昔单抗+环磷酰胺+长春新碱+泼尼松;R:利妥昔单抗;激素:糖皮质激素
▲图3 多中心型Castleman病(MCD)的推荐治疗路径
六、CD的疗效评估
1.UCD的疗效评价:
根据术后1~3个月时的影像学评估手术切除后局部病灶残留情况,之后每年复查影像学,评估有无术后复发。
2.iMCD的疗效评价:
iMCD的核心治疗目标是控制高炎症状态,而非淋巴结大小。疗效评价标准推荐采用CDCN 2017年版疗效评估标准(略)。


