深度解读中新两国备忘录:MitoQ分子解锁抗衰密码
时间:2024-07-02 14:03:27 热度:37.1℃ 作者:网络
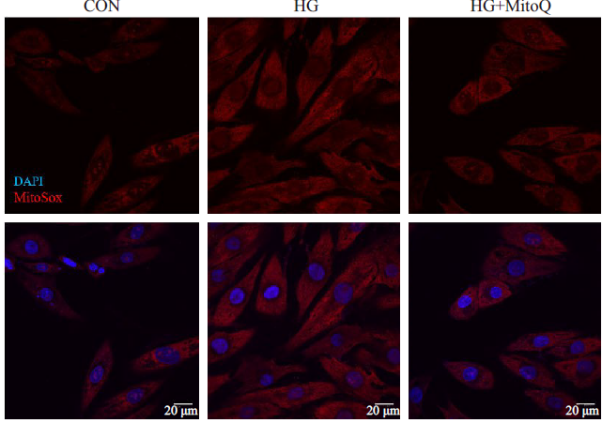
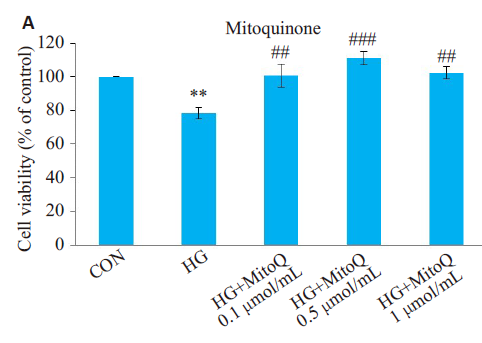
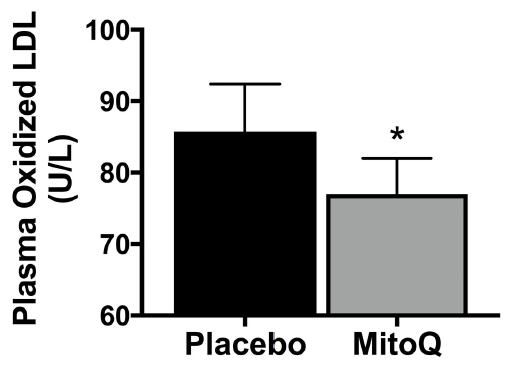
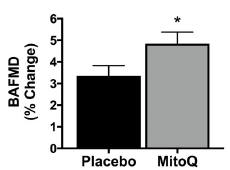
2024年6月14日,中方赴新访问期间,签署了两国在推进健康老龄化慢性病防治的战略合作备忘录,该科研项目由浙江大学和新西兰奥克兰大学合作开展,由新西兰企业MitoQ LIMIT独家支持,成为此次新西兰中国商业伙伴关系签约仪式的唯一一个健康科研项目,致力于为全球健康老龄化提供有效方案。 新西兰总理拉克森(Christopher Luxon)和贸易部长麦克莱(Todd McClay)及十二家新西兰企业与各自的中国合作伙伴签约代表 贸易部长麦克莱(Todd McClay)与MitoQ LIMITED首席执行官Mahara lnglis、浙江大学杨廷忠教授及奥克兰大学代表 01两国最新科研项目引领抗衰老领域新方向探索我国健康老龄化之路 我国是世界上老年人口最多、老龄化速度最快的国家之一,预计2025年每5名中国人中就有1名60岁以上的老年人,近80%的老年人至少患有一种以上慢性病,健康状况不容乐观1。衰老是每个人必经且不可逆转的生命历程2,实现健康老龄化已成为全球主流课题。目前,线粒体靶向抗氧化剂是全球抗衰老研究热门方向。上世纪90年代,剑桥大学的Mike Murphy教授研发出一种线粒体靶向抗氧化剂——米托醌(MitoQ分子,后简称MitoQ)。经历漫长的沉淀,已有数百篇研究积极探索了MitoQ在抗衰老、改善心血管功能等细胞健康相关维度的益处。在此背景下,我国浙江大学和新西兰奥克兰大学展开合作,继续探索“健康老龄化”的前沿科技——MitoQ在临床中的作用与价值。 MitoQ分子,靶向直达细胞线粒体 02衰老起始于人体内每一个细胞维持人体内“能量工厂”的正常运转是关键 衰老是每一条皱纹,每一根白发,还是每一次体力衰退?其实这些都只是外在表现,真正的衰老悄然无声,始于体内每一个细胞,当其基本功能开始衰退,器官逐渐失去功能3,随之发生衰老相关慢性疾病4。是什么让细胞开始衰老?让我们深入内部,解开衰老“密码”。 人体由37万亿细胞组成5,每个细胞中有数千个“能量工厂”——线粒体6,负责提供生命活动所需能量的80%-90%7。它们负责将食物中营养物质(葡萄糖、脂肪、蛋白质等)和氧气转化为ATP8——这是人体最主要、最基本的燃料,驱动细胞完成生理活动。然而“工厂”还会产生额外的副产物,这就是自由基9。 自由基是一种含有不成对电子的化学物质,在人体内是一把“双刃剑”。正常情况下自由基对细胞信号传递、维持内环境稳态等多方面起重要作用10,但是随着年龄增长,线粒体功能下降,对自由基的“管理能力”下降,过量的自由基就会破坏细胞的形态和功能,引发氧化损伤,进一步加速衰老及相关慢性疾病的发生11,12。 03MitoQ深入细胞内部的“能量工厂”结合自由基助力细胞修复与机体年轻化 有效对抗自由基对线粒体的破坏是抗衰老及心血管疾病的重要方向之一,近年来科学家们特别关注针对线粒体的抗氧化剂,帮助中和自由基,减轻氧化损伤,帮助延缓衰老13。MitoQ是目前研究最为热门的线粒体靶向抗氧化剂之一,与普通抗氧化剂相比,MitoQ有何神奇之处呢? MitoQ精准靶向线粒体,深入自由基产生“源头”,较其他非靶向抗氧化剂清除能力增强数百倍10 线粒体内部是产生自由基的“源头”,然而其双层膜结构通常会将普通的抗氧化剂“拒之门外”,导致较低的自由基清除效率,对抗线粒体氧化损伤的效果并不理想。而MitoQ在辅酶Q10的基础上结合了亲脂性阳离子三苯基磷 (TPP),相当于搭载“智能导航系统”,快速定位并进入细胞线粒体,相比其他非靶向抗氧化剂,MitoQ在线粒体内的浓度大约高出 1000 倍,清除自由基的能力增强数百倍,有效减少线粒体损伤,发挥强大的抗氧化作用14,15。 临床研究发现,MitoQ抑制并清除线粒体内部自由基的积累,保护细胞免受氧化应激损伤,焕发细胞活力16,17。 MitoQ显著降低线粒体氧自由基水平17 上图所示细胞内线粒体氧自由基变化平均荧光强度。相比HG组,添加MitoQ后荧光强度减弱,代表线粒体内自由基水平降低。 CON:正常对照组 HG:高糖损伤组(自由基水平增强) HG+MitoQ:高糖损伤组添加MitoQ MitoQ显著增强细胞活性17 上图所示细胞活性水平。相比HG组,添加MitoQ后细胞活性水平显著增强,接近正常细胞。 CON:正常对照组 HG:高糖损伤组,细胞活性下降 HG+MitoQ:高糖损伤组添加MitoQ 2MitoQ在体内可循环利用,提高生物利用率,延长抗氧化作用时间 MitoQ具有“自我修复”的能力,可以在体内不断循环利用。进入线粒体后,首先完成清除自由基的“使命”,之后它会与线粒体里的其他复合物发生反应,再次变得活跃,实现循环再利用,从而清除更多的自由基。这种独特的循环利用机制,使得MitoQ能够在长时间内持续发挥抗氧化作用,保护线粒体免受氧化应激的损害19。 3MitoQ改善人体内氧化应激水平,支持抗击衰老的同时改善血管功能、抑制大脑皮层神经元凋亡,多领域协同助力健康老龄化的实现 自由基水平升高导致氧化应激,严重损害细胞健康,并加速机体衰老19。为了促进健康老龄化,体外研究发现,MitoQ提高机体抗氧化功能,提升细胞健康20,助力延缓衰老。 首个改善人体血管功能的抗氧化剂临床研究发现,健康人群服用MitoQ 6周后氧化应激水平降低,血管功能显著改善21。 MitoQ显著改善体内氧化应激水平21 上图所示氧化应激标志物(氧化低密度脂蛋白)水平。相比安慰剂组,服用MitoQ明显降低13%氧化应激标志物浓度。 Placebo:安慰剂组 MitoQ:服用MitoQ组 MitoQ动脉扩张水平增加了42%21,这意味着血管“年轻”了15-20岁 上图所示肱动脉血流介导扩张 (BAFMD)水平。相比安慰剂组,服用MitoQ明显提高42%动脉扩张率。 Placebo:安慰剂组 MitoQ:服用MitoQ组 随着大众对健康意识的提升,不仅关注良好的生活方式,更重视饮食和营养成分的摄入。作为近年来抗衰研究的热门“黑科技”,MitoQ快速并持久降低线粒体内自由基水平,帮助改善血管功能,降低与年龄相关心血管疾病风险等。本次浙江大学和奥克兰大学的科研合作,积极践行《“健康中国2030”规划纲要》,进一步探索MitoQ在抗衰等更多细胞健康领域的突破与创新,迎接细胞的健康新生。 ---参考文献--- 1. 国家卫健委等. “十四五”健康老龄化规划. 国卫老龄发〔2022〕4号 2. China Kadoorie Biobank Collaborative Group. Healthy lifestyle and life expectancy free of major chronic diseases at age 40 in China. Nat Hum Behav. 2023 Sep;7(9):1542-1550. 3. O'Loghlen A. The potential of aging rejuvenation. Cell Cycle. 2022 Jan;21(2):111-116. 4. Guo, J., et al. Aging and aging-related diseases: from molecular mechanisms to interventions and treatments. Sig Transduct Target Ther 7, 391 (2022). https://doi.org/10.1038/s41392-022-01251-0 5. Roy AL, Conroy RS. Toward mapping the human body at a cellular resolution. Mol Biol Cell. 2018 Aug 1;29(15):1779-1785. 6. Pizzorno J. Mitochondria-Fundamental to Life and Health. Integr Med (Encinitas). 2014 Apr;13(2):8-15. 7. 付玉, 等. 线粒体生物学性状及细胞衰老和运动的影响. 中国组织工程研究. 2012, (11): 2063 -2066. 8. Khalil M, et al. The Potential of the Mediterranean Diet to Improve Mitochondrial Function in Experimental Models of Obesity and Metabolic Syndrome. Nutrients. 2022 Jul 28;14(15):3112. 9. Kowalczyk P, et al. Mitochondrial Oxidative Stress-A Causative Factor and Therapeutic Target in Many Diseases. Int J Mol Sci. 2021 Dec 13;22(24):13384. 10.汪启兵, 许凡萍, 魏超贤, 彭娟, 董旭东 . 人体内自由基的研究进展. 中华流行病学杂志, 2016, 37(8): 1175-1182 11. Lee YH, et al. Targeting Mitochondrial Oxidative Stress as a Strategy to Treat Aging and Age-Related Diseases. Antioxidants (Basel). 2023 Apr 15;12(4):934. 12. Stefanatos R, Sanz A. The role of mitochondrial ROS in the aging brain. FEBS Lett. 2018 Mar;592(5):743-758. 13. Braakhuis AJ, Nagulan R, Somerville V. The Effect of MitoQ on Aging-Related Biomarkers: A Systematic Review and Meta-Analysis. Oxid Med Cell Longev. 2018 Jul 12;2018:8575263. 14. Mao H, et al. Mitochondria-Targeted Antioxidant Mitoquinone Maintains Mitochondrial Homeostasis through the Sirt3-Dependent Pathway to Mitigate Oxidative Damage Caused by Renal Ischemia/Reperfusion. Oxid Med Cell Longev. 2022 Sep 20;2022:2213503. 15. Sun C, et al. MitoQ regulates autophagy by inducing a pseudo-mitochondrial membrane potential. Autophagy. 2017 Apr 3;13(4):730-738. 16. Pletjushkina OY, et al. Effect of oxidative stress on dynamics of mitochondrial reticulum. Biochim Biophys Acta. 2006 May-Jun;1757(5-6):518-24. 17. 王佳慧, et al. 抑制线粒体活性氧自由基可减轻高糖诱导的心肌细胞焦亡和铁死亡[J]. 南方医科大学学报, 2021, 41(7): 980-987. 18. Capeloa T, et al. Inhibition of Mitochondrial Redox Signaling with MitoQ Prevents Metastasis of Human Pancreatic Cancer in Mice. Cancers (Basel). 2022 Oct 7;14(19):4918. 19. Maldonado, E.; Morales-Pison, S.; Urbina, F.; Solari, A. Aging Hallmarks and the Role of Oxidative Stress. Antioxidants 2023, 12, 651. https://doi.org/10.3390/antiox12030651 20. Zhang S, et al. MitoQ Modulates Lipopolysaccharide-Induced Intestinal Barrier Dysfunction via Regulating Nrf2 Signaling. Mediators Inflamm. 2020 Apr 11;2020:3276148. 21. Rossman MJ, et al. Chronic Supplementation With a Mitochondrial Antioxidant (MitoQ) Improves Vascular Function in Healthy Older Adults. Hypertension. 2018 Jun;71(6):1056-1063.