Nature:揭示肿瘤进化新机制:体内单细胞CRISPR筛选解码TNF信号
时间:2024-07-20 06:02:33 热度:37.1℃ 作者:网络
引言
肿瘤的进化模型认为,恶性转化之前,癌基因中会出现随机分布的驱动突变,这些突变会在表型正常的组织中引起克隆扩增。虽然克隆扩增能够重塑整个组织,但仅有少数克隆会转化为恶性肿瘤,其具体机制仍然不明。为了解决这一问题,7月17日Nature的研究报道“In vivo single-cell CRISPR uncovers distinct TNF programmes in tumour evolution”提出了一种新的体内单细胞CRISPR策略,系统地研究了150种最常见的鳞状细胞癌基因在整个组织中的克隆动态。
研究团队结合了超声引导的子宫内病毒微注射、单细胞RNA测序(single-cell RNA sequencing, scRNA-seq)和导向捕获技术(guide capture),能够纵向监测克隆扩增并在单细胞转录组水平上记录其基因程序。通过这一策略,研究发现了一个依赖于TNF受体1(TNFR1)并涉及巨噬细胞(macrophages)的肿瘤坏死因子(TNF)信号模块,该模块在表皮组织中是克隆扩增的常见驱动因素。
然而,在肿瘤发生过程中,TNF信号模块被下调。相反,研究发现了一种侵袭性癌细胞的亚群,这些细胞切换到一个与上皮-间质转化(epithelial–mesenchymal transition, EMT)相关的自分泌TNF基因程序(autocrine TNF gene programme)。研究提供了体内证据表明,自分泌TNF基因程序足以介导侵袭性特性,并且TNF特征与鳞状细胞癌(squamous cell carcinoma, SCC)患者的较短总体生存期相关。
总的来说,这项研究展示了应用体内单细胞CRISPR筛选技术研究哺乳动物组织的强大力量,揭示了肿瘤进化中不同的TNF程序,并强调了理解表皮中克隆扩增与肿瘤发生之间关系的重要性。研究结果不仅为癌症的发生和发展提供了新的见解,还为未来开发针对TNF信号通路的治疗策略提供了理论基础。

肿瘤进化的理论认为,恶性转化是由癌基因中的随机驱动突变引起的,这些突变导致表型正常组织中的克隆扩增。虽然这些克隆扩增能够重塑整个组织,但最终只有少数克隆会转化为恶性肿瘤。理解这些克隆扩增的动态及其基因程序对于揭示肿瘤发生的机制具有重要意义。该研究开发的体内单细胞CRISPR策略结合了超声引导的子宫内病毒微注射、单细胞RNA测序(single-cell RNA sequencing, scRNA-seq)和导向捕获技术(guide capture),能够纵向监测克隆扩增并在单细胞转录组水平上记录其基因程序。
研究团队选取了150种最常见的鳞状细胞癌基因,使用体内单细胞CRISPR筛选策略来研究这些基因在表皮组织中的克隆扩增动态。具体方法包括:
构建CRISPR库:选取了150种最常见的鳞状细胞癌基因,包括134种突变基因和16种拷贝数变异(copy number variations, CNVs),其中15种是扩增的CNVs。
超声引导的子宫内病毒微注射:将携带CRISPR库的慢病毒注射到E9.5小鼠胚胎的羊膜腔内,以感染表达Cas9的表皮前体细胞。感染后的细胞会携带特定的sgRNA,用于引导Cas9进行基因编辑。
单细胞RNA测序(scRNA-seq):在小鼠出生后的第4天(P4)和第60天(P60)分别收集表皮组织,对mCherry阳性的感染细胞进行单细胞RNA测序,以评估基因表达谱并捕获sgRNA身份。
研究生成了总计477,773个单细胞的RNA测序库。通过严格的过滤和sgRNA注释,获得了120,077个P4单细胞和183,084个P60单细胞,平均每个时间点覆盖240个P4细胞和366个P60细胞。为了减少双sgRNA感染的情况,感染率控制在1%至12.5%之间。
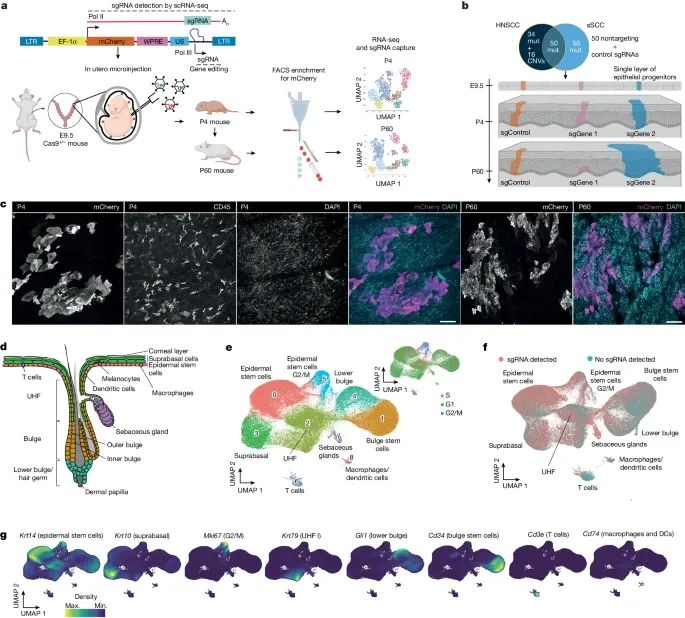
体内单细胞CRISPR筛选策略成功地在小鼠皮肤中实现了对克隆扩增的监测,并通过单细胞转录组学数据详细解析了各个细胞群的基因程序和克隆动态(Credit: Nature)
体内CRISPR筛选策略:图a展示了体内CRISPR筛选策略的示意图,包括超声引导的子宫内微注射技术,将携带500个单导向RNA(sgRNA)的慢病毒库注射到E9.5小鼠胚胎的羊膜腔内,以感染单层表皮前体细胞。
目标基因:图b显示了sgRNA库的目标,这些目标包括人类头颈部鳞状细胞癌(HNSCC)和皮肤鳞状细胞癌(sSCC)中最常见的150个突变基因(134个突变基因和16个拷贝数变异)。
免疫荧光染色:图c展示了在P4和P60小鼠皮肤中mCherry阳性克隆扩增的整体免疫荧光染色结果,确认了表皮中mCherry阳性细胞群的明确分离。
细胞类型分布:图d展示了P60小鼠皮肤中不同细胞群的位置分布示意图。
UMAP分析:图e展示了通过体内单细胞CRISPR策略识别出的P60小鼠皮肤中的9种细胞群的UMAP(统一流形近似与投影)分析结果,包括表皮干细胞、上基底细胞、毛囊细胞、皮脂腺细胞、T细胞和巨噬细胞等。
sgRNA检测:图f展示了在所有主要细胞群中均匀检测到sgRNA的UMAP结果。
特异性标志基因表达:图g展示了细胞类型特异性标志基因的表达密度图,例如Krt10(上基底细胞)、Krt14(表皮干细胞)、Cd34(毛囊干细胞)和Mki67(G2/M期标志基因)。
克隆扩增的识别
通过单细胞RNA测序和sgRNA捕获,研究团队识别出了在P4和P60小鼠皮肤中的9-10种不同的sgRNA含有细胞类型,包括表皮干细胞(epidermal stem cells, EpSCs)、上基底细胞、毛囊细胞、皮脂腺细胞、T细胞和巨噬细胞。经典标志基因如Krt14(表皮干细胞)、Krt10(上基底细胞)和Cd34(毛囊干细胞)在相应的细胞群中显示出特异性表达。
TNF信号模块的发现
研究发现一个依赖于TNF受体1(TNFR1)并涉及巨噬细胞(macrophages)的肿瘤坏死因子(TNF)信号模块,该模块在表皮组织中是克隆扩增的一般驱动因素。然而,在肿瘤发生过程中,TNF信号模块被下调。相反,研究发现了一种侵袭性癌细胞的亚群,这些细胞切换到一个与上皮-间质转化(epithelial–mesenchymal transition, EMT)相关的自分泌TNF基因程序(autocrine TNF gene programme)。
基因程序分析
通过单细胞RNA测序数据分析,研究团队使用加权基因相关网络分析(WGCNA)识别出了P60细胞群中的44个基因模块。其中一个主要基因模块在6个细胞群中占主导地位,包含25个基因,并显示出显著的TNF信号富集。研究发现高表达TNF基因模块的克隆扩增率较高,这表明TNF信号模块在克隆扩增中的重要作用。
克隆扩增与肿瘤发生的关系
为了进一步验证TNF信号模块在肿瘤进化中的作用,研究团队进行了多个实验,发现TNFR1依赖性和巨噬细胞消耗的数据提供了强有力的实验证据,支持了TNF信号模块在正常表皮中克隆扩增中的功能作用。此外,研究发现,在克隆扩增向肿瘤发生的转变过程中,癌细胞会下调用于克隆扩增的TNF模块,并切换到自分泌TNF-MMP9和MMP10轴,促进侵袭性肿瘤的形成。
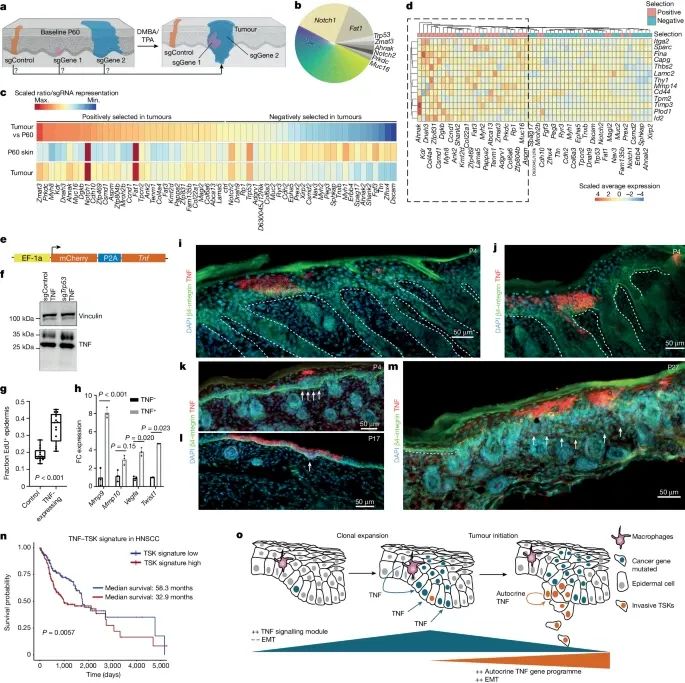
上皮细胞中的TNF表达不仅能够诱导侵袭特性,还通过自分泌途径激活MMP基因表达,从而促进肿瘤细胞的侵袭和转移(Credit: Nature)
实验设计与TNF表达构建:图a展示了用于验证上皮TNF诱导侵袭特性的实验设计示意图。研究团队设计了一个携带TNF表达构建体的慢病毒,并将其注射到E9.5小鼠胚胎中,观察其在P60阶段对皮肤细胞的影响。
TNF蛋白表达验证:图b展示了在不同基因敲除背景下,TNF蛋白的表达情况,通过免疫印迹(Western blot)确认了TNF在这些背景中的表达。
TNF诱导侵袭特性的验证:图c展示了TNF诱导侵袭特性的具体实验结果。通过流式细胞术(FACS)和免疫荧光染色,研究团队观察到在表达TNF的小鼠皮肤细胞中,侵袭性标志基因(如Mmp9和Mmp10)的表达显著增加。
侵袭性细胞的比例:图d展示了在表达TNF的小鼠皮肤细胞中,侵袭性细胞所占比例的变化。结果表明,TNF表达显著增加了皮肤中侵袭性细胞的比例。
空间转录组学分析:图e展示了通过Visium空间转录组学技术,对肿瘤细胞的空间分布和基因表达情况的分析。结果显示,表达Mmp10的侵袭性肿瘤细胞主要分布在肿瘤的侵袭前沿,与基底膜标志基因(如β4-integrin)的共定位。
细胞共现分析:图f展示了细胞共现分析结果,表明表达Mmp10的侵袭性肿瘤细胞与纤维细胞和内皮细胞共存,形成了一个与纤维血管相关的生态位。
肿瘤细胞的选育分析:图g展示了对不同sgRNA突变体在肿瘤中选育情况的分析。结果表明,某些基因突变(如Zmat3、Prkdc、Myh8等)在肿瘤细胞中的表达显著增加,提示这些基因突变与肿瘤细胞的侵袭特性有关。
基因表达谱对比:图h展示了正向选择和负向选择突变体在P60阶段的基因表达谱对比分析,显示了正向选择突变体中上皮-间质转化(EMT)相关基因的显著富集。
以前的研究表明,驱动突变在正常人类上皮组织中具有惊人的高频率,如皮肤、食管或结肠。这些研究揭示了高竞争力的驱动突变克隆可以通过克隆竞争消除新出现的肿瘤,从而具有抑制肿瘤的作用。这一观察结果进一步突显了理解正常上皮中的克隆扩增及其在驱动恶性转化中的作用的必要性。
传统的CRISPR筛选方法通常只能提供简单的结果,如增殖,而无法详细分析基因扰动在所有细胞类型中的转录组后果。通过结合超声引导的子宫内病毒微注射、单细胞RNA测序和导向捕获技术,该研究克服了这一局限性,实现了对正常上皮和肿瘤发生过程中基因功能的全面了解。
总的来说,该研究通过创新的体内单细胞CRISPR筛选策略,揭示了肿瘤进化中的不同TNF信号程序,并强调了理解表皮中克隆扩增与肿瘤发生之间关系的重要性。研究结果不仅为癌症的发生和发展提供了新的见解,还为未来开发针对TNF信号通路的治疗策略提供了理论基础。通过对研究方法、结果和观点的详细分析和扩展,我们可以更深入地理解这项研究的意义及其对未来癌症研究和治疗的潜在影响。
参考文献
Renz PF, Ghoshdastider U, Baghai Sain S, Valdivia-Francia F, Khandekar A, Ormiston M, Bernasconi M, Duré C, Kretz JA, Lee M, Hyams K, Forny M, Pohly M, Ficht X, Ellis SJ, Moor AE, Sendoel A. In vivo single-cell CRISPR uncovers distinct TNF programmes in tumour evolution. Nature. 2024 Jul 17. doi: 10.1038/s41586-024-07663-y. Epub ahead of print. PMID: 39020166.
https://www.nature.com/articles/s41586-024-07663-y


