Cardiovasc Diabetol:肝素酶抑制保护内皮糖萼和预防糖尿病微血管并发症研究
时间:2024-07-21 22:00:36 热度:37.1℃ 作者:网络
目前,全球超过8%的成年人患有糖尿病。糖尿病对心血管健康有负面影响,因此是影响多个血管床的微血管疾病发展的危险因素。糖尿病最常见的两种微血管并发症是糖尿病视网膜病变(DR)和糖尿病肾病(DKD)。DR是导致工作年龄人群视力损害和视力丧失的主要原因,影响全球超过34%(约9300万人)的糖尿病患者。DKD影响高达40%的糖尿病患者(> 1.16亿人),是导致终末期肾衰竭的主要原因。

DR和DKD均以微血管屏障功能障碍为特征,导致血管通透性增加。血液-视网膜屏障由包围基底膜的周细胞和单层无孔内皮细胞组成,形成了相对不透水的屏障。在糖尿病性黄斑水肿(DME)中,这一屏障的破坏会导致液体和循环蛋白的异常血管泄漏,从而导致糖尿病性黄斑水肿(DME)。在肾脏中,肾小球滤过屏障由称为足细胞的特化上皮细胞组成,这些细胞具有交错的足细胞足突,包裹在肾小球基底膜和开窗内皮细胞周围。它对水和小溶质有很高的渗透性,但对大分子没有渗透性。DKD的特征是尿白蛋白排泄(蛋白尿)增加,这是由于肾小球滤过屏障受损导致通透性增加。糖尿病患者的前瞻性和流行病学研究表明,微量白蛋白尿(即尿中少量白蛋白)的发生是肾脏疾病进展的独立预测因子。
内皮糖萼(eGlx)排列在血管内皮细胞的管腔表面。它已成为内皮和血管健康的关键决定因素,包括通过其在屏障功能中的作用。eGlx是一个多功能结构,作为;它是内皮细胞的保护层,是免疫细胞和分子粘附的调节剂,也是循环血液中大分子的屏障。eGlx限制了细胞因子对内皮细胞的激活,对这一保护层的损伤与内皮功能障碍和通透性增加有关,这是DR和DKD的一个关键特征。eGlx是一种富含碳水化合物的层,主要由蛋白聚糖和糖胺聚糖(GAGs)组成,包括硫酸肝素(HS)、硫酸软骨素和透明质酸。HS链延伸是HS合成的关键步骤,由HS聚合酶完成,HS聚合酶是由两种糖基转移酶Exotosin-1 (Ext1)和Exotosin-2 (Ext2)组成的异源二聚体。高尔基体中HS合成完成后,膜HS蛋白聚糖被运送到细胞表面虽然基质金属蛋白酶(MMP)酶家族可以切割eGlx中发现的HS蛋白聚糖核心蛋白,如Syndecan-4,但heparanase-1是已知唯一能够直接切割HS的哺乳动物内糖苷酶,在糖尿病中全体性上调。DR患者的玻璃体和视网膜前膜以及DKD患者的肾脏中的肝素酶升高。我们假设eGlx HS在视网膜和肾小球毛细血管的屏障特性中起关键作用,抑制肝素酶来保护eGlx HS,可以作为一种新的系统性方法来保护糖尿病患者的微血管并发症。
本研究表明,HS在eGlx体内微血管屏障功能中起关键作用。我们首次证明,在2型糖尿病小鼠模型中,eGlx可以被新型肝素酶抑制剂OVZ/HS-1638靶向治疗,这是一种独特的四价树突状肝素酶抑制剂,没有靶向抗凝活性,以预防糖尿病多血管床(即眼睛和肾脏)的微血管功能障碍
方法:采用两种硫酸肝素缺失小鼠模型(酶去除和内皮特异性外泌素-1敲低基因消融),研究内皮细胞表面(即内皮糖基)硫酸肝素缺失对微血管屏障功能的影响。采用荧光显微镜或透射电镜观察内皮糖萼的变化。为了测量对屏障功能的影响,我们在眼睛中使用了荧光素钠血管造影,在肾脏中使用了肾小球白蛋白通透性测定。采用一种新型肝素酶抑制剂OVZ/HS-1638治疗2型糖尿病(T2D, db/db)小鼠模型,以确定预防硫酸肝素损伤的治疗潜力。如上所述测量内皮糖盏的变化,并通过眼睛白蛋白外渗和肾脏肾小球渗透性测定来评估微血管屏障功能。
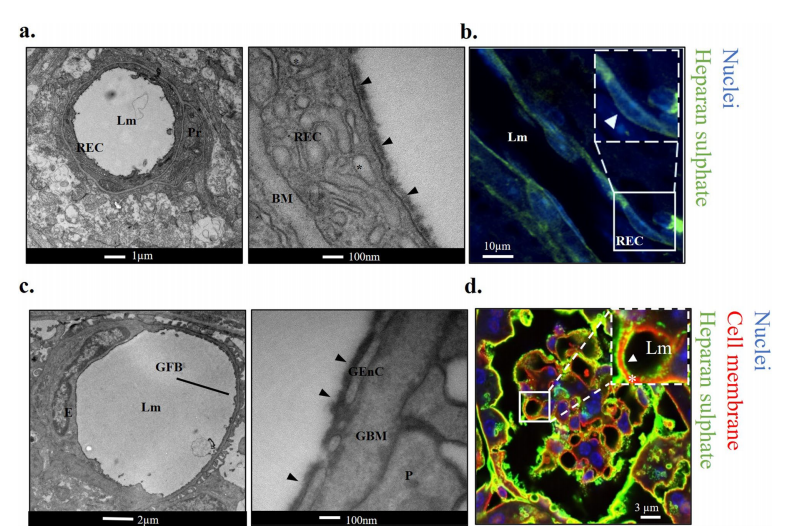
HS是视网膜和肾小球微血管中eGlx屏障的一部分。a左:心脏灌注阿利新蓝和戊二醛后小鼠视网膜血管的低倍电镜图像。显示有管腔(Lm)、视网膜内皮细胞(REC)和周细胞(Pr)。右:高倍图像显示REC管腔侧eGlx染色(箭头)。基底膜(BM)显示。REC囊泡(*)也可见。b抗hs染色的视网膜脂肪块(绿色)。蓝色的DAPI。显示视网膜内皮细胞(REC)和管腔(Lm)。注意REC核管腔侧的绿色信号(箭头),表明在eGlx中存在HS。c左:心脏灌注阿利新蓝和戊二醛后小鼠肾小球毛细血管的低倍电镜图像。显示管腔(Lm)和肾小球滤过屏障(GFB)。右图:高倍图像显示管腔肾小球内皮细胞(GEnC)的eGlx染色(箭头)。肾小球基底膜(GBM)和足细胞(P)显示。d小鼠肾组织抗hs染色为绿色,DAPI染色为蓝色,膜染色为红色(R18)。插图显示放大后的血管管腔(LM)侧eGlx HS染色(白色箭头)图像。
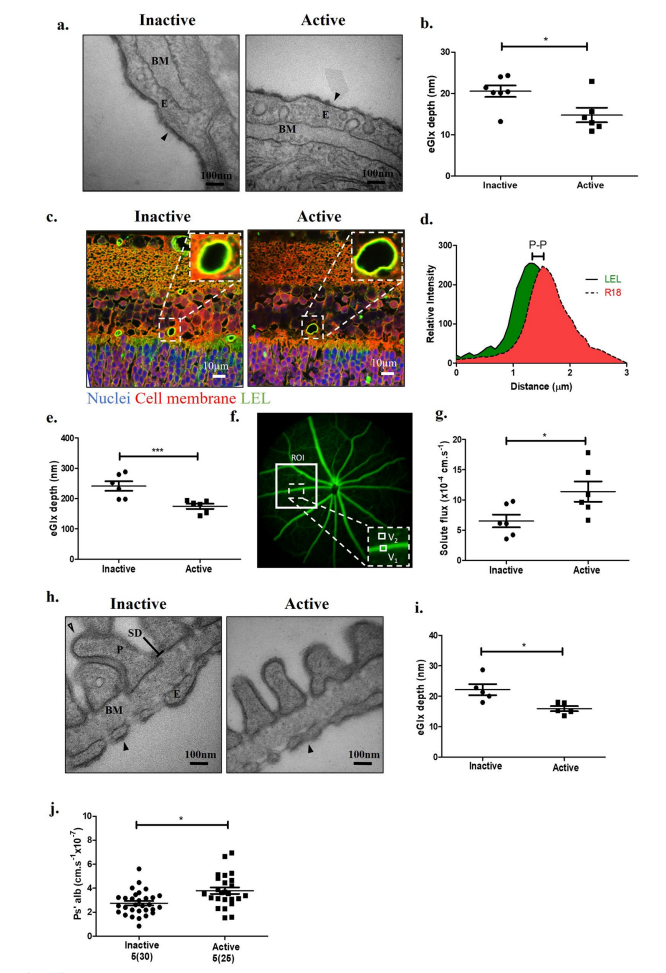
酶去除HS导致eGlx减少,视网膜和肾小球屏障功能丧失。a小鼠视网膜血管的代表性透射电镜图像,分别灌注无活性或活性肝素酶III,然后阿利新蓝,以显示eGlx和戊二醛用于EM制备。基底膜(BM)和视网膜内皮细胞(E)显示。箭头指向内皮细胞上的eGlx。b测量糖萼深度。示小鼠平均值(n=6只(不活动),n=7只(活动),未配对t检验,*P<0.05)。c用无活性或活性肝素酶III处理小鼠的凝集素染色视网膜切片的代表性图像。绿色为凝集素(FITC-LEL)染色,红色为R18细胞膜染色,蓝色为DAPI。插图显示血管管腔侧有绿色信号,表明eGlx染色。d使用LEL和细胞膜(R18)染色共聚焦荧光峰对峰(P-P)测量eGlx深度的例子。每只动物至少对三条血管进行共聚焦荧光峰对峰测量。示小鼠平均值(n=6只/组,*P<0.05,采用非配对t检验)。f小鼠视网膜灌注荧光素血管造影图像。在所选ROI内,随时间测量主血管(V1)和血管旁组织(V2)的面积,以计算溶质通量。g用失活酶或活性酶处理后的溶质熔解。(n=6只/组,*P<0.05,未配对t检验)h无活性和活性肝素酶III处理小鼠肾小球滤过屏障TEM图像显示足细胞(P)、足细胞狭缝隔膜(SD)、内皮细胞(E)、基底膜(BM)、足细胞Glx(开放箭头)和eGlx(实箭头)。i定量测量eGlx深度的EM图像(n=5只/组,*P<0.05, unpaired t检验)。j两组肾小球白蛋白通透性(Ps 'alb)测定。图示及括号内显示肾小球分析结果。统计小鼠数量(n=5只/组,*P<0.05,非配对t检验)。
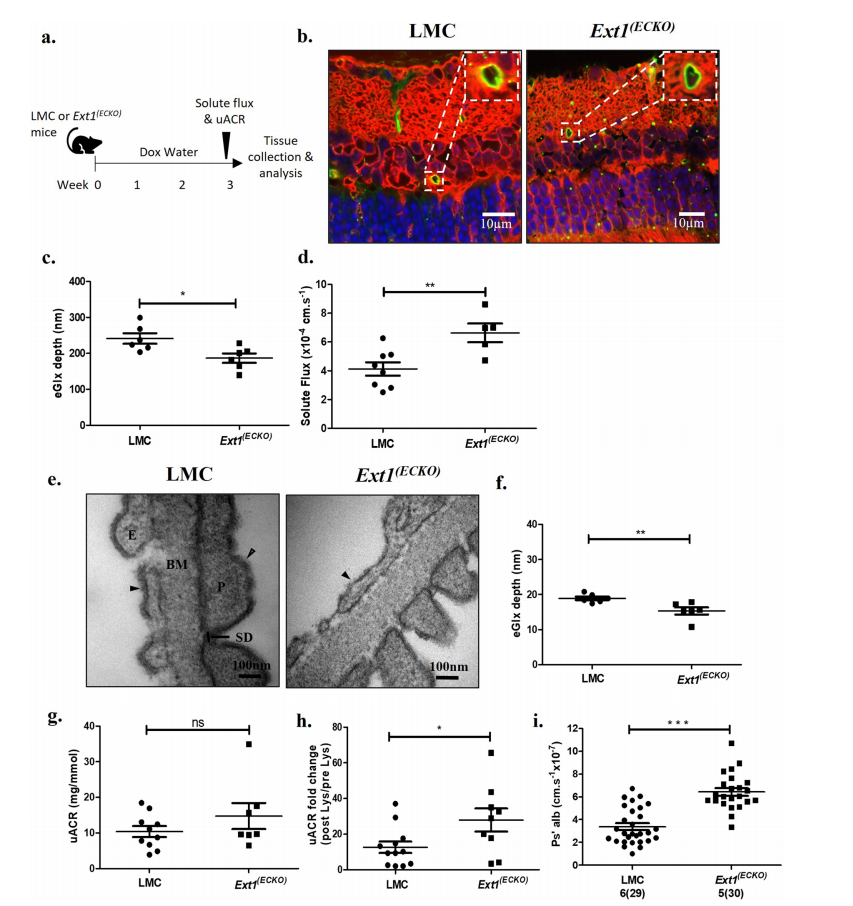
内皮细胞中HS聚合酶Ext1的条件敲除导致eGlx减少和微血管屏障功能受损。实验时间示意图。年龄和性别匹配的同窝对照(LMCs)或Ext1内皮特异性条件敲除小鼠(Ext1(ECKO))给予多西环素水三周以诱导敲除。在三周时,进行荧光素血管造影以测量溶质通量并进行尿液分析实验。多西环素治疗3周后,收集眼睛和肾脏组织进行分析。b LMC和Ext1(ECKO)小鼠凝集素染色视网膜组织的代表性图像。凝集素染色为绿色,R18细胞膜染色为红色,DAPI为蓝色。插图显示血管管腔侧绿色信号,表明eGlx染色。c每只动物至少对三条血管进行共聚焦荧光峰对峰测量。显示小鼠平均值(n=6, *P<0.05, unpaired t检验)。d多西环素治疗3周后LMC (n=8只小鼠)和Ext1(ECKO) (n=5只小鼠)溶质通量测定(**P<0.01,未配对t检验)。e胎仔对照(LMC)和内皮特异性条件敲除小鼠(Ext1(ECKO))的代表性肾小球滤过屏障TEM图像显示足细胞(P)、足细胞狭缝隔膜(SD)、内皮细胞(e)、基底膜(BM)、足细胞Glx(开箭头)和eGlx(实箭头)。f定量测量eGlx深度的TEM图像(n=6只小鼠,**P<0.01, unpaired t检验)。g LMC (n=10)和Ext1(ECKO) (n=7)小鼠的终点尿白蛋白肌酐比(uACR) (P=0.24,无配对t检验)。h LMC (n=12)和Ext1(ECKO) (n=9)小鼠处理l -赖氨酸(Lys)前后uACR的翻倍变化(*P<0.05,未配对t检验)。i LMC (n=6)和Ext1(ECKO) (n=5)小鼠肾小球白蛋白通透性(Ps 'alb)测定。图示和括号内显示了分析的肾小球数目。统计小鼠数量(***P<0.001,非配对t检验)。


