神经母细胞瘤常见DDR通路相关基因变异,靶向联合疗法有望使患者获益
时间:2024-07-30 16:00:46 热度:37.1℃ 作者:网络
神经母细胞瘤(NB)是一种儿童交感神经系统肿瘤。近40%的高风险NB患者的生存率仍然很低。针对高风险NB的靶向治疗选择有限,单一药物策略经常因逃逸机制而失败,而逃逸机制是由肿瘤异质性或适应性(表观遗传)反应或突变引起的。新型NB治疗方法越来越依赖于I/II期临床试验的生物标志物选择队列。需要并行的密集研究计划来识别新的治疗易感性或药物靶向策略,并进一步指导临床试验和优先考虑有效、毒性较小的组合。虽然几种有效的化疗是通过增加癌细胞中的复制压力来起作用的,但最近,许多癌症的早期试验正在评估新的毒性较小的基于小分子的方法,这些方法直接靶向DNA损伤反应(DDR)通路成分,例如ATR、CHK1和PARP抑制剂。NB测序研究已发现,编码关键DDR通路蛋白的许多基因中存在反复出现的变异(拷贝数和突变),表明对特定类型的靶向DDR疗法具有敏感性。在这篇综述中,研究者总结了当前支持DDR和复制应激成瘾在NB中的作用的数据,包括影响DDR信号通路的基因变异。最后,研究者回顾了靶向DDR缺陷和/或复制成瘾NB的药物的机制、临床前证据和正在进行的试验。
-
在神经母细胞瘤中已发现DDR通路基因的变异;
-
DDR通路抑制剂(PARP、ATR、WEE1、CHK1)的儿科试验正在进行中;
-
DDR基因变异和DNA特征正在被评估为儿科生物标志物;
-
DDR抑制剂联合疗法有望进一步临床开发。
在NB肿瘤发生和肿瘤维持中的DDR通路相关基因变异
儿童神经嵴源性肿瘤NB(NB)患者临床表现各异,部分原因可能是异质性基因变异。临床因素(例如年龄、分期)和生物标志物(例如染色体畸变和MYCN致癌基因状态)的组合可将患者分为低风险、中风险和高风险组。大多数高风险患者患有转移性疾病和/或含有MYCN致癌基因扩增的肿瘤。约40%的NB患者患有高风险疾病,尽管进行了积极的化疗和免疫疗法,但其5年无事件生存率仍然只有50%。在过去十年中,通过下一代测序方法在定义高风险NB的生物学异质性方面取得了重大进展。这些研究已经确定了多种变异(SNV,拷贝数缺失和DNA特征),涉及编码DDR通路不同成分,细胞周期检查点和复制压力的基因。在大多数细胞中,DDR和细胞周期检查点参与复杂的信号通路,防止突变和基因组不稳定性的发展。调节这些通路的基因缺陷在癌细胞中很常见。虽然DDR通路基因缺陷在成人癌症中得到了广泛的研究,但有新数据表明这些变异也会影响NB肿瘤的发展和维持,因此可能成为针对治疗耐药性NB的特定患者的可操作治疗靶点。
体细胞变异:
在对多种癌症类型患者的胚系和肿瘤的研究中,已经发现了编码DDR相关蛋白质的突变,而基因组不稳定性通常是由于这些DDR缺陷造成的,被认为是癌症的标志之一。编码参与修复单链断裂(SSB)和双链断裂(DSB)的蛋白质的基因占被认为是真正的“DDR 基因”的大多数,但这个列表仍在不断变化。尽管大多数识别这些变异的基因研究都是使用成年患者的肿瘤DNA进行的,最常见的是乳腺癌、卵巢癌、前列腺癌和结肠癌,但NGS研究发现许多儿童癌症的胚系和/或肿瘤存在变异,包括中枢神经系统肿瘤、肉瘤和NB。对于NB,体细胞研究表明,来自肿瘤DNA测序的DDR变异数据大部分来自高风险或复发性NB患者(图1中所示的最常见受影响的基因/通路)。虽然NB中单个DDR基因突变的发生率很低,但在一项大型研究中,约30%的NB患者检测到DDR基因的体细胞和/或胚系缺陷。除了SNV,其他变异还包括11q的等位基因缺失(约占患者的25-40%),该区域包含多个编码DDR相关蛋白的基因,包括ATM、CHK1、MRE11、γH2AX。此外,约20%的NB肿瘤和40-50%的高风险NB含有MYCN致癌基因的扩增,高水平的 MYCN 表达会促进增殖并导致复制压力。肿瘤的NGS研究也在BRCA1和BRCA2(1-2%)、ATM(<3%)中发现了罕见的体细胞有害SNVs,在BARD1、PALB2、CHK1、CHK2和RAD51中较少见。在大多数高风险NB肿瘤的有限研究中,高达10%的患者也检测到了ATRX或ARID1A的缺失和突变,并且这些基因的失活会影响DDR。此外,TP53突变或缺失在诊断时很少见,但在复发时检测到的频率增加,并且p53在多种细胞过程中发挥关键作用,包括对DNA损伤在内的压力的反应和基因组稳定性的维持。
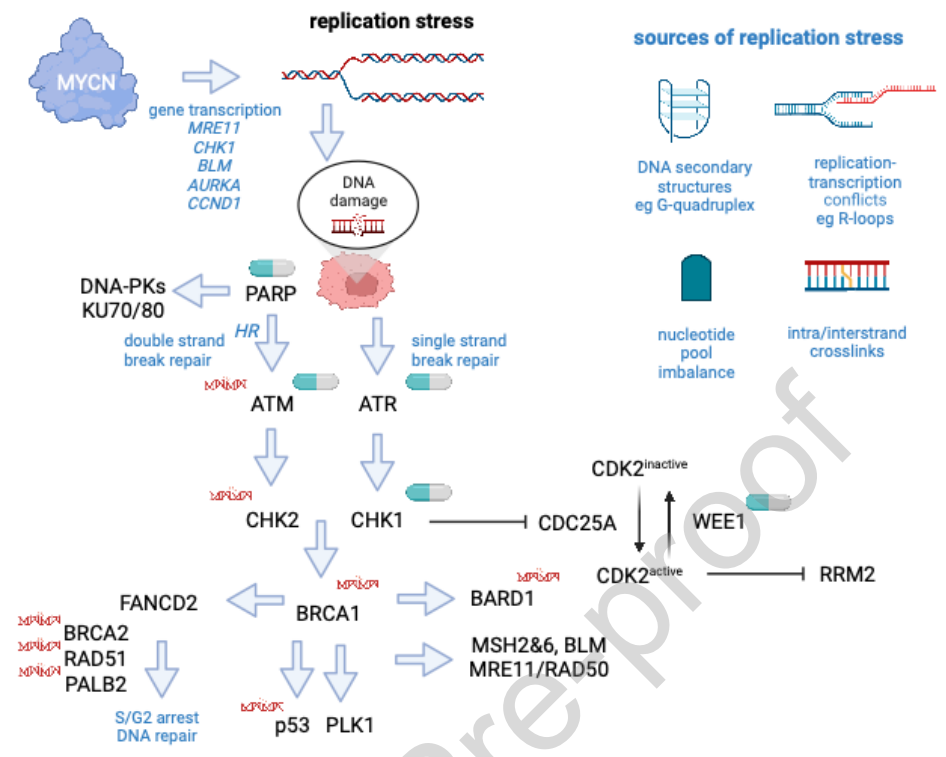

图1
胚系变异:
除了体细胞变异外,在NB患者的胚系中还发现了致病性DDR基因变异。在大多数情况下,杂合突变并不伴有肿瘤中第二个等位基因的杂合性缺失(LOH)。然而,最近有证据表明,某些DDR基因(包括BARD1)的杂合胚系突变可能会促进肿瘤发展并可能赋予NB的遗传易感性。机制研究支持了这一点,这些研究表明杂合BARD1缺失对NB细胞系体外DNA修复的影响。目前,在NB患者中检测到的其他DDR基因胚系变异(例如BRCA1/2、CHK1/2)的具体作用及其在NB易感性中的潜在作用尚不清楚,尽管目前仍有研究在体外和体内斑马鱼和小鼠模型中检验它们在促进NB肿瘤发生中的作用。
上面描述的一些等位基因和突变变异越来越被认为是靶向DDR和复制应激成瘾的药物的生物标志物。除了单基因水平上的这些DDR变异外,还有新出现的数据显示,特定的肿瘤DNA突变特征也可能预测DDR缺陷基因组,因此可能表明对靶向DDR药物的易感性。这些特征包括“SBS3/BRCAness”特征,在一些研究中,该特征预测了对PARP抑制剂的敏感性。值得注意的是,在最近的一项研究中,SBS3/BRCAness特征与儿童癌症患者的胚系和/或体细胞DDR突变有关,其中包括许多患有NB的患者。重要的是,并非所有“BRCAness”特征报告都是使用相同的基因组方法(外显子组、基因组)或生物信息学算法检测的,并且根据当前数据,尚不清楚这些DNA特征是否可以用作PARP抑制剂和其他靶向DDR治疗的生物标志物。需要进行前瞻性试验以确定它们作为预测生物标志物的作用。图1总结了参与DDR信号通路的蛋白质和NB中报道的变异。
基因变异是NB单药治疗的确凿证据和靶点
基因组不稳定性是癌症的主要特征之一,因为它产生基因可塑性并驱动癌症的发生和发展。按照经典范式,控制DDR通路基因的功能缺失突变是这一过程中的关键分子基因事件,因此可能是新治疗方法的高优先级靶点。重要的是,许多DDR突变是功能缺失,不能直接靶向。然而,这些DDR变异下游的通路可能是可靶向的。许多这些DDR突变的结果是,由于DNA损伤位点的复制叉停止,细胞经历复制应激(RS)。或者,原癌基因的不适当过度表达也会诱导复制应激,并被认为是真正的癌症启动过程。在过去的二十年里,对人类原发性NB的详细基因组分析揭示了不同重复出现的大面积和局部DNA拷贝数变异模式,其中最常见的是1p和11q缺失以及2p和17q增加。然而,测序工作表明,与大多数成人发病的癌症相比,与其他胚胎肿瘤类似,突变情况相对沉默。如上所述,MYCN扩增状态是重要的独立预后标志物,因此是患者风险分层的关键决定因素。该致癌基因定位于2p24染色体,是通过NB基因变异分析发现的首批基因之一。具有MYCN扩增的高风险NB肿瘤通常还伴有其他节段性染色体变异(SCA),包括1q、2p和17q增加,而MYCN非扩增肿瘤更常见于包括3p、4p、11q缺失和1q和17q增加在内的SCAs。一般而言,SCAs的存在与不良预后特征(例如高分期、MYCN扩增)相关,并且在某些具有其他有利特征的亚组中,SCAs可能预示较差的生存率。这些常见SCA中涉及的一些基因位点可能包括重要的肿瘤抑制基因和致癌基因,包括11q上编码的基因。有趣的是,NB细胞系中11q的缺失已被证明与PARP抑制剂敏感性有关。最近,研究人员对NB中检测到的反复性拷贝数变异进行了全面概述。
除了在约20%的肿瘤中检测到MYCN扩增外,另一个较小的亚群表达高水平的c-MYC。失调的致癌信号,如MYC(N)的激活,导致正常复制动力学的失调和复制率的增加。有研究表明,MYCN过表达的NB细胞表现出较高的PARP1/2水平,因此PARP抑制剂可以造成有丝分裂困境。这可能在一定程度上解释了这一发现:在体外,与MYCN未扩增的NB细胞系相比,那些携带MYCN扩增的NB细胞系对PARP抑制剂更敏感。有趣的是,为了对抗这些强烈的复制应激迹象,Solvie等人最近的一项研究指出,MYCN本身通过在停滞的复制分叉处形成所谓的MYCN多聚体,与修复因子如ATR和BRCA1相关,积极参与DNA复制和转录的协调以及DNA损伤修复。此外,Szydzik等人最近的数据进一步支持ATR在介导NB细胞耐受ALK信号下游复制应激能力中的关键作用。
对复制应激的进一步下游反应涉及复杂的机制网络和信号转导途径,以监测和适当管理这种应激。简而言之,DNA损伤信号传导由磷酸肌醇3-激酶(PI3K)相关激酶的蛋白质磷酸化驱动,这些激酶包括ATM、ATR和DNA依赖性蛋白激酶三聚体复合物,包括 Ku70、Ku80和DNA-PKcs,还需要特定的蛋白质辅助因子募集,其中包括ATM的NBS1和ATR的ATRIP。更具体地说,ATM和DNA-PK主要对DNA双链断裂 (DSB) 作出反应,但迄今为止,尚未在儿童中进行ATM或DNA-PK抑制剂的试验。如上所述,11q缺失似乎定义了对PARP1抑制高度敏感的NB细胞系子集。Parvin等人最近的一项研究表明,这些11q单倍体不足的NB中的ATM缺失在机制上与抑制FANCD2和RAD51表达有关,从而导致DNA损伤水平增加。有趣的是,Koneru等人证明,端粒功能障碍的ALT阳性NB对ATM和ATR抑制表现出不同的敏感性。此外,ALT NB中ATRX功能的丧失与复制压力和 G-四链体的存在有关,后者通过激活ATM/CHK2/p53轴来诱导DNA损伤修复,而Akter等人现在表明,在这种情况下,p53缺陷可以减少复制压力引起的DNA损伤。
与ATM相反,更广泛的基因毒性应激可导致ATR的激活,因此被认为是对复制应激的主要信号反应。ATR-ATRIP的完全激活需要额外的介质,包括募集可通过直接相互作用激活ATR的TOPBP1。ATR通过磷酸化驱动的CHK1激活来造成细胞周期停滞,从而防止复制叉崩溃并抑制起源激发。Buisson等人的研究表明,在S期,ATR的主要作用是协调起源激发。有趣的是,ATR抑制剂会诱导DNA-PK/CHK1介导的后备通路来抑制起源激发,从而产生一个阈值,在此阈值下,ATR抑制剂会在高复制压力下选择性地杀死细胞,而CHK1抑制剂可以在较低的阈值下诱导细胞死亡。有趣的是,之前的功能丧失筛选(siRNA方法)进一步强调了CHK1信号在NB中的重要性,并指出药理学CHK1抑制剂是NB中的选择性敏感性,与其他人类肿瘤细胞系(例如髓母细胞瘤、乳腺癌)相比,NB的磷酸化CHK1水平相对较高。这与最近将MYCN扩增鉴定为CHK1抑制剂敏感性的推测生物标志物一致,与11q丢失无关。活化的ATR磷酸化CHK1,导致CDK2活性受到抑制,这是通过蛋白酶体降解CDC25A并最终激活WEE1激酶实现的。在NB中,先前的研究表明,WEE1表达和活性在NB中显著升高,尤其是在MYCN扩增病例中。药理学抑制WEE1会导致G2/M细胞周期检查点被绕过,从而进一步增加NB细胞的复制应激水平,因此可以将WEE1标记为该轴上另一个强大的治疗靶点。基于这些发现和临床前数据,人们对使用AZD1775(adavosertib)等药物靶向WEE1产生了浓厚的兴趣。如下文联合疗法所述,最有前景的方法是将这些药物与化疗或放疗相结合,以诱导DNA损伤应激,从而靶向WEE1/CHK1轴。
核苷酸还原酶调节亚基M2(RRM2)越来越多地被认为是CHK1下游的癌症治疗靶点。已发现用于其他疾病的几种抑制剂可靶向这些途径,包括三胺苯乙酸 (3-氨基吡啶-2-甲醛缩氨基硫脲) 和羟基脲。尽管两种药物都是核糖核苷酸还原酶(RNR)抑制剂,但与羟基脲相比,三胺苯乙酸已被证明在体外更有效抑制癌细胞生长。然而,I期临床试验结果表明,一些毒性(如呼吸困难和高铁血红蛋白血症)限制了该药物的使用。值得注意的是,与MYCN和ALK一样,RRM2位于2p的临界增益区域内,是NB的不利预后标志物。在细胞和斑马鱼中进行的临床前研究表明,RRM2促进MYCN扩增的NB生长并导致ATR-CHK11信号传导增强,因此可能代表一种新的可用药靶点。
端粒维持机制 (TMM) 是高风险NB的标志,NB肿瘤维持端粒的主要机制有两种——通过上调TERT(最常见的是融合)或通过替代性的端粒(ALT)延长,这通常在具有ATRX突变的肿瘤中检测到。端粒缩短会导致DDR,最近的几项研究探讨了TMM对DDR通路抑制剂(包括靶向ATR、ATM和PARP的抑制剂)潜在敏感性的影响。最近,Reynolds及其同事证明,ALT阳性NB对化疗具有耐药性,部分原因是ATM激活。使用ATM抑制剂AZD0156治疗可使ALT阳性NB细胞和异种移植物对伊立替康和替莫唑胺重新敏感。
DDR和RS的新联合治疗方法
靶向DDR和RS的联合疗法的理由是多方面的。首先,药物诱导复制应激已被证明可以增强化疗和放疗的遗传毒性作用。支持这一观点的临床前(和有限的临床)联合数据包括使用伊立替康和其他化疗与PARP和WEE1抑制剂。其次,对于已成功应用于成人临床的几种药物(如PARP抑制剂),患者通常会出现或产生治疗耐药性,因此单一药物很少是有效的长期策略。有趣的是,临床前数据表明,ATR-CHK1抑制剂可以在多种肿瘤类型中重新对PARP抑制剂敏感,使ATR-CHK1通路成为药物耐药环境中有吸引力的治疗靶点。第三,DDR机制中的合成致死概念使得细胞更加依赖其他冗余的DDR通路来生存。从后者的概念来看,基于NB研究的基本发现,已经鉴定出多种有效的新型药物组合。首先,PARP与CHK1抑制剂的合理组合可以在NB的背景下得到展示,而 King等人则证明,以奥拉帕利为基础的PARP抑制剂会导致复制压力增加,随后ATR激活,从而引发PARP和ATR抑制剂的协同作用。其次,尽管目前无法在MYCN水平上直接有效地靶向MYCN致癌基因诱导的复制压力,但已在共同驱动因素水平上开发出有效的策略。在这方面,最近将ALK确定为ATR(和CHK1)的上游调节剂,为高风险NB的ATR单一疗法以及ATR-ALK联合疗法提供了独特的切入点。此外,MYCN蛋白的稳定化在很大程度上是在S期通过与Aurora 激酶A (AURKA) 的物理相互作用来驱动的。已知AURKA的药理学抑制会引起转录-复制冲突。在这种情况下,ATR抑制剂可以发挥协同作用,因为ATR本来会限制DNA双链断裂的积累。最近的研究还表明,除了PARP1之外,CHK1抑制剂的联合疗法也非常有效。Russell等人强调了联合WEE1-CHK1抑制剂在更大程度上的协同相互作用,而不是两种药物中的任何一种与化疗联合治疗。此外,Nunes等人报道了CHK1和RRM2抑制剂在MYCN驱动的NB中的协同作用,同时在此背景下也强调了ATR-RRM2联合抑制剂的治疗潜力降低,因为DNA-PK驱动CHK1激活的挽救途径。因此,这些重要的临床前研究以及非NB细胞中的许多其他研究为成人单药和联合试验提供了重要依据,并且最近还向18岁以下患者开放了附加试验。
儿科临床试验:
目前,针对儿童癌症患者,靶向DDR药物单独使用和联合使用的情况很多,并且已完成多项试验。最近召开的多方利益相关者ACCELERATE战略论坛将临床医生、研究人员、制药公司、患者权益倡导者和监管机构聚集在一起,报告了一份2022年ACCELERATE论坛摘要,该论坛旨在促进讨论和确定DDR通路抑制剂在儿童药物开发和试验中的优先次序。在儿童中研究的大多数靶向DDR药物包括PARP抑制剂,但也有试验包括以下蛋白质或通路的抑制剂- ATM、ATR、WEE1、CHK1/2或PKMYT1。最初,这些药物在非生物标志物选择队列中用作单一药物,但最近的早期方法包括篮子试验,而不是传统的由肿瘤组织学确定的早期试验资格。进行儿科篮子试验的两个主要团体包括欧洲(ITTC)eSMART联合试验和NCI儿科MATCH,后者目前仅包括单一药物的组,计划扩展到成人患者,进行CombinationMATCH试验。表1中审查的组合、生物标志物和临床试验包括那些对NB患者有合理性和/或适用性的。
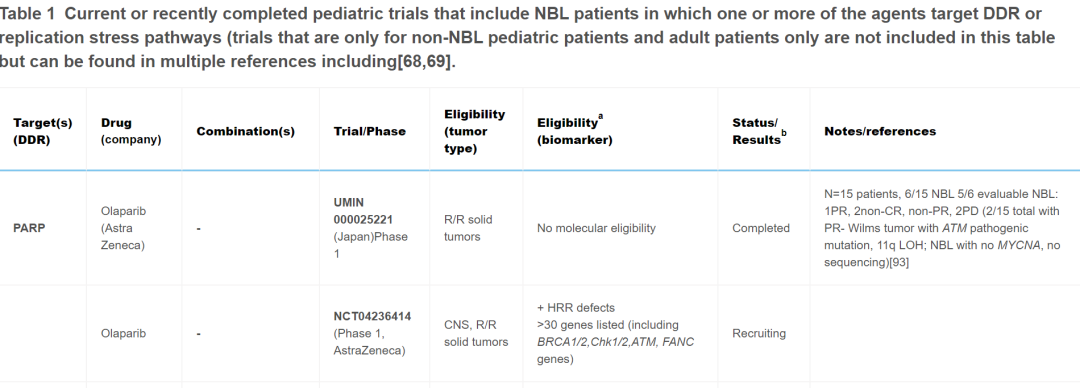
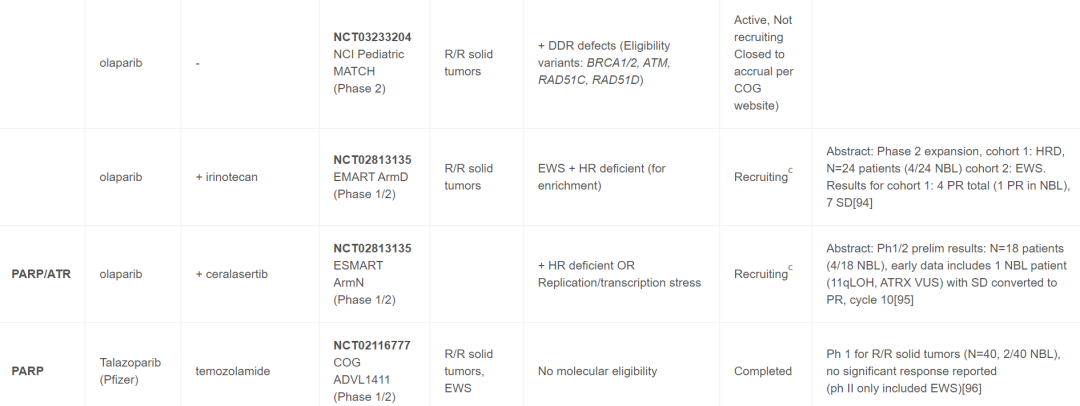
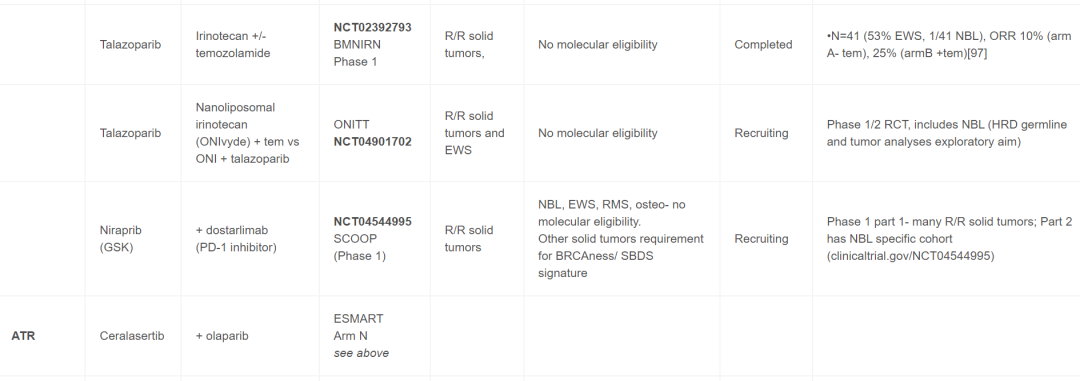
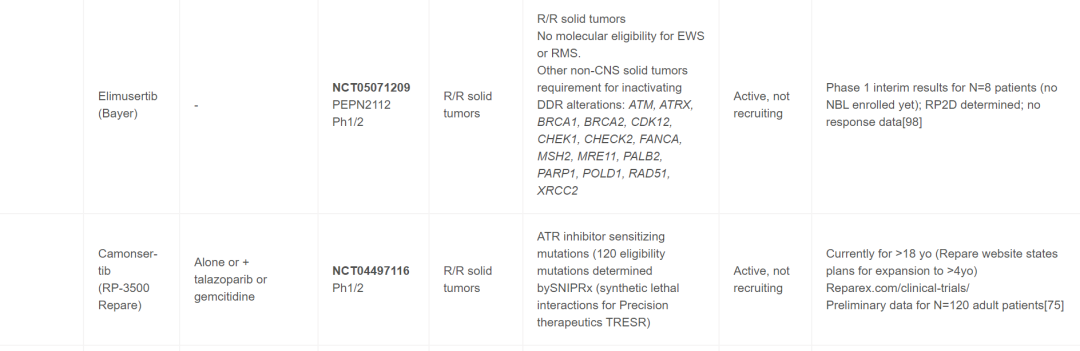
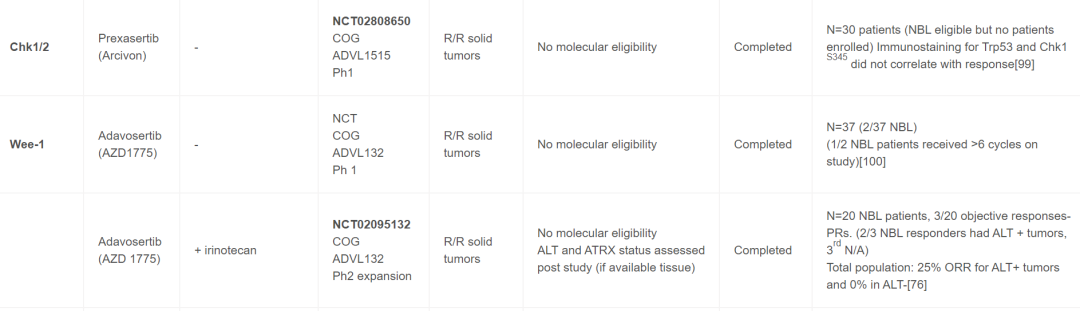
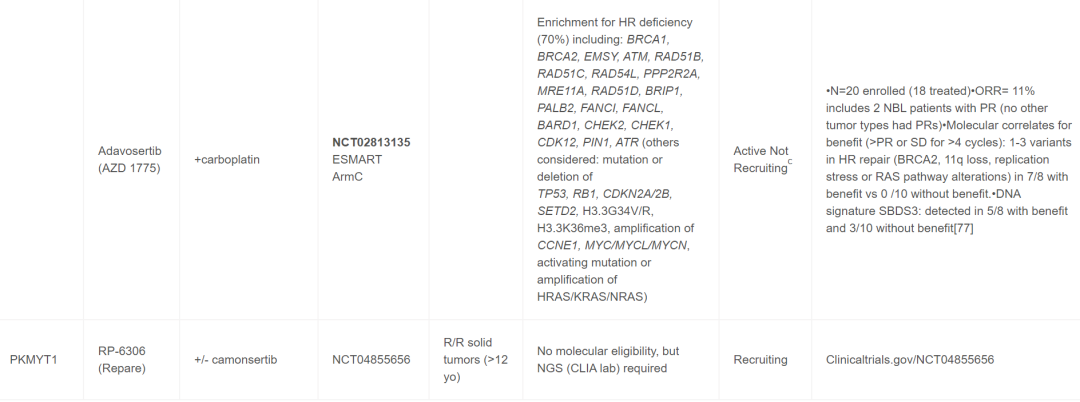
表1
PARP抑制剂:
成人PARP抑制剂试验已在卵巢癌、前列腺癌和最近的胰腺癌患者的生物标志物选定队列中显示出极好的成功。目前正在或最近评估用于儿科患者的PARP抑制剂包括奥拉帕利、他拉唑帕利、尼拉帕利和维利帕利。奥拉帕利、他拉唑帕利和尼拉帕利的试验将神经母细胞瘤作为符合条件的诊断;然而,迄今为止,维利帕利仅在患有中枢神经系统肿瘤的儿童中进行过研究。这类药物最常见的是与放疗或化疗(例如伊立替康或替莫唑胺)联合使用以诱导DNA损伤,尽管基于机制见解,正在研究包括ATR抑制剂和PD-1检查点抑制剂(表1)在内的更具创新性的抑制剂组合。在SSB环境中,PARP1募集蛋白质以促进DNA修复,这一过程被PARP1/2抑制剂类阻断。这种抑制会导致DSB,通常通过同源修复途径进行修复。但是,如果细胞由于DDR基因突变(例如BRCA1/2通路中的基因突变)导致DSB机制出现缺陷,则使用PARP抑制剂治疗会导致合成致死。已发现生物标志物可预测成人发病肿瘤(最常见的是卵巢和前列腺)中的这种“合成致死”反应,现在用于资格或患者分层,包括DDR通路成分中的胚系和/或体细胞突变。最常见的是BRCA1、BRCA2、PALB2、ATM、RAD51C和RAD51D,其他基因通常也包括在不同的试验资格中,包括CHEK1、CHEK2、BRIP1、PTEN、RAD50、CDK12、范可尼贫血基因和PPP2R2A。除了特定基因突变或缺失外,还有正在开发的其他检测方法用于测量“基因组疤痕”,包括端粒不平衡的变异、LOH 和其他可能产生基因组不稳定性评分的变异。其他更具功能性的检测方法(例如RAD5 灶形成)也显示出一些早期前景。尽管大多数评估这些生物标志物效用的研究仅针对成人发病的肿瘤进行,但一些儿科试验正在研究在成人肿瘤中发现的这些基因子集,以确定它们是否具有作为儿童发病肿瘤的生物标志物的效用。
继早期对未选定队列进行的I期试验之后,在儿童(包括NB患者)中单独或联合进行的PARP抑制剂试验开始纳入生物标志物资格审查(表1)。e-SMART Arm D1/2期联合奥拉帕利和伊立替康的试验结果很有希望,包括4例NB患者的PR(AACR 2023,CT088)。值得注意的是,eSMART试验使用生物标志物富集策略,所有患者都进行了某种形式的下一代测序,包括但不限于全基因组测序或基因panel,目的是将所选生物标志物富集到50%以上(Arm D为HR缺陷基因突变或缺失)。除了试验之外(表1),包含生物标志物信息的病例报告也提供了支持使用PARP抑制剂的额外数据。Cupit-Link等人报道了一名患有难治性NB的患者,该患者存在致病性BARD1胚系突变和BARD1 LOH(在肿瘤中),对他拉唑帕利、化疗和局部放射治疗的联合治疗有持续反应。此外,研究者报道了一位多次复发的NB患者,该患者存在胚系PALB2变异和具有11q LOH和SBDS特征3的肿瘤。患者对MIBG治疗和PARP抑制剂治疗有持续部分缓解(PR)。该组合是基于MIBG和PARP抑制剂的临床前数据。这些临床试验和病例报告以及临床前理论和数据支持目前优先考虑PARP抑制剂与化疗、ATR抑制剂(见下文)和潜在的电离辐射或MIBG疗法的联合治疗。
ATR抑制剂:
目前,纳入18岁以下患者的ATR抑制剂试验非常少(表1)。可能导致ATR抑制剂敏感性的预测变异包括DDR基因的致癌基因过度表达和突变(包括ATM)。还有大量临床前数据支持ATR和PARP抑制剂的联合方案。将ATR抑制剂西拉塞替(ceralasertib)与奥拉帕利联合的eSMART 试验(Arm N)的早期结果表明,该组合耐受性良好,尽管招募仍在进行中,但至少有一名NB患者出现PR(表1),有趣的是,该患者的肿瘤存在11q缺失和ATRX VUS(意义不明变异)。人们对将ATR抑制剂用于NB患者(包括与PARP抑制剂联合使用)有着浓厚的兴趣,NB临床前数据可能会为其他组合提供信息,包括表明与AURKA抑制剂有协同作用的研究,以及利用基因组数据识别预测性生物标志物的成人研究。支持ATR抑制剂更广泛的分子资格,包括首批120名接受ATR抑制剂卡蒙塞替尼(camonsertib)治疗的成年患者的早期结果。通过CRISPR化学成因的筛选确定合成致死率,选择合格和分层的基因,迄今为止,在已发表的患者队列中最常见的检测到的致病变异是ATM、BRCA1、BRCA2和CDK12。早期数据表明这种方法可能是有效的,更大的队列数据应该可以为未来的ATR抑制剂研究设计和患者选择标准提供参考。
CHK1/2:
CHK1激酶是ATR的下游靶点,由DNA复制缺陷激活。尽管迄今为止只有一项针对CHK1/2抑制剂普瑞色替(prexasertib)的试验纳入了包括NB在内的实体瘤患者,但还有其他一些针对不同肿瘤类型的儿科试验,包括肉瘤和髓母细胞瘤。相比之下,NCI临床试验网站列出了许多正在进行的成人试验,其中许多试验使用与组织学无关的分子资格,其中包括以下一些或全部复制应激(MYC扩增、CCNE1扩增、RB缺失、FBXW7突变)或HR缺陷(BRCA1、BRCA2、PALB2、RAD51C、RAD51D、ATR、ATM、CHK2或范可尼贫血通路基因的胚系和/或体细胞突变)生物标志物。
WEE1:
最近有几项针对儿童的WEE1抑制剂联合研究显示,该药物在少数NB患者中具有良好的活性。由于WEE1在磷酸化CDK2以促进DNA修复和复制应激耐受性方面发挥着作用,因此在临床前研究中对WEE1与DNA损伤化疗的联合疗法进行了研究,然后在临床试验中与化疗或电离辐射一起进行了测试。成人试验中提出的生物标志物包括TP53、BRCA1/2变异和CCNE1扩增。继WEE1阿达色替(adavosertib)的儿科1期试验之后,最近的两项联合试验显示出良好的活性,并深入了解了介导这些影响的机制。首先,Cole及其同事在COG 2期扩展队列中证明,接受伊立替康和阿达色替治疗的20名NB患者中有3名表现出部分反应。为了确定其机制,对现有患者肿瘤的基因组研究进行了ALT状态评估,有趣的是,ALT阳性肿瘤的总缓解率为25%,而ALT阴性肿瘤的总缓解率为0%。对于三名PR的NB患者,只有两名有可用的样本,但其中2/2为ALT阳性。在ESMART ArmC试验中,患者接受了阿达色替联合卡铂治疗。HR缺陷基因变异的富集策略使37名患者队列中的70%具有一个或多个HR通路基因致病突变(见表1)。ORR为11%,其中包括2名PR的NB患者。对于整个队列,评估了分子相关数据以确定HR变异是否预测临床益处(定义为≥PR或≥4个周期的稳定疾病)。具有1-3个HR修复变异(BRCA2、11q缺失、复制压力或 RAS通路变异)的7/8患者有临床益处,而0/10没有益处。有趣的是,DNA特征SBDS3对本次试验益处的预测性较低。这些发现支持继续获取全面的分子数据以识别与药物活性相关的生物标志物。
其他DDR通路抑制剂:
在临床前研究和成人癌症中,还有几种其他DDR基因/通路正在评估。这些包括PKMYT1、ATM、RRM2、DNA-PK和DNA聚合酶theta抑制剂。迄今为止,这些药物中只有一种PKMYT1抑制剂RP-6306(单独或与ATR抑制剂RP-3500联合使用)参与了一项针对儿科患者的试验(仅限于12岁及以上;NCT04855656)。PKMYT1属于WEE激酶家族,PKMYT1在某些肿瘤(包括神经母细胞瘤)中表达较高。PKMYT1已被证实能够调节致癌应激和MYCN稳定性,敲低该基因可抑制神经母细胞瘤细胞生长。在其他DDR抑制剂中,有特定的神经母细胞瘤临床前数据研究了RRM2和ATM抑制剂的作用。ATM抑制剂单独使用或与伊立替康和替莫唑胺联合使用对ATRX突变和ALT阳性神经母细胞瘤细胞系有效。ATM抑制剂没有儿科试验,但是,AZD0156和AZD1390目前正在成人实体瘤(包括中枢神经系统)中单独使用以及与化疗和放疗联合使用进行研究。临床前数据也支持DNA-PKcs在神经母细胞瘤中的作用,包括作为放射增敏剂。针对DNA-PKcs的药物(AZD7648、M3814)单独使用和联合使用(例如放射疗法、检查点抑制剂)正在I期和II期临床试验中对患有实体瘤和中枢神经系统肿瘤的成年人进行评估。DNA聚合酶pol-theta抑制剂GSK 4524101单独使用和与尼拉帕利联合使用正在对患有晚期实体瘤的成年人进行评估(NCT06077877),根据临床前数据,预计将对包括神经母细胞瘤在内的儿科患者产生兴趣,可能对H 缺陷型肿瘤患者有选择性。
未来展望:
总之,NB有许多变异(拷贝数和突变),导致基因组不稳定、DNA 修复缺陷和复制压力,这些似乎是复发和难治性疾病NB患者需要关注的重要弱点。值得注意的是,Rodriguez-Fos最近的数据强调,高风险NB的局灶扩增与复制应激和滑移有关,而高风险非MYCN扩增NB的拷贝数变异与基于同源重组的修复缺陷有关。目前尚不清楚DDR通路基因的胚系变异是否会导致NB的遗传易感性,尤其是在没有杂合性丢失的情况下。然而,正在进行的使用细胞和动物模型的研究可能会提供进一步的机制见解,以确定患有这些变异的患者是否需要监测或其他干预措施。重要的是,靶向因体细胞变异导致的DDR缺陷的药物是一个热门的研究领域。NDDS 2 (2019)和最近举行的NDDS 3 (2023)(手稿准备中)优先考虑了针对NB药物开发和试验的DDR途径靶向单药和联合方法。此外,最近专门针对此类药物的ACCELERATE论坛优先考虑了几种药物组合,作为即将进行的试验的重点。重要的是,如上所述,这些蛋白质的基本机制研究及其在DDR和复制压力中的功能作用已为实验室中的潜在组合提供了信息,这些组合开始遵循早期的单一药物早期试验。这些治疗方法可能对肿瘤显示“靶标”的患者最有效,而了解确定资格的最佳生物标志物仍然是一个挑战。当前的范例包括经典的DDR基因,最常见的是致病突变,但在某些情况下还包括带有DDR基因的常见SCA的拷贝数丢失或增加。此外,鉴于测序数据和机制研究的快速增长,许多试验允许肿瘤委员会就新变异进行知情讨论,并且正在进行研究以确定DNA特征(例如SBDS3“BRCAness”模式)是否可以预测敏感性。此外,成人队列中的研究开始使用由功能筛选和/或各种基因组不稳定性评分提供的更长的“DDR 基因”列表。对于具有相关DDR基因变异的NB患者,任何疗效信号都可能会增强,并且针对此类药物的NB患者进行的许多试验越来越多地成为与组织学无关的篮子试验。与这些试验相关的生物相关性研究可能会进一步增强我们对反应预测因素的理解。
最近的成功使免疫检查点抑制剂(PD1/PDL1)疗法成为转化癌症研究的前沿。然而,对于NB来说,这一进展充其量只是适度的。一般来说,肿瘤突变负担较低的NB肿瘤在免疫学上被视为“冷”肿瘤。将这些“冷”无反应肿瘤转化为“热”肿瘤是一项尚未满足的临床需求。增强肿瘤内在基因组不稳定性,从而激活先天免疫反应途径(特别是cGAS-STING轴),是一种靶向肿瘤的方法,在临床前和临床试验中取得了有希望的结果。很明显,肿瘤DNA修复环境在驱动这种抗肿瘤免疫反应中起着重要作用,异常修复是免疫原性DN 积累的主要驱动因素。在这方面,多项临床研究揭示了基因组不稳定性与免疫检查点抑制剂反应之间的联系。此外,临床前研究表明,DDR抑制剂(包括CHK1抑制剂)不仅对癌细胞具有直接的细胞毒性作用,而且更高的基因组不稳定性以及肿瘤突变负荷也与淋巴细胞浸润增加有关,有助于消除残留的癌细胞。针对CHK1抑制剂的敏化剂和脱敏剂的筛选也揭示了与先天免疫的推定功能联系。因此,可以假设将药物干扰复制应激抵抗与免疫调节相结合可以显著提高治疗效果,从而改善患者预后。包括对肿瘤微环境和免疫系统的影响在内的机制研究将有助于为可能涉及免疫疗法的其他组合方法提供信息,包括抗体药物偶联物(ADC)。这种策略最近在HER2阳性恶性肿瘤的背景下被证明是成功的,其中靶向HER2 ADC与PARP和ATR抑制剂相结合,以引起协同相互作用,从而引起强烈的抗肿瘤反应。类似地,在多发性骨髓瘤的背景下,BCMA ADC与靶向ATR或WEE1的抑制剂具有协同作用。
总之,DDR通路是NB的重要靶点,选择新兴联合疗法(包括多种DDR药物、与化疗或放疗的联合治疗以及未来的免疫疗法)的最佳患者群体将至关重要。临床前模型和机制研究以及这些试验中患者的丰富基因组研究可能会为成人和儿童癌症(包括高风险NB)的未来优先组合提供信息。
参考文献:
Kaat Durinck and Meredith S Irwin, DNA Repair and Replicative Stress Addiction in Neuroblastoma, EJC Paediatric Oncology, (2024) doi:https://doi.org/10.1016/j.ejcped.2024.100177



