【BCJ】RRMM在双抗治疗缓解后停药,仍可维持缓解
时间:2024-09-01 06:02:11 热度:37.1℃ 作者:网络
RRMM双抗停药后缓解
BCMA和GPRC5D双特异性抗体(双抗)在复发/难治性多发性骨髓瘤(RRMM)患者中显示出深度和持久缓解,单药缓解率为57%-71%。目前有两种BCMA和一种GPRC5D双抗获得FDA批准,包括特立妥单抗(teclistamab)、elranatamab和talquetamab。双抗需要持续治疗,直到疾病进展或不耐受,但也在探索无治疗间期的有限期给药,从疗效和安全性的角度来看,这可能是一种首选方法。首先,持续暴露于T细胞衔接双抗细胞可导致T细胞衰竭,导致后续T细胞重定向治疗的疗效降低,而无治疗间期可导致T细胞的转录重编程和功能恢复。其次,持续暴露可能会导致某些复发机制(例如TNFRSF17突变或双等位基因丢失)。第三,感染相关的致病率和死亡率已成为BCMA双抗的关键毒性之一,而免疫抑制的深度和持续时间可能与双抗暴露的持续时间密切相关。最后,有限期治疗可降低患者的治疗负担和时间毒性,并减少财务影响,改善全球可及性。
目前尚无前瞻性研究评估BCMA或GPRC5D双抗在RRMM有限期治疗的缓解持久性,但确实有个别患者因为非进展原因停药。美国6家中心的学者回顾性分析了在双抗早期试验中因非进展/死亡原因停药的患者停药后的结局。结果近日发表于《Blood Cancer Journal》。

研究结果
在201例接受BCMA或GPRC5D双抗单药治疗的患者中,有23例患者符合纳入标准(因为非进展/死亡原因导致双抗停药且停药后缓解>3个月)并纳入研究。患者中位年龄为68岁,52%为女性,7/23(30.4%)属于种族/少数民族(包括黑人、西班牙裔或亚裔)。10/23例患者存在FISH高危细胞遗传学异常(HRCA),主要是gain(1q)(n=8)、del(17p)(n=3)、t(4;14)(n=1)和del(1p)(n=1);2例患者携带≥2个HRCA。患者在接受双抗前接受过中位4线治疗,包括17例既往自体移植 (其中6例既往2次自体移植)和2例既往异基因移植。20例的双抗靶点为BCMA, 3例为GPRC5D。停药前缓解状态包括16例CR/sCR、6例VGPR患者和1例PR。至最佳缓解的中位时间为3.1个月。停药前双抗治疗的中位持续时间为7.6个月。最常见的停药原因为感染(n=12),其次为第二恶性肿瘤(n=2)、中性粒细胞减少(n=2)、生长不良(n=2)等。
双抗停药后中位随访15.5个月,19/23例患者(82.6%)存活且无进展,6、12和18个月无进展生存率(PFS)分别为90.5%、84.0%和70.0%。
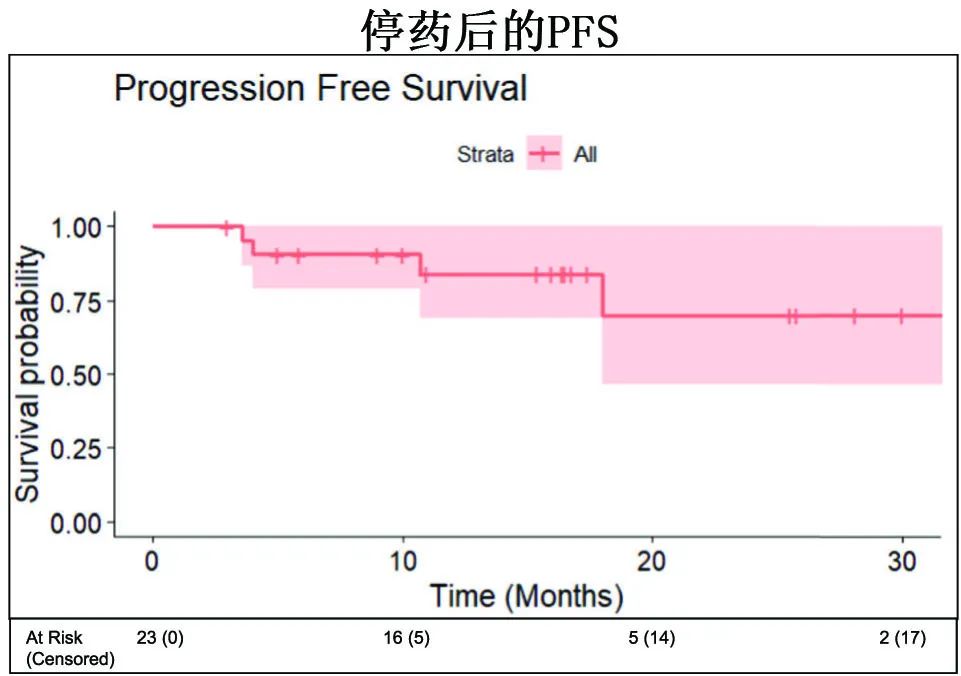
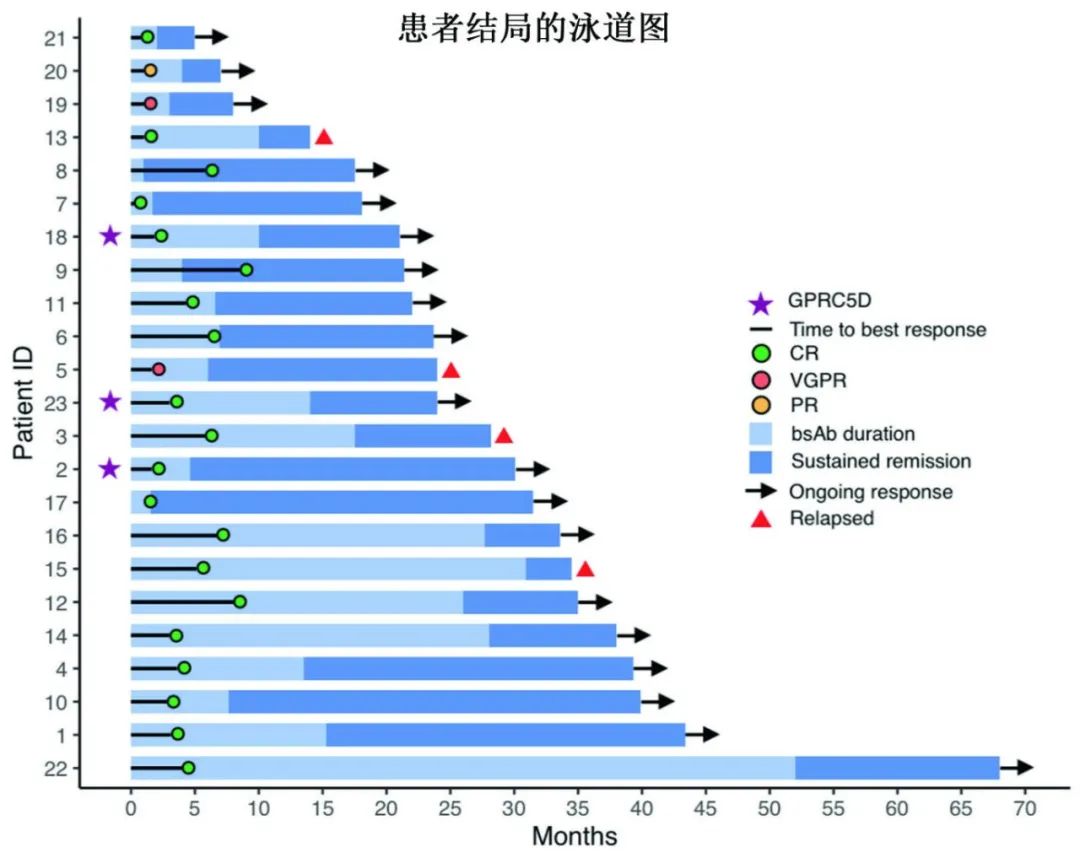
共4例复发,复发前对BCMA双抗的最佳反应均为sCR,双抗停药至复发中位时间为7.3个月。末次随访时,三例接受GPRC5D双抗治疗的患者分别在停药后10、11和25.5个月仍处于缓解期。值得注意的是,复发的4例患者中2例在基线时具有高危细胞遗传学。
复发后接受的治疗和相关反应如下(每例1例):talquetamab(达到sCR);环磷酰胺、硼替佐米、地塞米松(无反应);elotuzumab、泊马度胺、地塞米松(无反应);无治疗。
自双抗停药以来尚无死亡报告。
总结
该研究证实,对于因非进展或死亡原因停用双抗的重度经治RRMM患者,一年后超过80%可维持缓解。但由于绝大多数患者(20/23)在停药时处于CR/sCR,因此该数据可能不适用于<VGPR的患者。
迫切需要开展双抗停药的前瞻性研究,探索有限期、反应调适和/或延长暂停时间的双抗治疗,因为双抗治疗可能早期就清除肿瘤细胞。未来的研究还应评估临床可操作的肿瘤和免疫微环境生物标志物,包括纵向MRD评估,以识别停药后复发风险较高的患者。虽然在该研究的患者疾病复发时未再次暴露于相同的双抗治疗,未来的试验应该前瞻性地评估再治疗,但可结合监测抗原丢失等逃逸机制。
此外,RRMM中FcRH5xCD3双抗和GPRC5D双抗cevostamab正在探索治疗1年的有限期治疗,特立妥单抗一项2期研究也在探索治疗6-9个月且获得≥VGPR的患者停药;有限期治疗亦可参考淋巴瘤的CD20xCD3双抗格菲妥单抗(治疗12周期)。
参考文献
Chakraborty, R., Cheruvalath, H., Patwari, A. et al. Sustained remission following finite duration bispecific antibody therapy in patients with relapsed/refractory myeloma. Blood Cancer J. 14, 137 (2024). https://doi.org/10.1038/s41408-024-01114-7


