Nature:揭示卵巢老化的基因密码:稀有变异与癌症风险的双重关联
时间:2024-09-14 19:01:32 热度:37.1℃ 作者:网络
引言
卵巢老化(ovarian ageing)是女性生殖健康的一个关键问题,它不仅影响着生育能力,还与许多疾病的风险密切相关,如癌症和代谢疾病。卵巢老化的主要特征是卵子储备的逐渐耗尽,最终导致绝经(menopause)。近年来,随着人们生育年龄的推迟,卵巢老化带来的健康挑战变得愈发重要。通过对基因组的深入研究,研究人员已经识别出一些常见的基因变异与卵巢老化的关联。然而,稀有蛋白编码基因变异在卵巢老化中的作用却鲜有研究。
9月11日Nature的研究报道“Genetic links between ovarian ageing, cancer risk and de novo mutation rates”,利用UK Biobank中超过10万名女性的外显子组测序数据,深入探讨了稀有蛋白编码基因变异对卵巢老化的影响。研究发现,与常见变异相比,某些稀有基因变异对绝经年龄的影响更为显著。特别是,研究确认了ZNF518A、SAMHD1等基因在卵巢老化及癌症易感性中的重要作用。此外,研究还揭示了早期卵巢老化与母体来源新发突变率(de novo mutation rate)的潜在关联。
这些发现不仅加深了我们对卵巢老化遗传机制的理解,还为未来的生殖健康干预提供了新的可能性。特别是在生殖寿命延长和癌症风险管理方面,这些基因可能成为潜在的治疗靶点。通过更好地理解这些基因的功能,科学家们或能开发出新的方法来延缓卵巢老化进程,从而改善女性的生殖健康和整体健康状况。

卵巢老化(ovarian ageing)是女性生殖健康中非常重要的领域,直接影响女性的生育能力和整体健康。通常,女性在出生时拥有有限数量的卵母细胞储备,这些细胞会在女性的一生中不断减少,最终导致绝经(menopause)。绝经年龄的个体差异与多种因素有关,包括遗传因素和环境因素,而这些差异对疾病风险和寿命都有显著影响。过早绝经(premature ovarian failure, POF)不仅与生育能力下降有关,还与多种疾病的高风险相关,如癌症、骨质疏松和心血管疾病。因此,深入了解影响卵巢老化的基因变异对于改善女性生殖健康、延长生育期具有重要意义。
该研究基于UK Biobank数据,分析了106,973名女性的外显子组测序数据(exome sequencing data),重点研究了罕见蛋白编码基因变异对卵巢老化的影响。研究使用了高置信度蛋白截断变异(high-confidence protein-truncating variants, HC-PTVs)、错义变异(missense variants)及其结合分数CADD(combined annotation-dependent depletion, CADD)≥25的变异等类别。通过基因负担分析(gene burden analysis),研究发现了多个与自然绝经年龄(age at natural menopause, ANM)相关的基因变异,并对其在卵巢老化中的作用进行了详细分析。
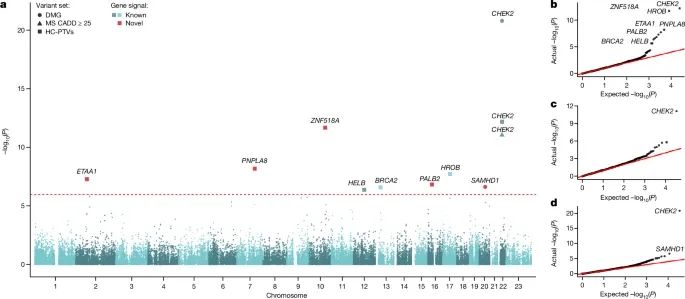
与自然绝经年龄(ANM)相关的全外显子组水平的关联结果(Credit: Nature)
Manhattan图:图a显示了106,973名女性中进行基因负担测试(gene burden test)的结果。图中标示了通过全外显子组显著性水平(P < 1.08×10⁻⁶)的基因,结果表明这些基因与ANM有显著关联。不同形状代表了不同类别的变异,颜色则表明这些基因是已知的还是新发现的。
QQ图图:图b-d展示了不同类别基因的P值分布相对于预期的P值的偏差,具体包括:高置信度蛋白截短变异(HC-PTVs)、CADD评分≥25的错义变异、以及所有损伤变异(damaging variants)。这些图显示了在进行的统计测试中,结果良好校准,表明测试结果可信。
关键基因的鉴定
研究识别了多个与卵巢老化相关的罕见蛋白编码基因变异,包括ZNF518A、SAMHD1、ETAA1、PNPLA8、PALB2等。ZNF518A基因的截短变异与较短的生殖寿命相关,携带此变异的女性平均绝经年龄比正常女性早5.61年。此外,ZNF518A还与较晚的初潮年龄(menarche age)相关,平均延迟0.56年。而SAMHD1基因的变异不仅与卵巢老化有关,还增加了男女两性患癌症的风险。SAMHD1基因的突变与延长的生殖寿命和较高的癌症风险有显著关联,特别是对前列腺癌和乳腺癌的易感性。
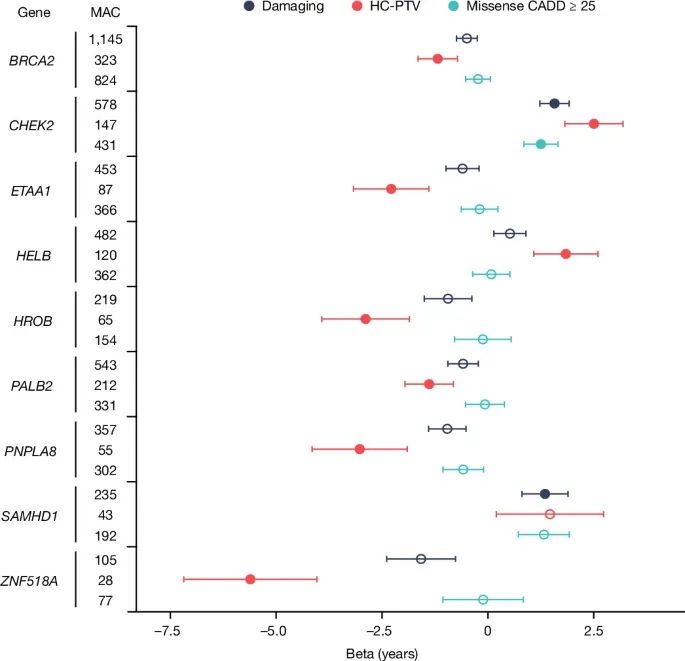
与自然绝经年龄(ANM)相关的基因负担分析(gene burden analysis)的森林图(forest plot)(Credit: Nature)
基因和变异类型:图中展示了通过全外显子组显著性水平的多个基因(如BRCA2、CHEK2、ZNF518A、PALB2、SAMHD1等)以及它们的变异类别,包括高置信度蛋白截短变异(HC-PTVs)和损伤变异(damaging variants)。
效应大小(Beta值)和置信区间:每个基因的点和误差线表示其效应大小(Beta值)和95%的置信区间。负Beta值表示该基因变异与提前绝经相关,正Beta值表示与推迟绝经相关。比如,ZNF518A的截短变异携带者的绝经年龄平均提前了5.61年,而SAMHD1变异携带者的绝经年龄平均延迟了1.35年。
显著性标记:填充的圆点代表在统计上显著的关联结果,空心圆点表示非显著的结果。通过这些结果,可以看到不同基因变异对自然绝经年龄的显著影响,以及它们的不同效应大小。
与癌症风险的关联
该研究进一步加强了卵巢老化与癌症易感性之间的关联。尤其是,损伤修复基因(DNA damage repair, DDR)在维持卵母细胞的基因完整性中发挥了重要作用。研究发现,BRCA1和BRCA2基因变异的携带者不仅卵巢老化进程加快,且相关的双链DNA断裂修复机制受损,导致卵巢储备的早期耗竭。这些基因变异也与乳腺癌和前列腺癌等多种癌症的高风险相关。
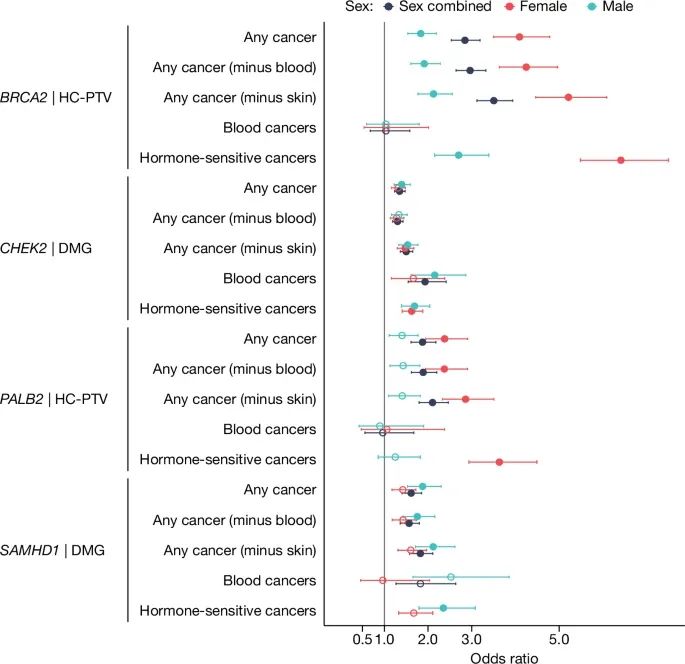
与自然绝经年龄(ANM)相关的全外显子组测序基因(WES genes)与不同癌症表型显著基因负担关联的森林图(Credit: Nature)
基因和变异类型:图中展示了与ANM相关的显著基因(如BRCA2、CHEK2、PALB2、SAMHD1等),并展示了这些基因的不同变异类别(如高置信度蛋白截短变异(HC-PTVs)、损伤变异(DMG))在癌症风险中的效应。
效应大小(OR值)和置信区间:每个基因和癌症类型的点和误差线表示其相对风险(Odds Ratio, OR)和95%的置信区间。OR值大于1表示这些基因变异与癌症风险增加相关,OR值小于1则表示癌症风险降低。比如,SAMHD1的损伤变异与多种癌症的风险显著增加相关,特别是在男性前列腺癌和女性乳腺癌中,OR值较高,表明这些变异显著增加了癌症的易感性。
性别分层分析:图中对男性和女性分别进行了癌症风险的分层分析,展示了在不同性别中的具体效应。例如,BRCA2和CHEK2变异不仅在女性中增加乳腺癌风险,在男性中也增加前列腺癌风险。
显著性标记:填充的圆点表示这些基因变异与癌症风险的关联在统计上具有显著性(通过了Bonferroni校正),空心圆点则表示关联非显著。多数基因(如SAMHD1、BRCA2、CHEK2)的变异与多种癌症显著相关。
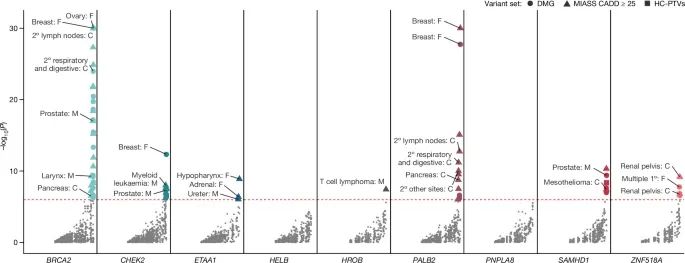
卵巢早衰(premature ovarian ageing)遗传易感性及其对多种癌症类型的风险增加之间的关联(Credit: Nature)
基因与癌症类型的关联:图中列出了与卵巢早衰相关的多个基因(如BRCA2、CHEK2、SAMHD1、PALB2等),并分析了这些基因变异与90种特定癌症类型之间的关联。不同癌症类型的名称在图中标注,表明这些基因变异显著增加了特定癌症的风险,例如乳腺癌、前列腺癌、胰腺癌、间皮瘤等。
显著性水平:图中的Y轴表示与癌症风险关联的显著性(P值)的负对数(-log10(P))。P值越低,关联越显著。为了便于可视化,Y轴上的显著性水平被设置为上限30,因此一些高显著性关联的P值未完全展示。部分癌症类型的标注,如乳腺癌和前列腺癌,显示了这些基因与癌症的极强关联。
不同癌症类型的高风险关联:图中标注了多种癌症类型,这些癌症与卵巢早衰相关基因的变异显著关联。例如,BRCA2和CHEK2变异与乳腺癌和前列腺癌显著关联,SAMHD1与间皮瘤(mesothelioma)和血液系统癌症(如T细胞淋巴瘤)的风险增加显著相关。此外,PALB2基因变异与多种原发癌症的风险增加相关。
遗传易感性的广泛影响:卵巢早衰的遗传易感性不仅与卵巢老化相关,还显著增加了多种癌症的风险,特别是在激素敏感型癌症和血液系统癌症中,这些基因变异的影响尤为显著。
新发现的基因功能
ZNF518A和PNPLA8基因是首次被发现与卵巢老化相关的非DDR基因。ZNF518A基因属于锌指蛋白家族,可能作为转录调控因子,通过调控多个与生殖寿命相关的基因发挥作用。而PNPLA8基因是独立于钙的磷脂酶,与线粒体疾病相关,尽管之前未有研究证明其与生殖表型的关联,但此次研究表明其可能在卵巢老化中发挥重要作用。
与新发突变率的关联
研究还探讨了罕见蛋白编码基因变异与母体来源的新发突变率(de novo mutation rate)的关联。通过分析100,000基因组计划(100kGP)中的8,089个测序三联体,研究发现,与早期卵巢老化相关的常见遗传变异与母体来源的新发突变率升高存在显著关联。这表明,卵巢老化不仅影响女性生殖寿命,还可能对后代的遗传完整性产生影响。然而,该发现尚未在独立样本中得到验证,需要进一步的研究来确定其机制和影响。
该研究首次系统性地研究了罕见蛋白编码基因变异对卵巢老化的影响,扩展了我们对卵巢老化遗传机制的理解。研究发现了一些具有较大效应的罕见变异基因,这些基因与常见变异相比对卵巢老化的影响更为显著。这些基因包括参与DNA损伤修复的基因,如BRCA1、BRCA2,以及其他可能调控卵巢老化的新基因,如ZNF518A、PNPLA8。
未来的研究可以考虑进一步探索这些基因在不同人群中的普遍性及其对不同疾病风险的影响。此外,开发基于这些发现的遗传检测工具,可能为女性提供更加个性化的生育健康管理方案。研究结果还提示,延缓卵巢老化的潜在治疗方法可以针对这些关键基因,尤其是通过增强卵母细胞的DNA修复能力,延长女性的生殖寿命,并降低相关的癌症风险。
参考文献
Stankovic S, Shekari S, Huang QQ, Gardner EJ, Ivarsdottir EV, Owens NDL, Mavaddat N, Azad A, Hawkes G, Kentistou KA, Beaumont RN, Day FR, Zhao Y, Jonsson H, Rafnar T, Tragante V, Sveinbjornsson G, Oddsson A, Styrkarsdottir U, Gudmundsson J, Stacey SN, Gudbjartsson DF; Breast Cancer Association Consortium; Kennedy K, Wood AR, Weedon MN, Ong KK, Wright CF, Hoffmann ER, Sulem P, Hurles ME, Ruth KS, Martin HC, Stefansson K, Perry JRB, Murray A. Genetic links between ovarian ageing, cancer risk and de novo mutation rates. Nature. 2024 Sep 11. doi: 10.1038/s41586-024-07931-x. Epub ahead of print. PMID: 39261734.
https://www.nature.com/articles/s41586-024-07931-x


