西南交通大学郑晓彤团队《AHM》: 多腔室核壳磁性纳米载体用于肿瘤的实时、全时一体化诊断和治疗
时间:2024-09-23 12:02:39 热度:37.1℃ 作者:网络
肿瘤治疗新技术:诊疗一体化纳米平台
目前,癌症是全球范围内导致死亡的主要原因,每年有数百万人死于癌症。目前的治疗方法包括手术、化疗和放疗。而随着纳米医学的发展,集诊断和治疗功能于一体的纳米诊疗平台可进一步开发,用于肿瘤治疗过程中载药纳米颗粒的积累、药物递送和术后治疗。其中,具有高载药量和无创成像特性的诊疗一体化纳米载体有望同时实现治疗和监测的效果。然而,单模态成像的限制和传统诊断和治疗的区域化往往削弱了对病灶部位相关信息的精确获取,阻碍了个性化肿瘤治疗的实施。
多模态纳米诊疗平台
近日,西南交通大学郑晓彤课题组将荧光成像( FLI ),磁共振成像(MRI)与和肿瘤治疗药物脱盐阿霉素( DOX )结合到纳米诊疗平台中,设计了一种多模态纳米诊疗平台(图一),可同时作为药物和显像剂多载荷纳米载体,促进肿瘤治疗效率,解决了难以对肿瘤治疗整个过程的关键阶段和信号可持续性的及时监测的难题。
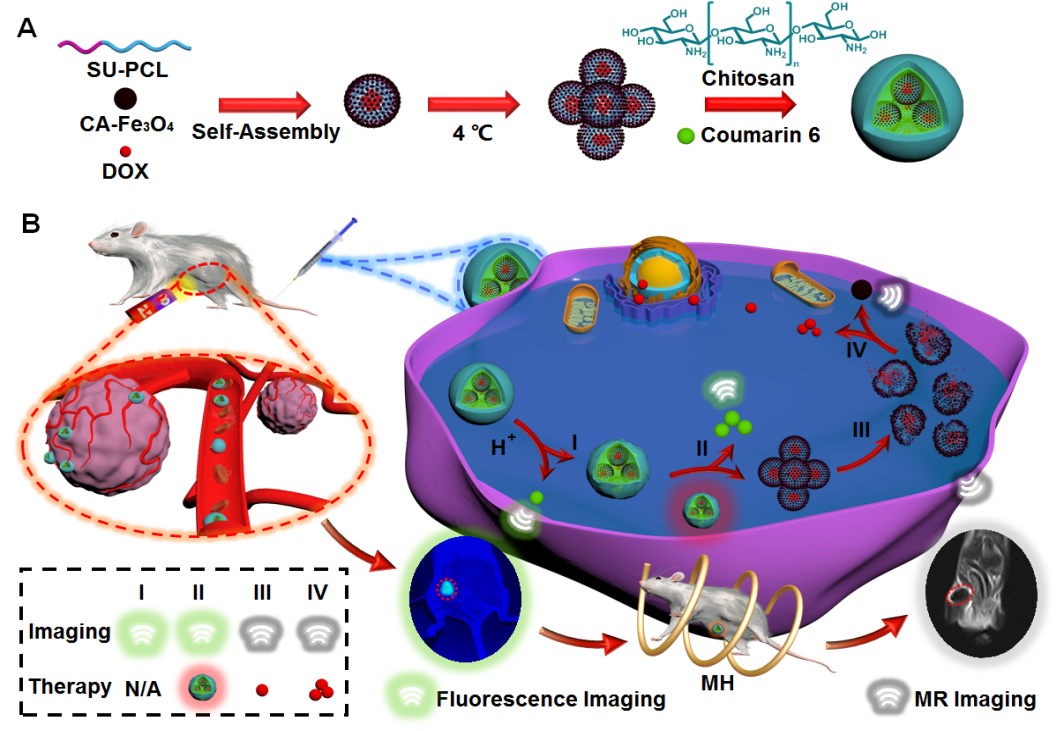
图一 多腔室核壳结构的治疗纳米载体的示意图
在这项研究中,作者首先设计了一种自组装形成的具有磁性壳层的核壳纳米球( C-MNPs )作为内腔,香豆素6 ( C6 )被引入到内部多腔室之间的空腔中,而壳聚糖被用作多腔室核壳磁性纳米球( MC-MNPs )的外壳层。壳聚糖在酸性肿瘤微环境( TME )中逐渐溶解,导致C6和肿瘤信号在"治疗开始" (时间I )时有序逃逸。随后,在磁热( MH )下(时间II ),壳聚糖壳层受较高温度的影响而进一步解体,暴露出磁性核壳纳米球,表现出梯度降解行为。随后,多个腔室中装载的脱盐阿霉素( DOX )被均匀释放,同时显示出持续的高对比度MRI信号(Ⅲ、Ⅳ次)(图一)。
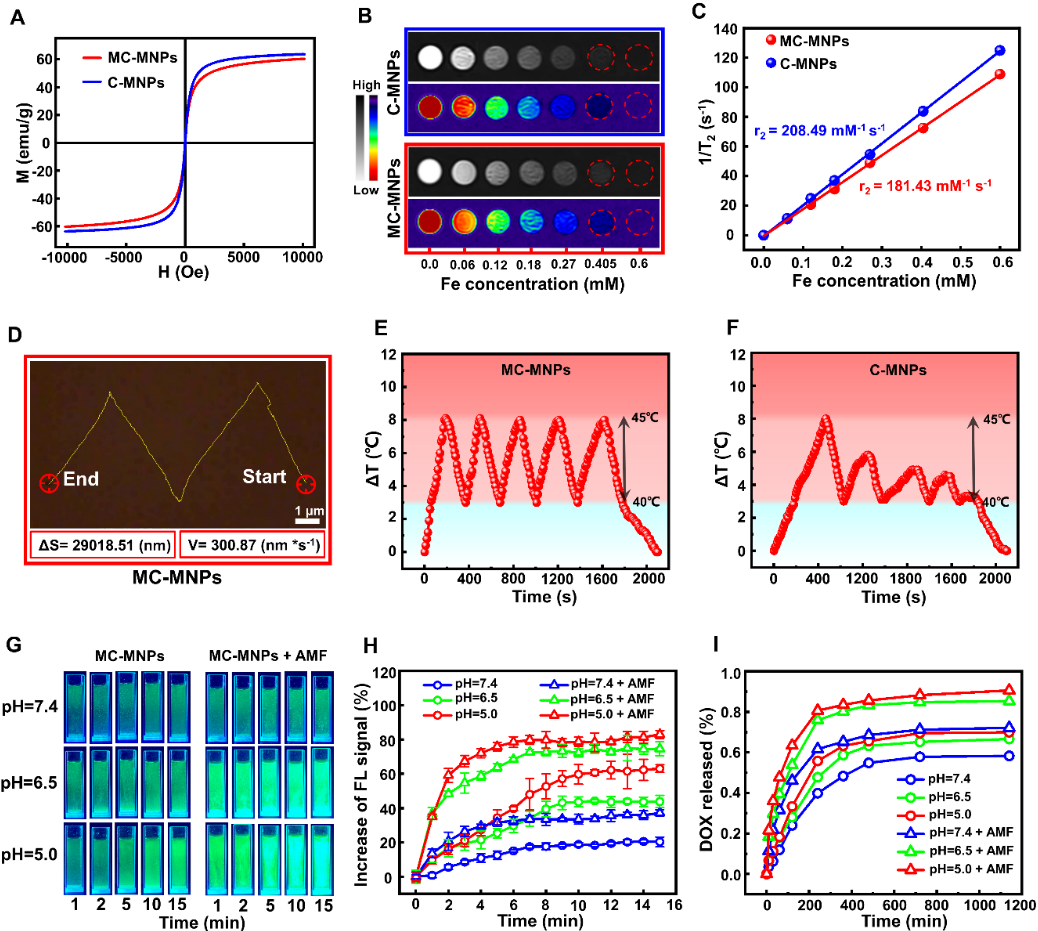
图二 MC-MNPs的功能特性
为了进一步探究MC - MNPs的多腔室性能,将C - MNPs和MC - MNPs都进行了体外MRI测量,结果表明由于MC - MNPs具有独特的磁性外壳结构,MC - MNPs的多腔室结构与C - MNPs相比具有更长的弛豫时间以保持MRI效率。同时,作者通过磁靶向运动直接评估了MC - MNPs的磁响应性能,发现MC - MNPs和C - MNPs均沿着预定的轨迹运动,其平均运动速度分别为300.87和284.43 nm/s。此外,多腔室核壳结构的磁热能力与药物释放行为证明了MC - MNPs在肿瘤环境中的梯度降解和稳定释放的可控性,表明其可以在靶向肿瘤部位实现持续的成像和药物富集的梯度诊疗效果,可应用于全时肿瘤诊断和治疗(图二)。
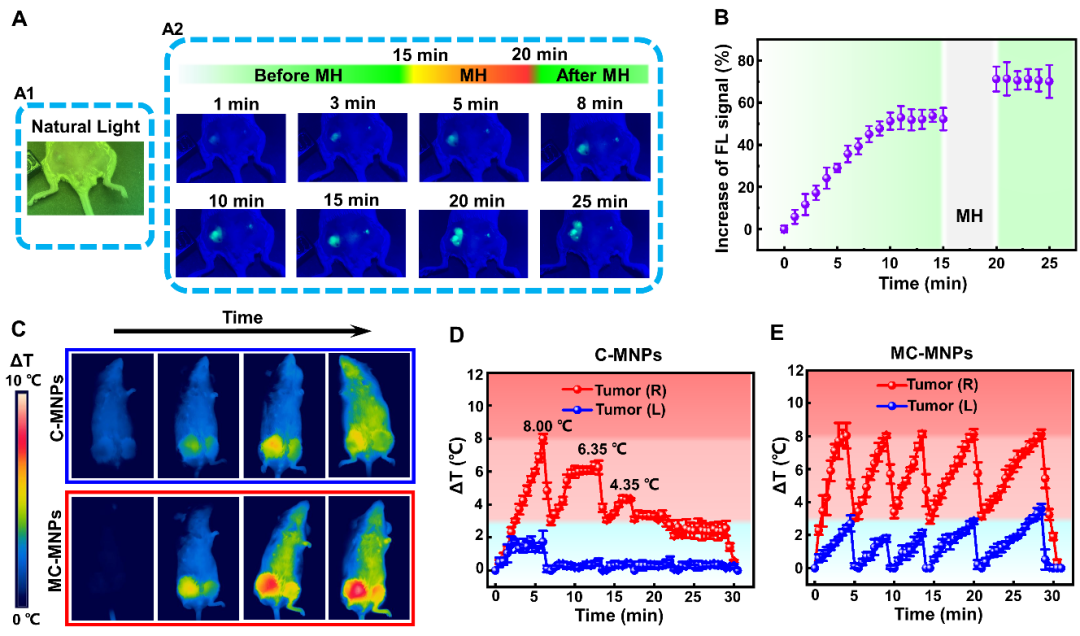
图三 MC - MNPs的体内FLI和MH效应
为了研究MC - MNPs在特定荧光下的体内FLI特性,对过滤后的自然光和特异性荧光光下肿瘤中C6的荧光信号进行了对比诊断,发现即使在C6发射光的波长下,肿瘤组织也没有发光效果,然而同一肿瘤部位在荧光下会显示出明显的荧光信号。此外,从MH期间荧光信号强度的定量变化中发现注射MC - MNPs 11 min后,靶向肿瘤的荧光强度最高,并在几分钟内保持稳定。与C - MNPs组相比,MC - MNPs在多次加热过程中表现出更优异的MH效率和稳定性,突出了MC - MNPs在肿瘤中可控的热疗潜力(图三)。
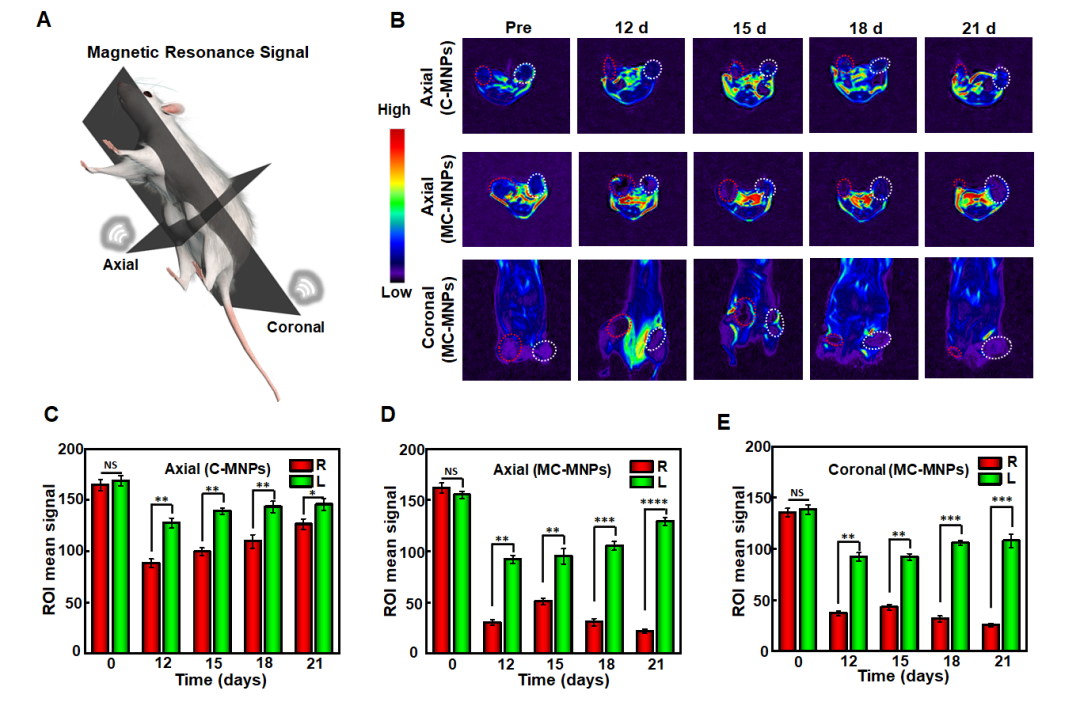
图四 4T1荷瘤小鼠活体T2加权MRI研究
作者为了分析纳米载体在小鼠肿瘤治疗过程中的MR信号,构建了多面的实时诊断模型,发现与C - MNPs相比,MC - MNPs表现出更大程度的降低靶向肿瘤的信号强度,并在整个期间保持这种效果。此外,MC - MNPs保留了肿瘤与周围区域之间的高MRI信号对比度。从C - MNPs组的轴线角度来看,随着时间的延长,靶向肿瘤信号上ROI的灰度程度显著降低,平均降低程度约为35.7 % 。相反,MC - MNPs组的ROI在轴位和冠状位方向上都显示了靶向肿瘤信号强度的大幅降低,平均降低幅度分别为79.3 %和74.8 %。重要的是,灰度降低的巨大差异在整个肿瘤治疗过程中具有良好的持久性(图四)。
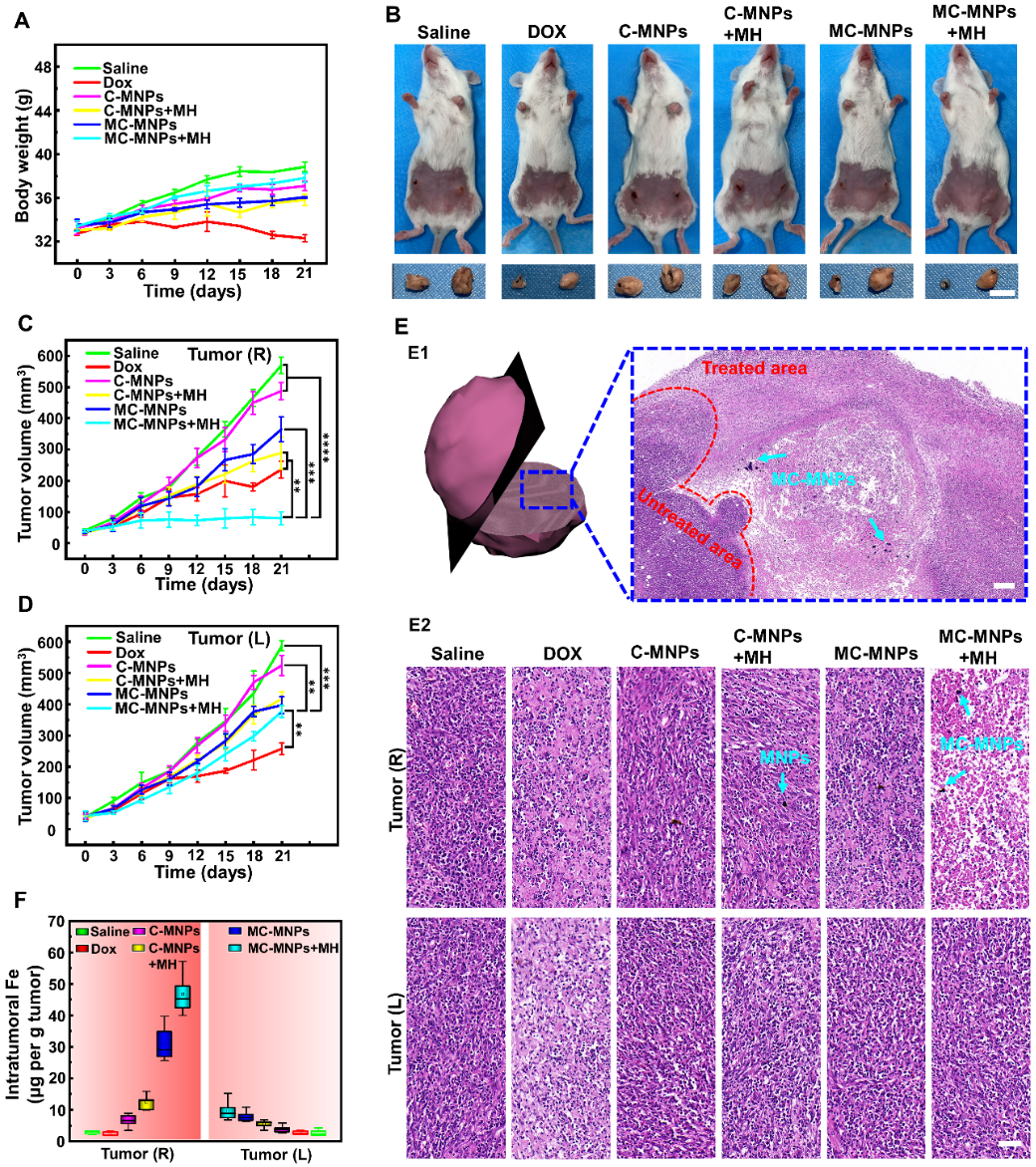
图五 在4T1双荷瘤小鼠模型中评估不同治疗方式的制剂的治疗效果
最后,作者进一步评估了MC - MNPs在各组小鼠肿瘤的治疗效果,发现C - MNPs处理的小鼠仅对MH下的靶向肿瘤表现出治疗效果,而MC - MNPs即使在没有MH的情况下也表现出显著的肿瘤抑制效果,对靶向肿瘤具有显著的选择性。在磁场的引导下,MC - MNPs可以深入到肿瘤内部,并通过有效的热-化学结合有效地清除靶向肿瘤中的癌细胞(图五)。因此本研究为探索MC - MNPs在实时和全时诊疗纳米平台中作为个性化和精准的纳米载体提供了一种新策略。
该研究成果在国际著名学术期刊《Adv. Healthcare Mater》上在线发表,西南交通大学2020级生物医学工程专业硕士生孔德港为该工作第一作者。
研究论文:
Degang. Kong, Xiaotong Zheng, et al. Multi-Chambered Core/Shell Supraparticles for Real-Time, Full-Time Diagnosis and Treatment Integration of Tumors. Adv. Healthcare Mater. 2024, 2401749. https://doi.org/10.1002/adhm.202401749
原文链接:
https://doi.org/10.1002/adhm.202401749


