浙江大学王杭祥团队《Cancer Research》:首次提出可离子化免疫佐剂用于抗肿瘤免疫治疗
时间:2024-09-24 18:00:35 热度:37.1℃ 作者:网络
2024年9月16日,王杭祥教授团队在免疫佐剂研究取得进展,该成果以 “Ionizable STING-Activating Nanoadjuvants Enhance Tumor Immunogenicity and Potentiate Immunotherapy Efficacy in Solid Tumor”为题,在《Cancer Research》杂志在线发表研究论文。该研究针对STING激动剂的临床应用困境,创新性地提出了可离子化前药概念,以改善免疫激动小分子在细胞内的快速激活和肿瘤浸润效率。该项工作不仅为靶向STING信号通路的候选药物的设计和高端制剂研发提供了新的思路,也为STING激动剂注射液制剂的临床转化提供了理论基础。
免疫疗法通过激活自身免疫系统来杀伤癌细胞,是癌症治疗的主要手段之一。基于CTLA-4和PD-1/PD-L1的免疫检查点阻断疗法已在多种肿瘤的临床治疗中取得显著成果。然而,这种方法在缺乏细胞毒性T淋巴细胞的“免疫沙漠型”肿瘤中的治疗效果仍然有限。因此,除了直接靶向适应性免疫应答外,激活先天性免疫可以让更多癌症患者受益。STING蛋白通过促进抗原呈递细胞成熟和招募CD8+ T细胞来增强抗肿瘤免疫,因此是一个极具潜力的免疫治疗靶点。然而,环状二核苷酸类STING激动剂(如cGAMP)在临床应用中因半衰期短、易被酶降解或快速代谢清除及入胞困难等问题而存在临床应用挑战。新一代非核苷酸类STING激动剂被认为具有较好的成药性,但是存在水溶性较差,通过注射给药通常会导致系统性毒性和较大的不良反应等问题。
课题组选用非核苷酸类STING激动剂MSA-2作为研究对象。首先,通过长度不同的碳链将MSA-2分子与哌嗪基团连接,设计并合成了一系列可离子化前药(图1)。在微酸性的肿瘤环境中,前药分子中的哌嗪基团被质子化,这种极性转变促进药物进行溶酶体逃逸并渗入细胞质中,从而实现STING通路的快速有效激活。通过MSA-2系列前药促进 BMDC成熟能力分析,确定了前药3(Prodrug 3)具有最大的激活STING通路的活性,因此以前药3作为后续研究的模型药物来探究其体内递送及活性。进一步,他们开发了一种酸敏感型脂质体(iProsome-3)用于Prodrug 3的静脉注射给药。在肿瘤环境中,该脂质体能够促进自身表面的聚乙二醇外壳脱落,使脂质体电荷由正转负,从而促进细胞摄取,并产生比常规脂质体更大的血管外渗透和肿瘤组织穿透。
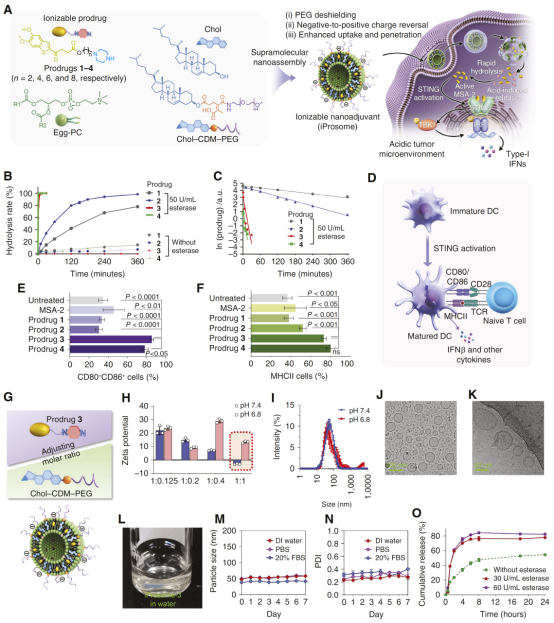
图1,可离子化STING激动剂MSA-2的前药设计及纳米佐剂的构建。
在MC38结肠癌模型中,静脉注射iProsome-3的抗肿瘤疗效明显高于口服游离型MSA-2,表现为淋巴结中成熟DC和肿瘤浸润的CD8+效应T细胞的增加(图2)。在临床相关的原发性结直肠癌小鼠模型中,iProsome-3显示出比游离MSA-2或常规脂质体(STING-cLP)更强的治疗效果。此外,在αPD-1低反应性4T1三阴性乳腺癌中,iProsome-3与免疫检查点阻断联合使用表现出优异的抑瘤效果。综上,在该研究中,课题组首次提出可离子化前药的设计概念,并将其负载于肿瘤微环境响应型脂质体构建纳米佐剂,用以高效激活 STING 通路介导的先天免疫途径。
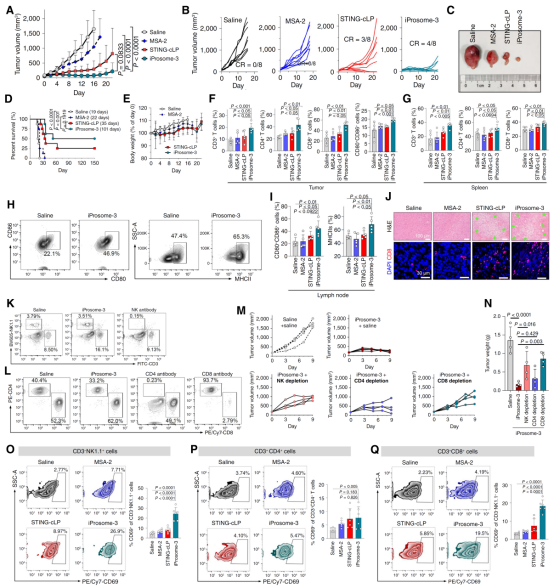
图2,纳米佐剂iProsome-3在MC38结肠癌模型中的抗肿瘤效果验证及免疫激动效应。
浙江大学医学院硕士生冼诗韵,浙江大学附属邵逸夫医院副研究员陈晓娜为论文共同第一作者;王杭祥教授为该论文的通讯作者。王杭祥教授课题组长期在抗肿瘤免疫药物和纳米递送系统的设计和转化应用领域开展深入研究,已在PNAS、Nat. Commun.、Cancer Res.、Adv. Mater.、ACS Nano、Biomaterials、J. Controlled Release等学术期刊发表论文100多篇,部分1类创新药成果已转让,并已进入临床转化阶段。本研究获得了国家自然科学基金委面上项目及山东省自然科学基金重大基础研究项目等经费的资助。
原文链接:
https://aacrjournals.org/cancerres/article-abstract/84/18/3044/747791/Ionizable-STING-Activating-Nanoadjuvants-Enhance?redirectedFrom=fulltext


