Cancer Letters:突破难关:弥漫性内在桥脑胶质瘤(DIPG)现有与新兴治疗策略综述
时间:2024-09-28 06:05:33 热度:37.1℃ 作者:网络
弥漫性内在桥脑胶质瘤(DIPG)是弥漫性中线胶质瘤(DMG)的一个亚型,属于高级别肿瘤,主要发生在脑桥。DIPG的发病率为每10万人中1.78例,美国每年约有300例确诊病例。尽管发病率较低,但胶质瘤包括DIPG仍然是19岁以下儿童癌症相关死亡的主要原因。DIPG约占所有儿童高级别胶质瘤(HGG)的近一半,通常影响6至8岁的儿童。其中位生存期不足一年,五年整体生存率低于1%。尽管近年来在分子层面的理解有所进展,但DIPG的预后仍然没有改善。
近日,Afshin Salehi 团队在 Cancer Letters 发表了题 Diffuse intrinsic pontine glioma (DIPG): A review of current and emerging treatment strategies 的综述,该文探讨了DIPG的遗传机制,并回顾了临床试验、临床前研究和新兴的治疗靶点。多种DIPG的治疗策略已在临床前研究中进行调查,其中一些显示出希望,并已被进一步转化为正在进行的临床试验。综述总结道:针对细胞内在变化、微环境并增强免疫系统的多方面治疗方法可能是根除DIPG的必要手段。

文章首先从基因角度讨论了DIPG和组蛋白3(H3)赖氨酸27(K27)改变型肿瘤背后遗传驱动因素的同质性:大多数发生在中线的高级别胶质瘤与H3 K27M突变相关,这种突变发生在H3.1或H3.3组蛋白上,或通过EZHIP基因。
H3.1 K27M突变是由HIST1H3B基因突变引起,而H3.3 K27M突变则由H3F3A基因突变引起。H3.3 K27M突变在三分之二的DIPG和非脑干小儿高级别胶质瘤中发现,而H3.1 K27M肿瘤主要位于脑桥。在脑桥中,H3.3 K27M突变常与TP53或PPM1D突变相关,而H3.1 K27M肿瘤则通常有ACVR1突变。
在丘脑中,H3.3 K27M突变与TP53或FGFR突变相关,这两种突变占该部位高级别胶质瘤的60%以上。相比之下,带有H3.3 G34 R/V突变的肿瘤主要出现在大脑半球,被归类为"弥漫性半球胶质瘤,H3 G34-突变"。这些肿瘤与TP53和ATRX突变共同分离,是唯一具有高频MGMT启动子甲基化的小儿胶质瘤。ATRX突变在DIPG中较为罕见,但一旦出现,它与肿瘤生长减缓和生存率提高有关,这可能解释了ATRX突变在老年患者中较为常见的原因。H3 K27M突变通常在幼儿中确诊,而H3.3 G34 R/V突变更常见于青少年和年轻成人。
EZH2作为PRC2复合体的一种甲基转移酶,其失调与多种癌症相关,包括DMG。EZH2通过在H3的K27位点进行甲基化来引发转录沉默。抑制PRC2减少了H3的总甲基化,并促进细胞分化和增殖。值得注意的是,K27M突变会作为"分子毒素"抑制EZH2的催化活性。尽管EZH2在DMG中的确切作用仍然不明确,但最近的研究表明,EZH2可能在这些胶质瘤中起到肿瘤抑制作用。
除了组蛋白突变外,DIPG还表现出常见的癌症信号通路改变,最显著的是PDGFRA的基因扩增或突变,以及p53功能丧失。PDGFRA存在于32%的DIPG中,并在Ras-PI3K-Akt信号通路中发挥重要作用,该通路在69%的DIPG中活跃。PDGFRA通过促进磷酸化和激活PI3K和MAPK通路发挥作用。此外,CDKN2A/B基因缺失,常见于多种癌症类型,导致细胞周期中断,也出现在DIPG中。CDKN2A的表观遗传抑制可能在H3.3 K27M驱动的肿瘤发生中起重要作用。
综述接下来讨论了现有的临床试验。由于DIPG位于脑干,无法进行完全的手术切除。目前的标准治疗方案是替莫唑胺结合外照射放疗,剂量为54–60 Gy,持续6周,适用于3岁以上的患者。目前,美国有21项临床试验正在研究DMG的治疗选择(图1)。其中特别值得注意的有两个实验:
GD2被确定为CAR-T细胞疗法的一个有前景的靶点,特别是考虑到它在DIPG及其他实性肿瘤(如神经母细胞瘤)中的高表达。多项临床试验正在研究针对GD2和B7-H3的CAR-T疗法,早期研究结果显示积极的治疗效果。
ONC201是一种新型研究药物,通过阻断多巴胺受体D2(DRD2)激活肿瘤坏死因子相关的凋亡诱导配体(TRAIL)。前期临床数据显示,ONC201对H3K27M突变型胶质瘤特别有效。临床试验显示其具有肿瘤缩小和改善患者预后的积极效果。ONC201目前正在进行II期临床试验,有望成为第一个获得FDA批准用于治疗H3 K27M改变型胶质瘤的药物。
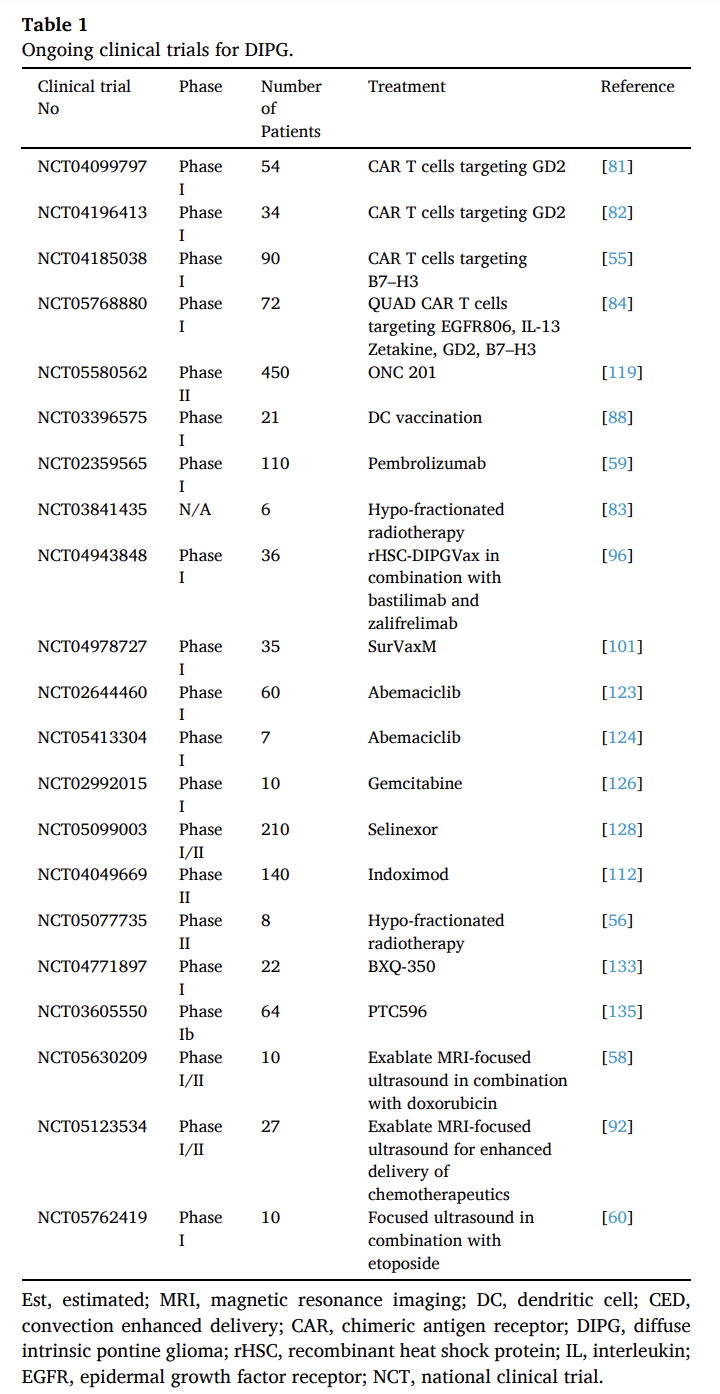
图1: 弥漫性内在桥脑胶质瘤(DIPG)的正在进行的临床试验
综述还讨论了用于治疗DIPG的新兴靶点,特别关注纳米技术。纳米颗粒能够穿过血脑屏障(BBB),提供增强的成像和靶向治疗输送。结合纳米颗粒和其他疗法的策略正在探索中,以促进长期生存。其中,OLIG2是一个值得注意的新兴靶点。研究强调了OLIG2在DIPG生长调节中的作用,抑制OLIG2影响了EGFR和YAP1等通路,提示OLIG2为潜在的治疗靶点。
最后,综述讨论了DIPG的新兴免疫疗法,强调了炎症微环境的重要性。研究表明,DIPG肿瘤中的免疫细胞,如T淋巴细胞含量较低,主要由巨噬细胞组成,这些巨噬细胞的行为与成人胶质母细胞瘤(GBM)中的不同。DIPG相关的巨噬细胞炎症性较弱,可能促使DIPG肿瘤发生,这与GBM不同。理解这种特殊的免疫微环境可能为未来的免疫疗法提供依据。
总结来说,由于缺乏安全的外科手术选择以及当前药物和放疗的无效性,弥漫性内在性桥脑胶质瘤(DIPG)预后极差。然而,随着对H3 K27M突变DIPG生物学理解的进步以及正在进行的临床试验,新疗法的出现提供了希望。分子水平的进展和对免疫微环境的深入理解预计将引导新的治疗策略,为患者、家庭成员和医疗提供者提供了乐观的前景。


