J Exp Med:线粒体是肺动脉高压血管生成模式的主要决定因素
时间:2024-09-28 12:00:38 热度:37.1℃ 作者:网络

肺动脉高压(PAH)是一种进展性、危及生命的疾病。肺血管细胞的失控生长和随之而来的血管重塑是导致肺血管阻力(PVR)升高和右心室(RV)功能障碍的主要原因,最终可能导致患者死亡。基础研究、转化研究和临床研究的一系列研究一致表明,线粒体功能受损是临床和前临床PAH的标志性特征。然而,尽管有越来越多的证据,线粒体功能障碍(MD)与PAH之间的因果关系尚未确定。我们的研究团队创建了一种新的大鼠模型,该模型具有NFU1蛋白的人类点突变(NFU1G206C)。NFU1是一种铁-硫簇支架蛋白,负责组装和转移4Fe-4S簇到目标蛋白上,例如琥珀酸脱氢酶(SDH)和脂酰合成酶(LAS)。由于LAS的充分活性对确保脂酸(LA)供应至关重要,LAS的抑制会因NFU1不足而严重破坏线粒体稳态。特别是,它被描述为影响丙酮酸脱氢酶(PDH)、α-酮戊二酸脱氢酶、甘氨酸裂解系统(GCS)的蛋白质和支链α-酮酸脱氢酶的活性。再加上SDH的直接活性受损,SDH参与三羧酸循环和电子传递链,抑制NFU1突变导致严重的线粒体疾病和人类携带者中描述的多重MD综合症。此外,70%的NFU1突变患者发展为PAH,这一发生率比一般人群报告的(每百万10-50例)高出14,000到70,000倍。在大鼠基因组中引入该突变也在原本健康的斯普拉格-道利(SD)大鼠中诱发了自发的PAH表型。除了右心室收缩压(RVSP)和右心室肥大增加外,该模型还表现出严重的肺血管重塑和血管阻塞性疾病。从NFU1大鼠中分离的肺动脉平滑肌细胞(PASMCs)检查显示出代谢转变,促进了增强的糖酵解、抵抗凋亡和明显增殖的表型。这些早期发现提示MD在PAH中的因果作用,尽管具体的机制仍不清楚。
血管生成,或从已形成的血管中形成新血管,负责在出生与成年之间肺毛细血管体积的35倍扩张,并在成人肺中响应刺激增加血管长度和分支。然而,在PAH中,血管生成被描述为受损或功能失常。尽管增殖潜力增加且抵抗凋亡,但从PAH患者或动物中分离的肺动脉内皮细胞(PAECs)具有较少的有序分支网络、迁移能力下降,并且在体外和体内确认严重的血管生成缺陷。此外,远端肺血管密度降低是临床PAH的典型放射学表现,与右心导管检查和心脏磁共振成像显示的肺动脉压力增加和右心室功能障碍相关。相反,血管生成因子的过表达可以防止PAH的发生或逆转已建立的PAH。因此,整个疾病过程中持续丧失的血管生成能力代表了PAH中负责疾病进展和患者死亡的中心致病事件之一。然而,尽管不充分的血管生成对PAH的贡献得到了确认,推动血管生成缺乏的启动机制仍未完全明了。
因此,肺血管生成的紊乱从未直接与线粒体功能受损联系在一起,主要是因为内皮细胞(ECs)的代谢已知依赖于糖酵解。然而,这仅对静息的ECs适用。相反,生长中的ECs越来越依赖线粒体呼吸以满足其提高的能量需求。为了填补这一知识空白,研究MD是否影响PAH中的肺血管生成,我们使用了NFU1G206C大鼠模型。我们比较了MD大鼠和野生型(WTs)大鼠,以评估肺血管和毛细血管网络的渐进变化,并分析两种基因型中分离的PAEC的血管生成能力。我们的结果表明,MD大鼠的肺血管形态复杂性显著降低,表现为小肺动脉的严重丧失、动脉分支减少、毛细血管密度降低以及肺内皮细胞(PECs)的整体血管生成能力减弱。值得注意的是,LA补充后改善的线粒体功能足以拯救血管形态的缺陷并减轻PAH表型。此外,我们发现特发性PAH(iPAH)患者的肺组织中存在NFU1不足,并且LA在从人类PAH肺中分离的PAECs中有潜力拯救MD。这些发现共同表明,所发现机制对有和没有NFU1突变的PAH患者具有高度相关性。由于血管修剪的程度与PAH的严重性和患者死亡率相关,能够维持足够肺血管生成的干预措施对改善患者预后具有重要潜力。
本研究揭示了由NFU1基因人源化突变引起的线粒体功能障碍(MD)与成年肺中严重破坏的肺血管生成之间的显著联系。恢复NFU1下游靶点脂酸(LA)的生物可利用性,缓解了MD和血管生成缺陷,并拯救了NFU1G206C模型中的渐进性PAH表型。值得注意的是,特发性PAH(iPAH)患者的肺中也发现了显著的NFU1表达和信号不足,强调了本研究在非NFU1突变病例中的相关性。补充LA后,PAH患者来源的肺动脉内皮细胞(PAECs)的线粒体功能显著改善,提示LA作为潜在的治疗方法。总之,本研究揭示了MD在肺血管生成失调和PAH表现中的新角色,强调了纠正PAH患者中未被识别的NFU1/LA缺乏症的必要性。
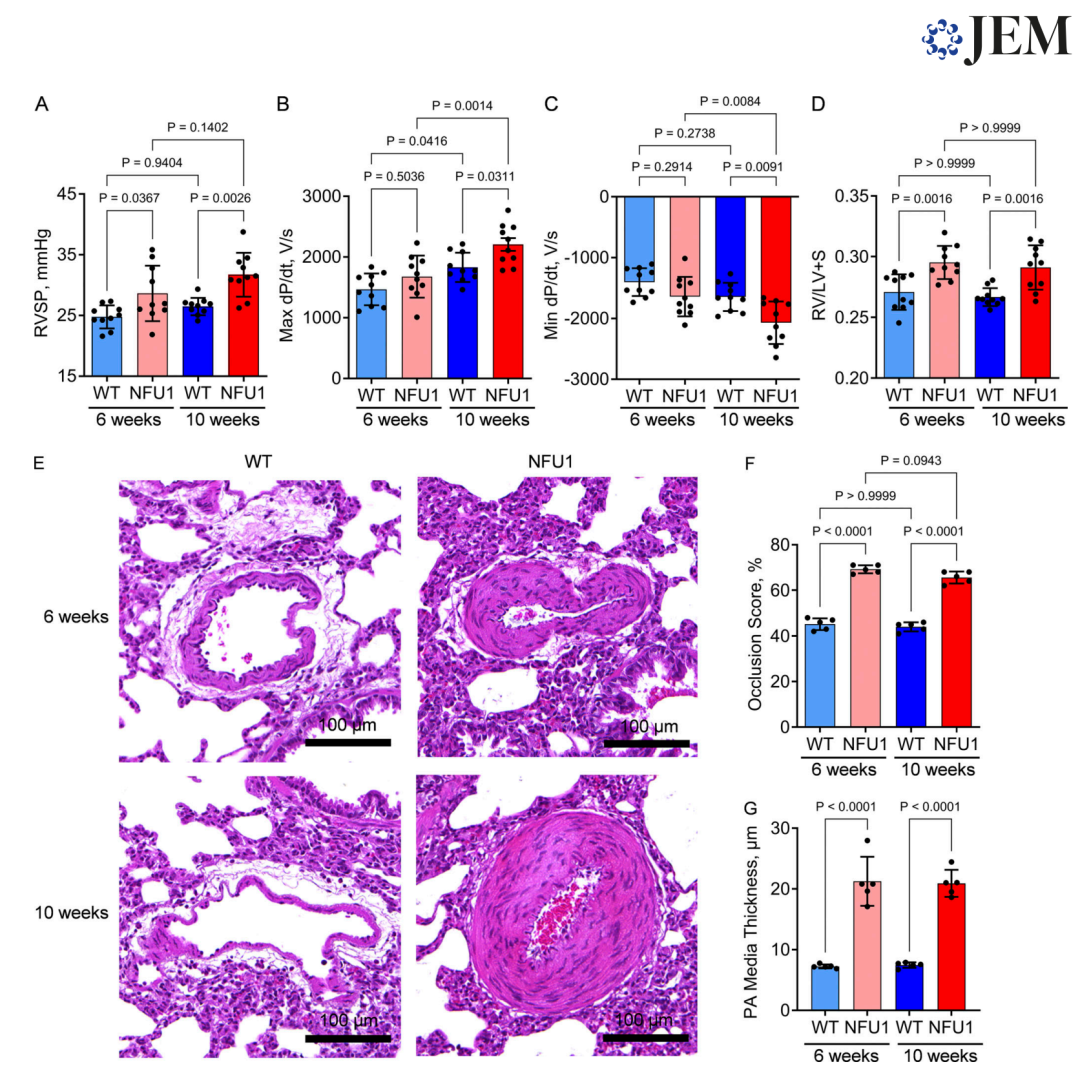
图 1. 患有 NFU1G206C 突变的大鼠会出现自发性和进行性PAH表型。
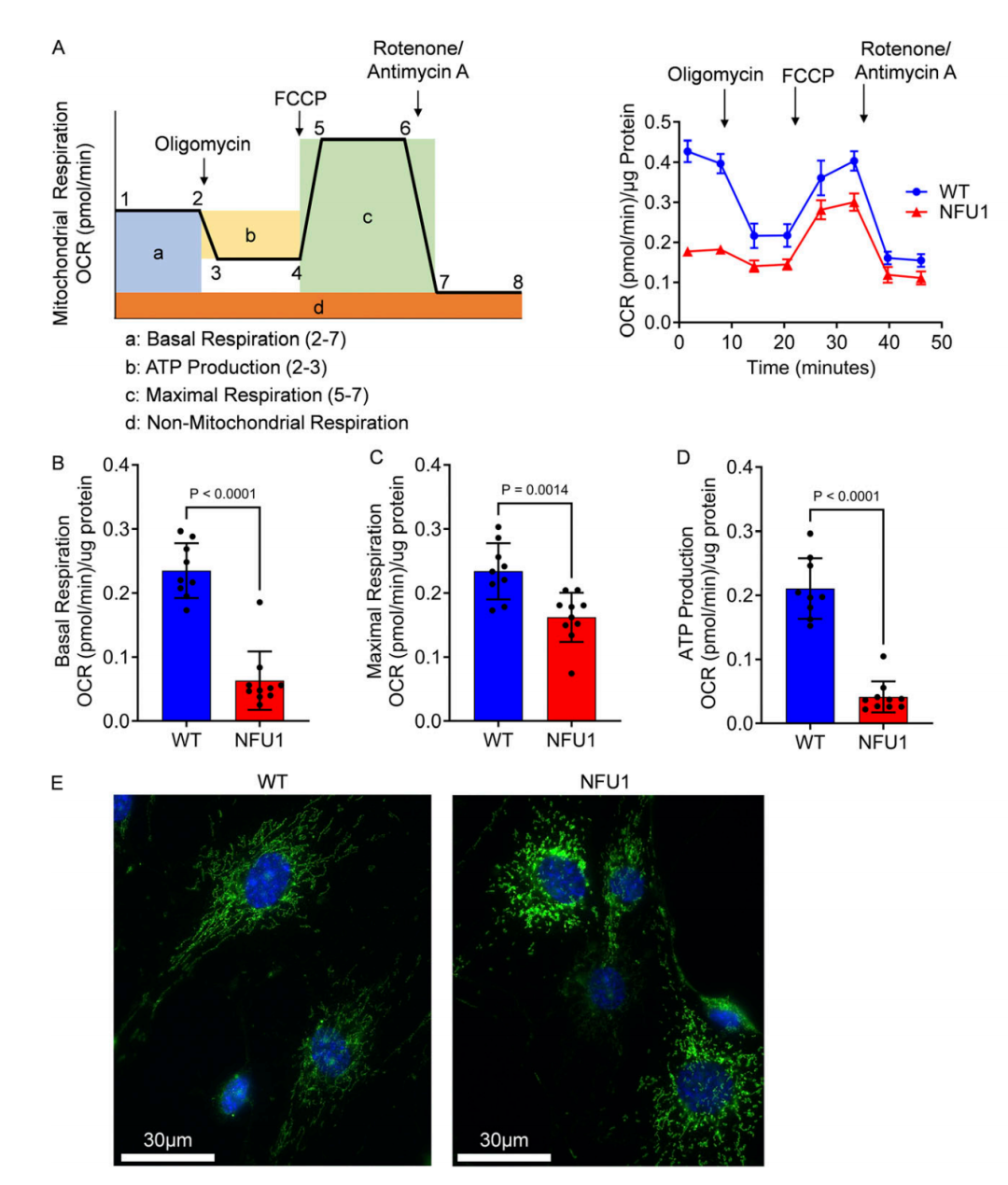
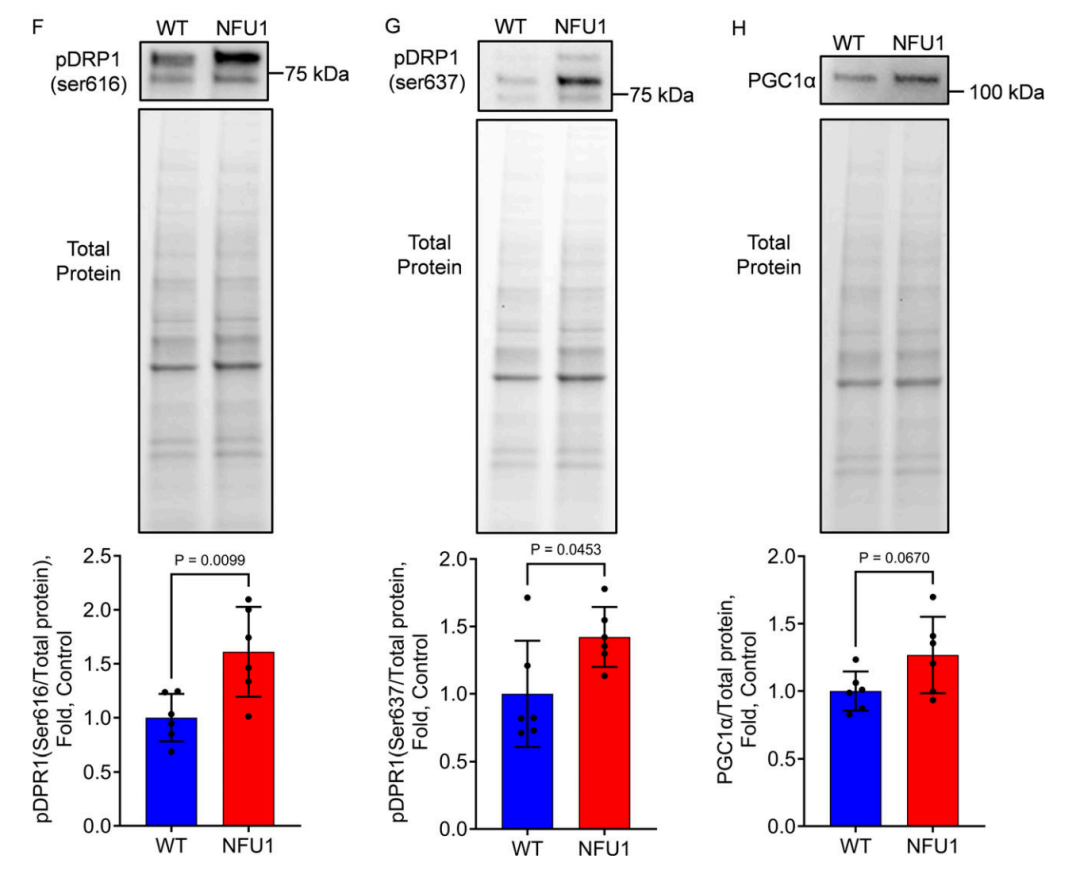
图 2. 从 NFU1G206C 大鼠中分离的 PEC 显示出受损的线粒体功能和线粒体形态。
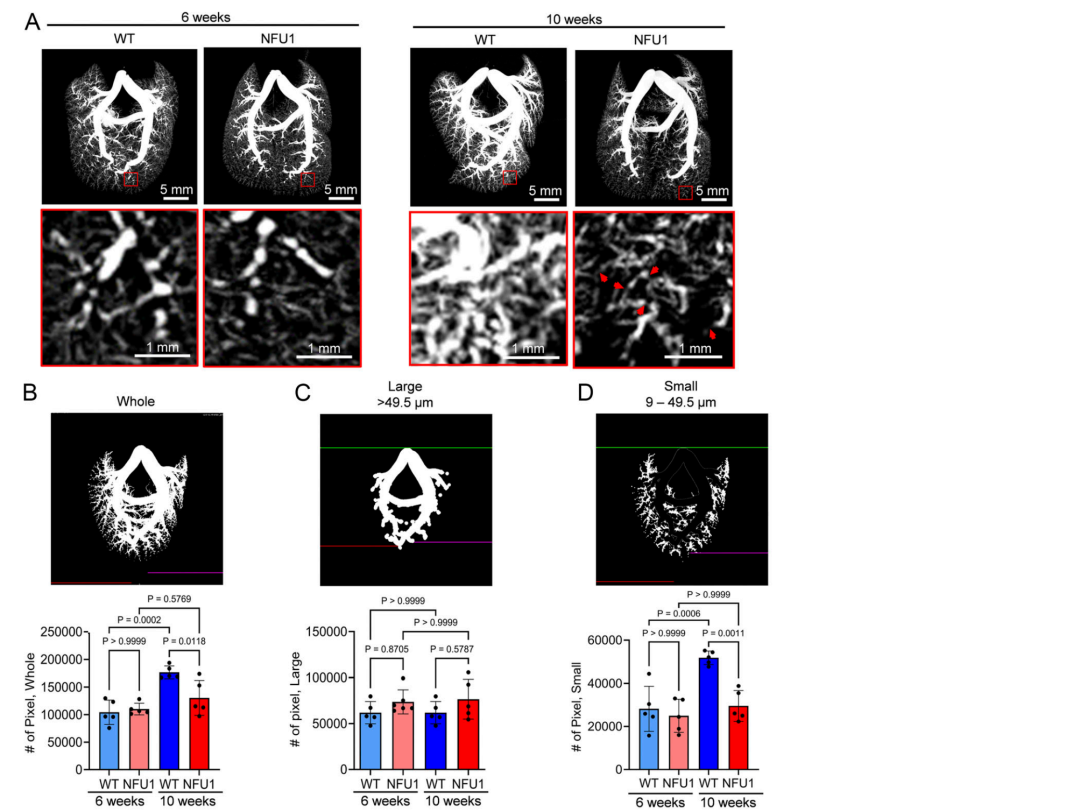
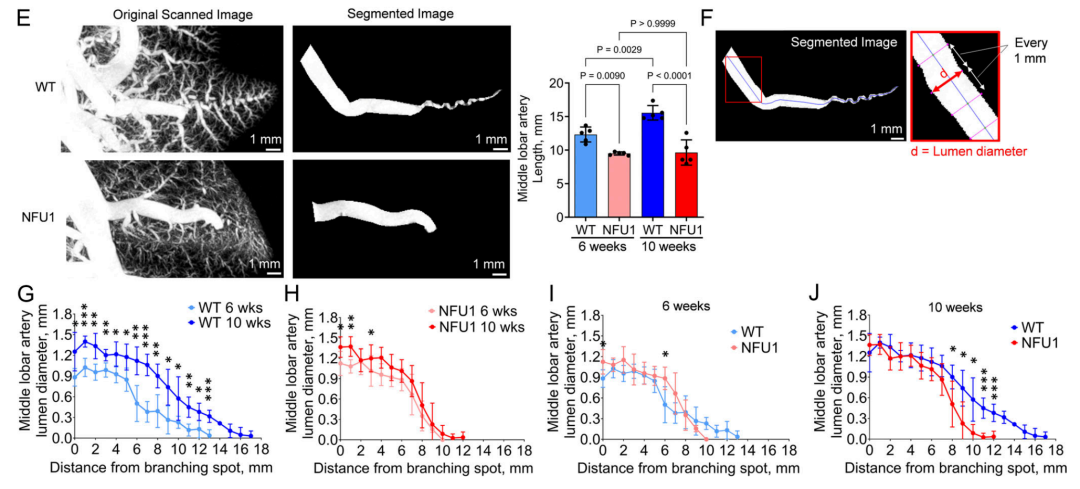
图3.NFU1G206C大鼠肺血管树形态缺陷。
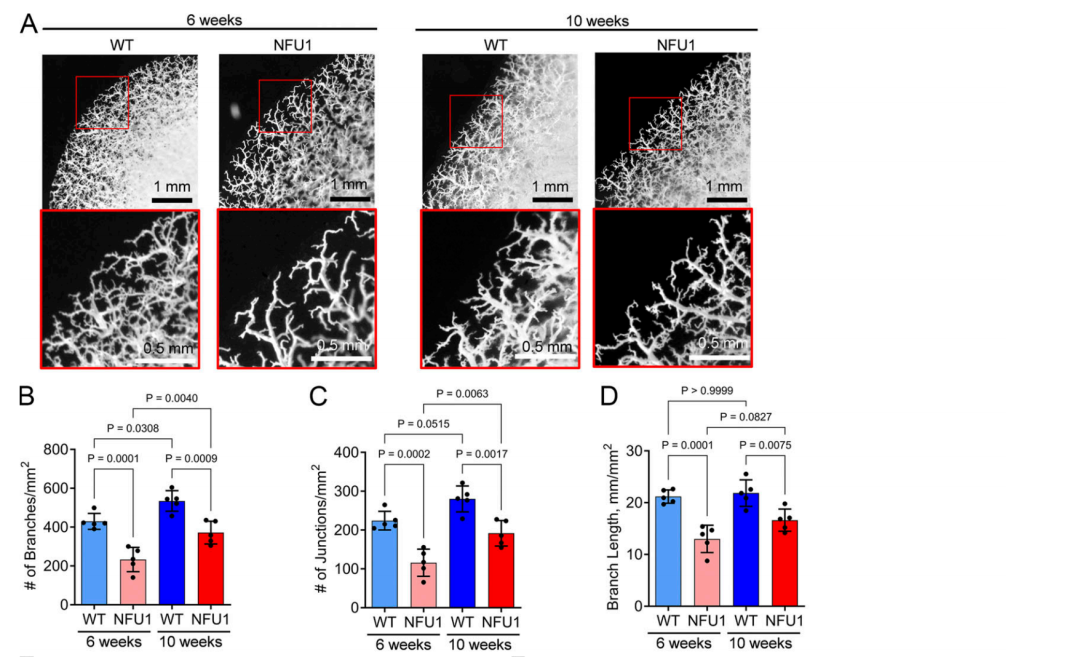
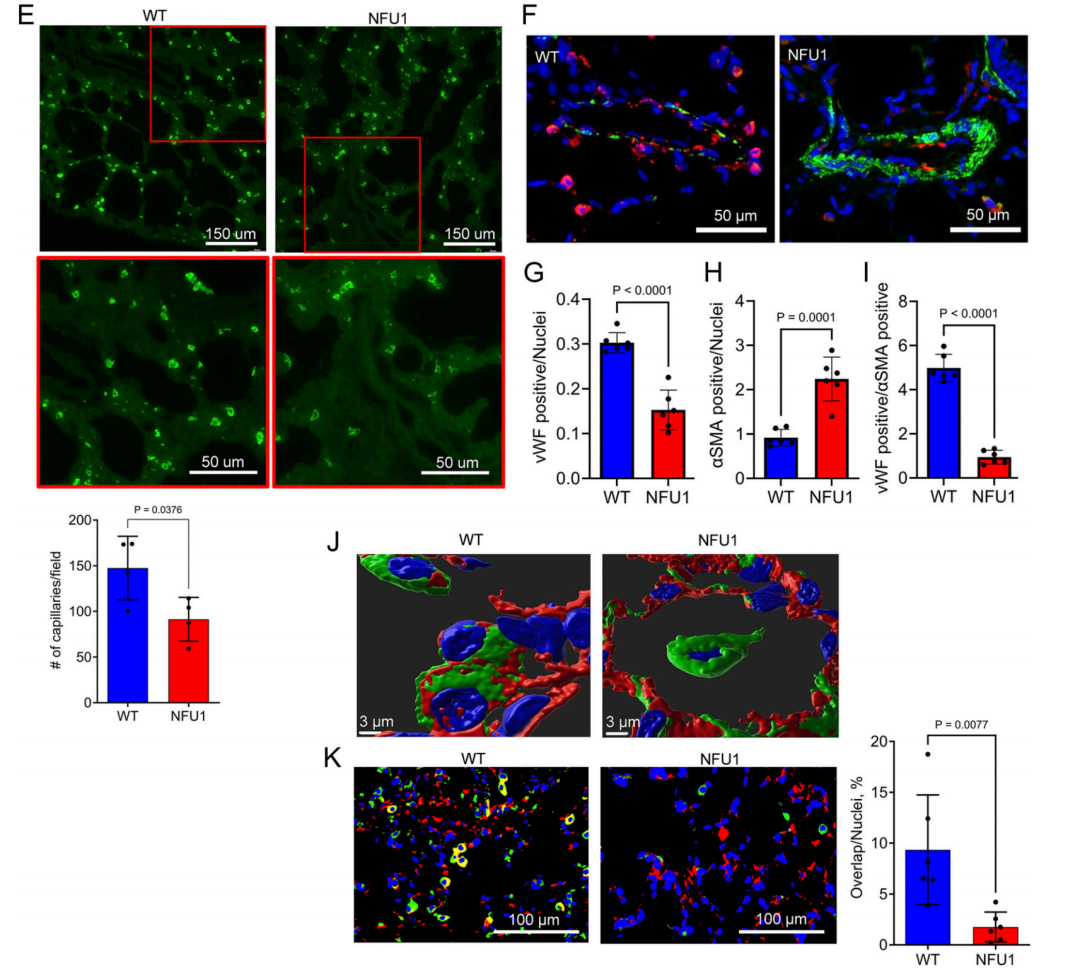
图4.NFU1G206C 基因型会损害肺微血管密度和体内平衡。
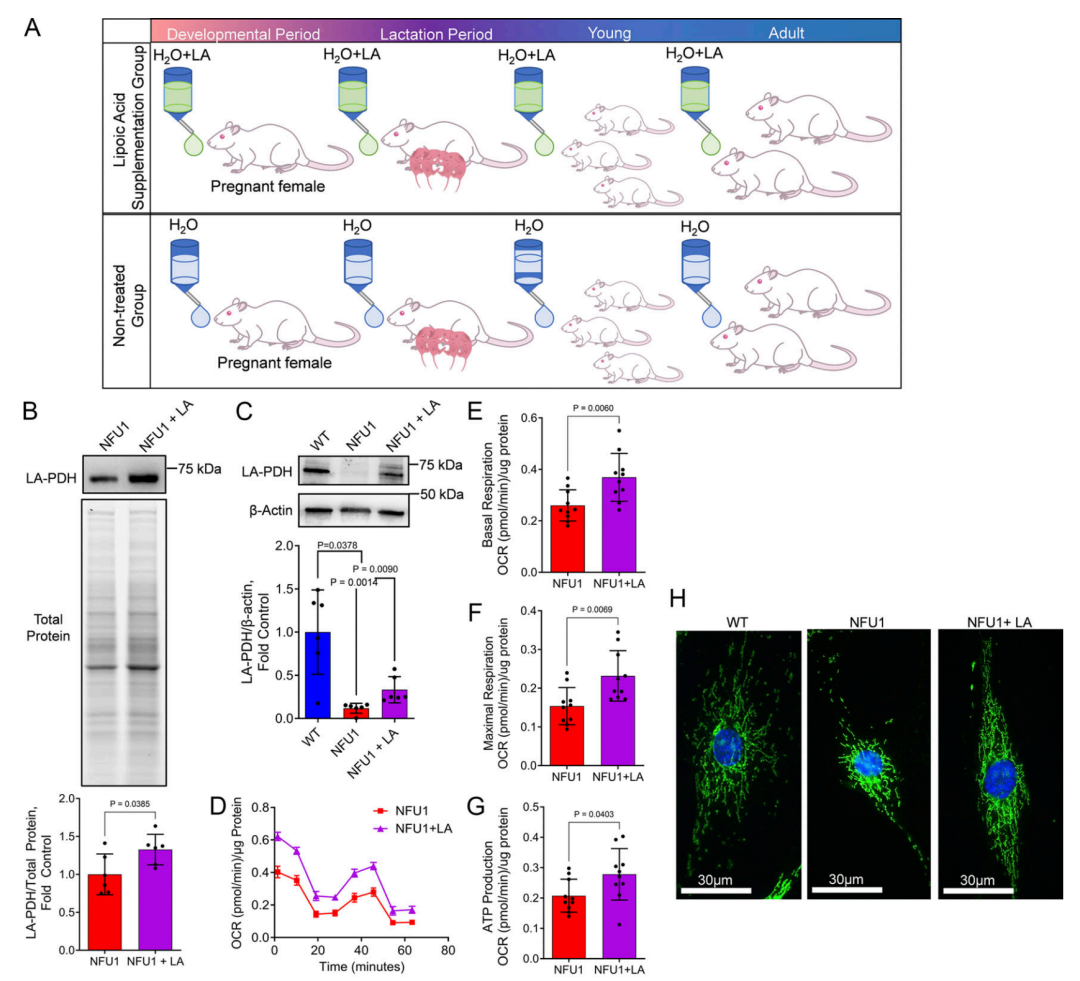
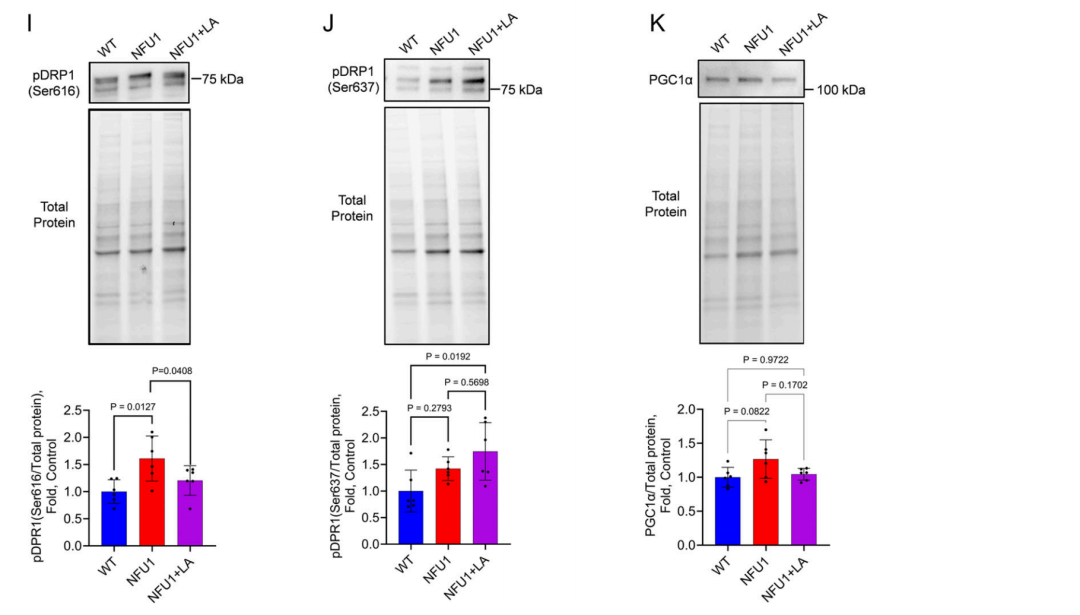
图 5. 长期补充 LA 可恢复 NFU1G206C PEC 中的线粒体功能。
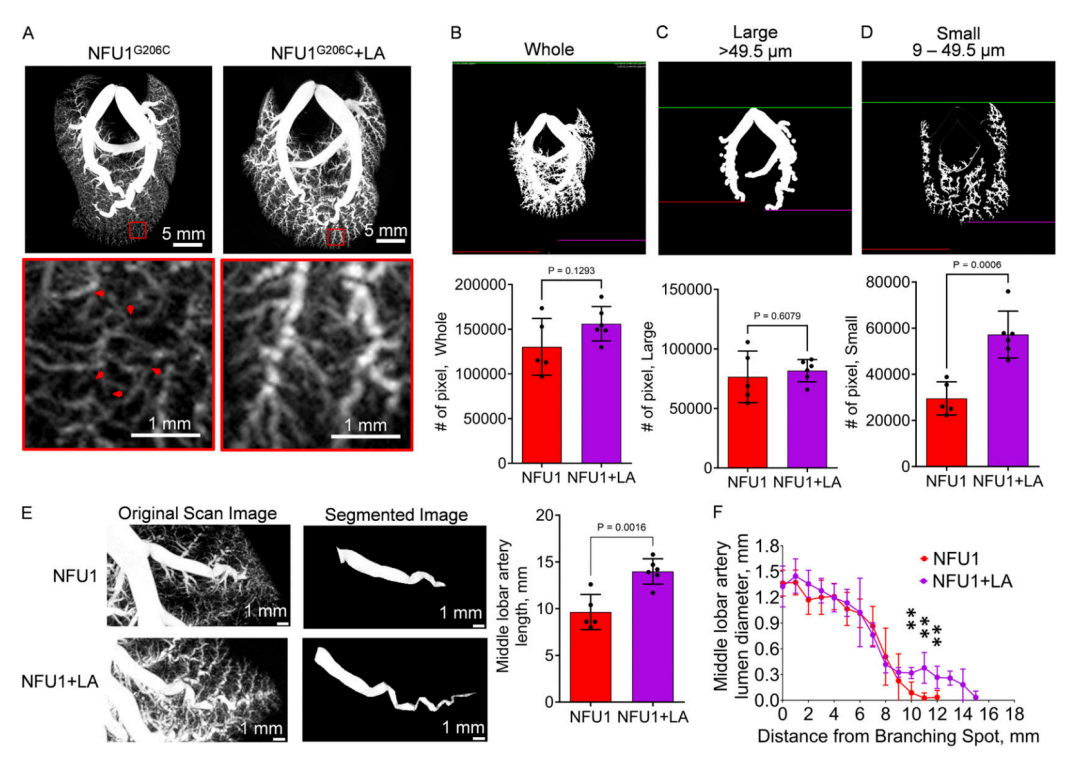
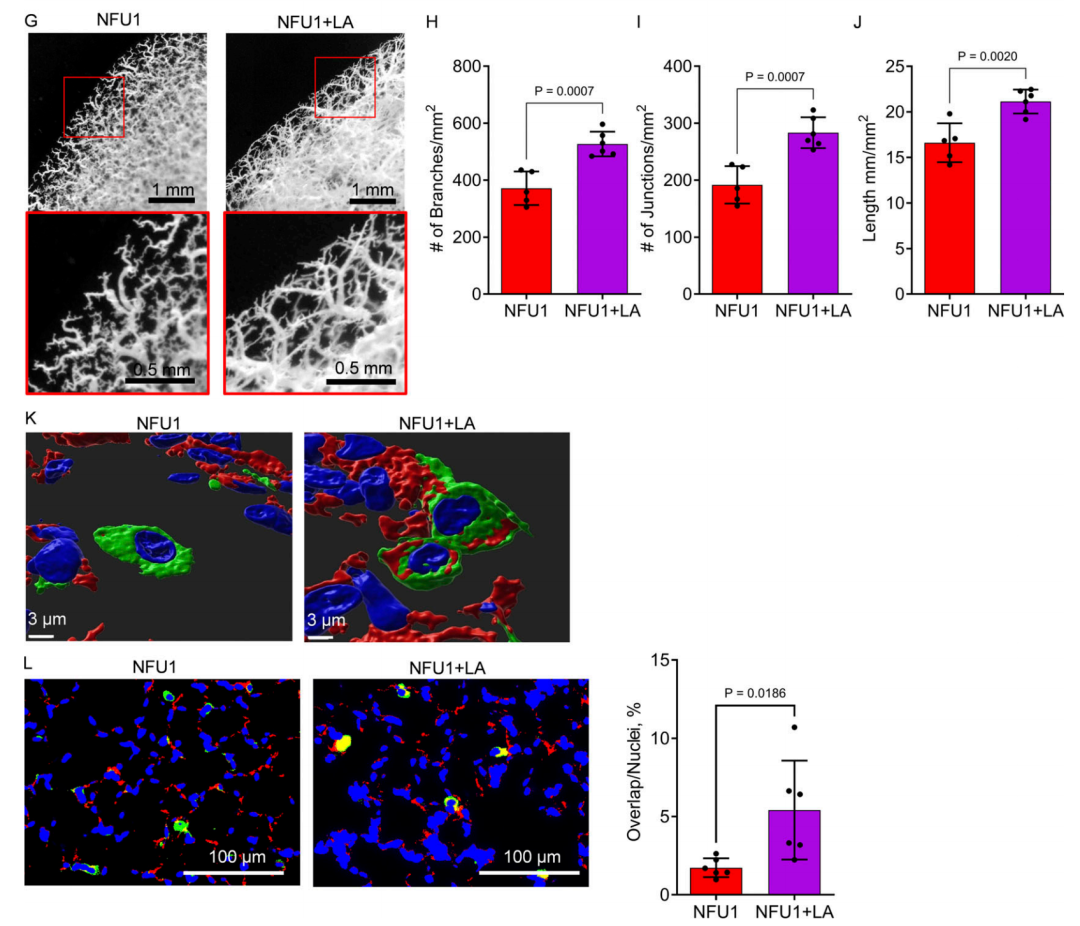
图 6. 提高 LA 生物利用度足以预防 NFU1G206C 大鼠的血管生成缺陷。
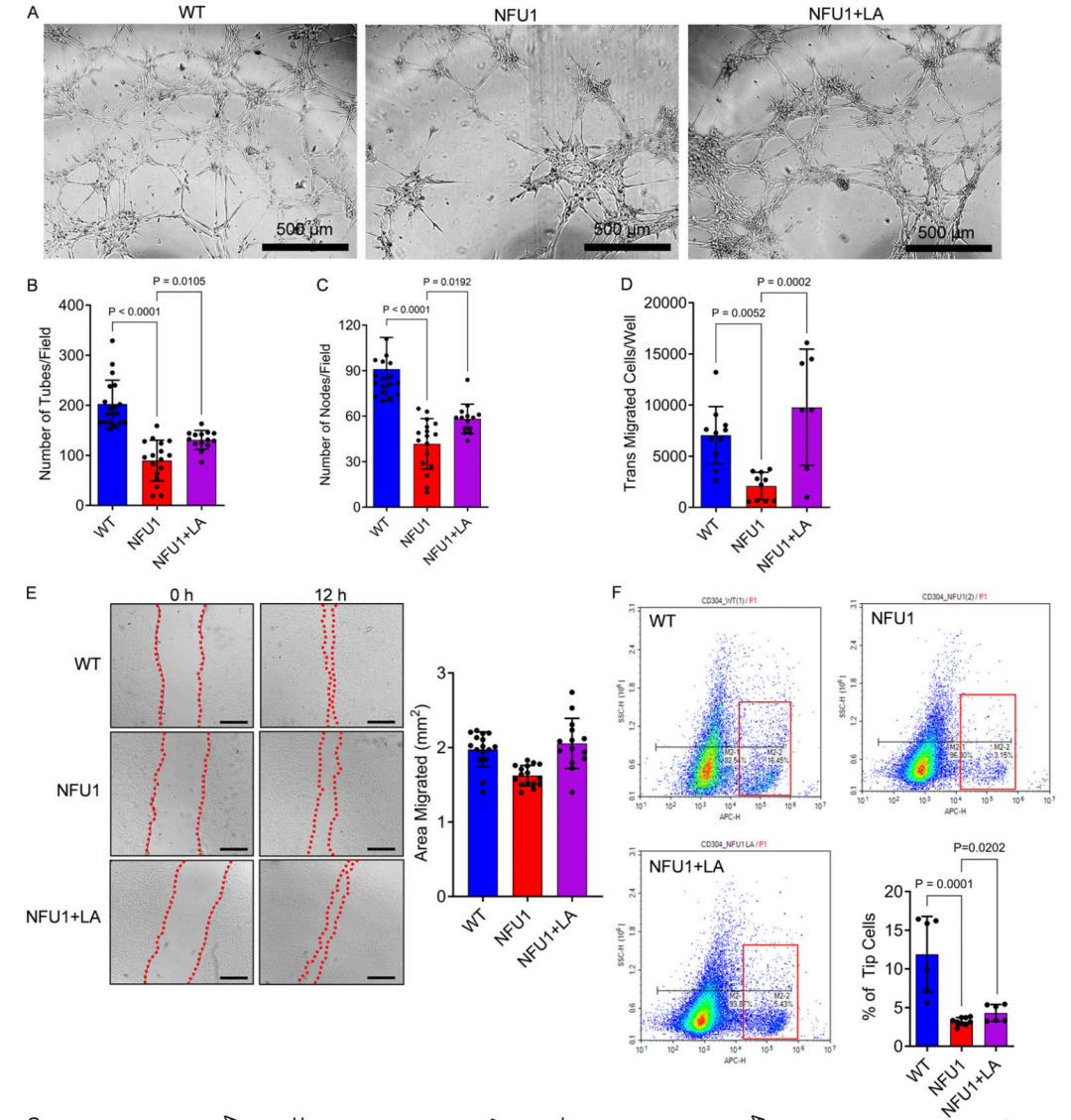
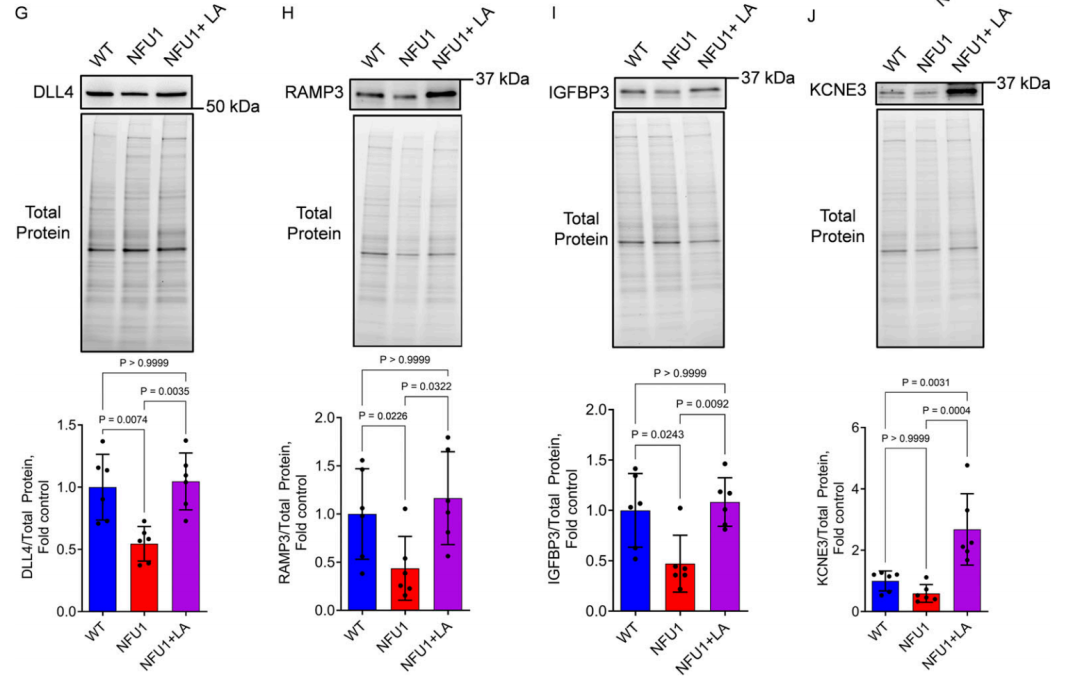
图 7.LA 恢复NFU1G206C的PEC血管生成能力。
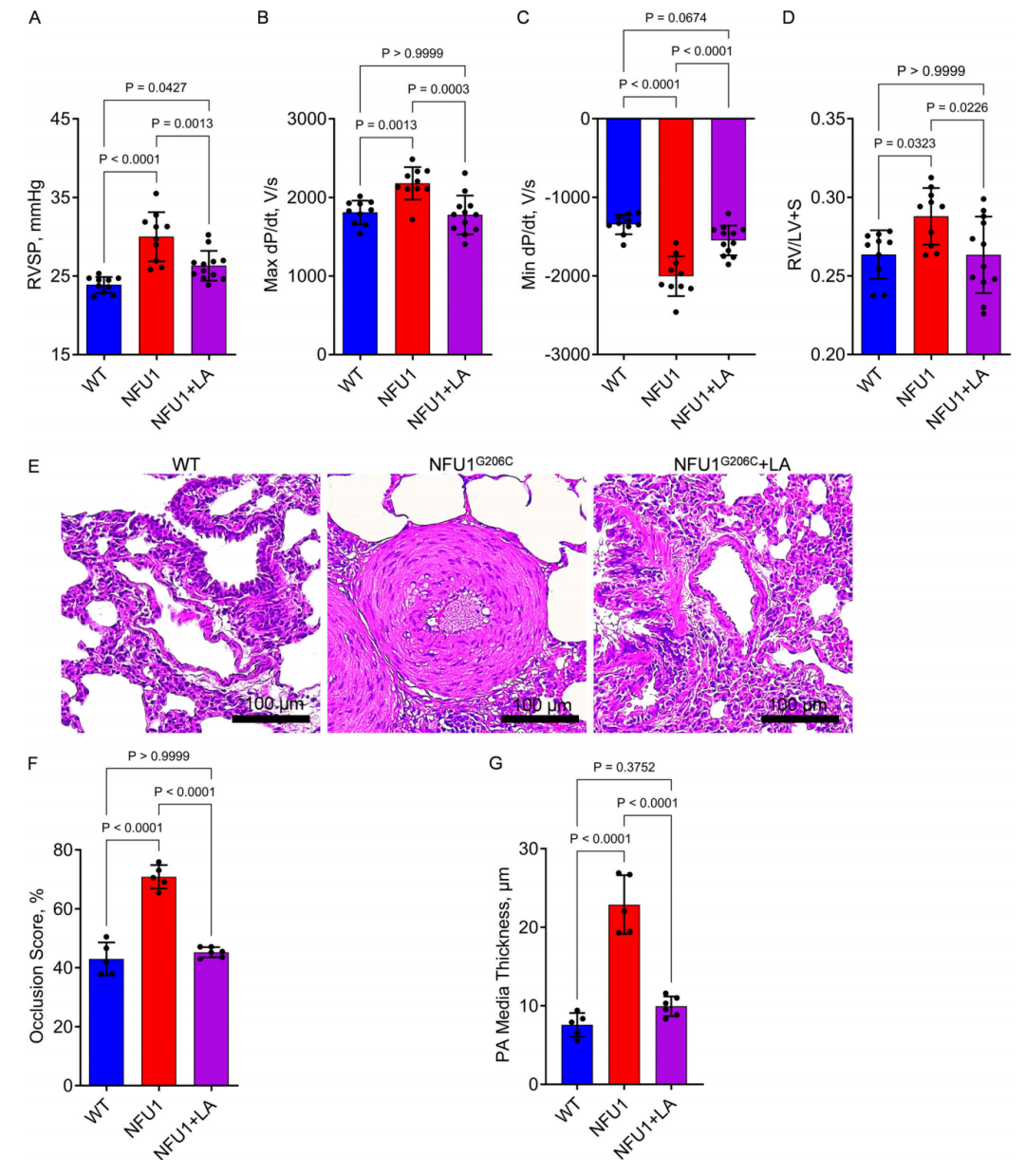
图 8. LA 补充剂可挽救NFU1G206C大鼠的PAH表型。
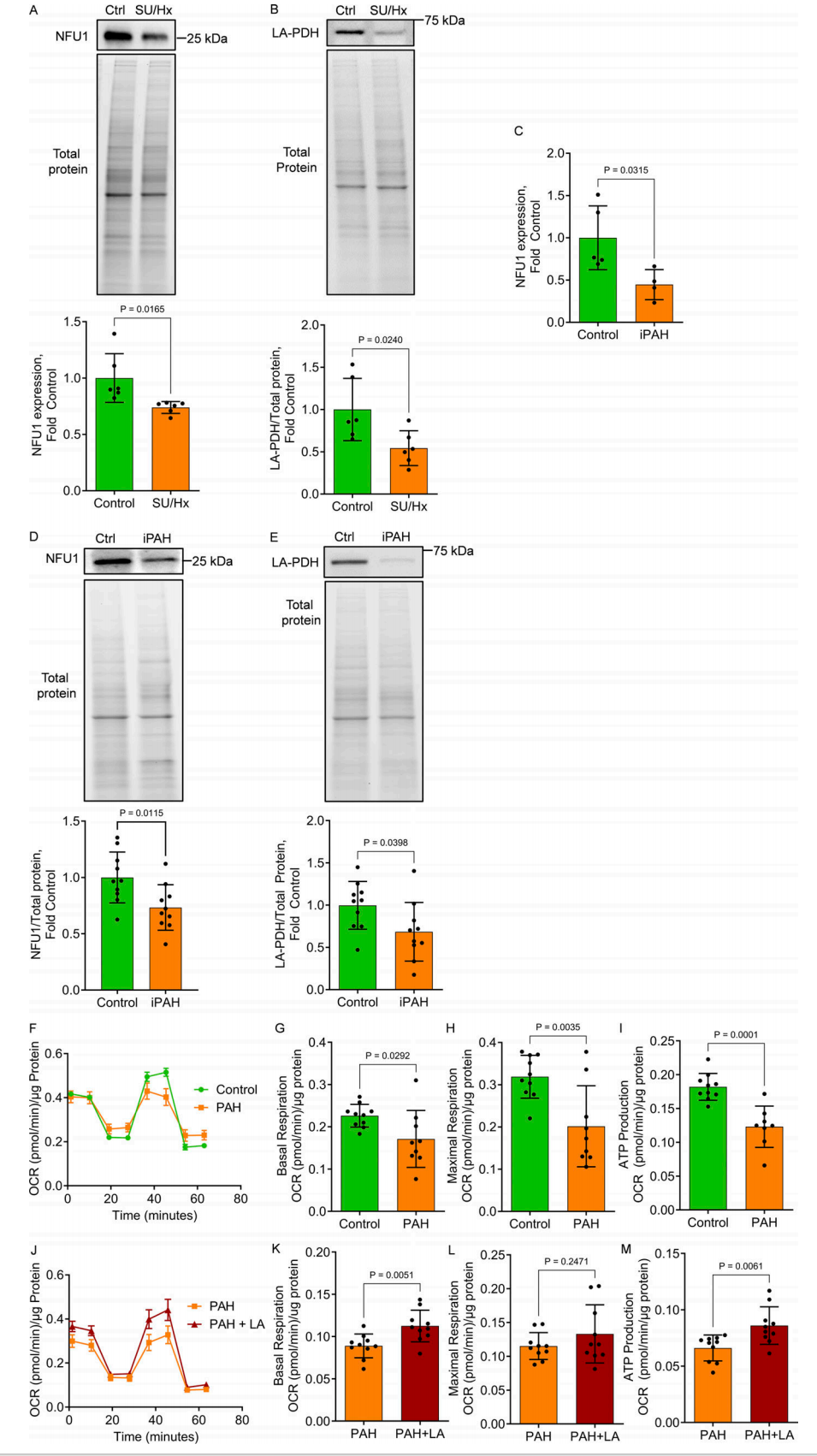
图 9. Su/Hx 大鼠模型和 iPAH 患者的 NFU1 缺乏症以及 LA 补充剂对缓解患者 PAEC 中的 MD 的保护潜力。
研究结论:
本研究旨在通过详细研究线粒体功能受损大鼠的肺血管生成,填补知识空白。与其他PAH动物模型不同,NFU1G206C模型因NFU1中的抑制突变导致原发性线粒体功能障碍(MD),进而损害多种关键线粒体酶的活性。研究表明,即使没有其他致病机制,MD也能引发自发性PAH表型。当前重点在于评估这些变化,以阐明PAH在年轻动物中的存在及其成年后的发展。此外,跟踪年龄相关的肺形态变化将有助于揭示肺血管生成逐渐受损与PAH表型严重程度之间的紧密关联。
Niihori M, James J, Varghese MV, McClain N, Lawal OS, Philip RC, Baggett BK, Goncharov DA, de Jesus Perez V, Goncharova EA, Rafikov R, Rafikova O. Mitochondria as a primary determinant of angiogenic modality in pulmonary arterial hypertension. J Exp Med. 2024 Nov 4;221(11):e20231568. doi: 10.1084/jem.20231568. Epub 2024 Sep 25. PMID: 39320470.



















