【WSPH】肺动脉高压的桥接策略
时间:2024-09-30 18:00:36 热度:37.1℃ 作者:网络


桥接策略-PH导致的RHF桥接策略的支持技术
RHF的循环支持为患有终末期和短期危及生命的RHF并伴有全身器官衰竭的PH患者提供了先进的治疗机会。然而,我们仍处于发展的早期阶段,经验来自于PH患者的病例报告或相对较小的病例系列。已经开发了许多用于RHF的急性机械循环支持装置,包括直接或间接绕过RV的方式,具有体内和体外选项。最终,选择的机械支撑类型应根据RHF涉及的机制、患者的生理需求和预期的生理效应来确定。并非所有类型的衰竭RV支持都适用于肺血管阻力增加的情况。使用绕过右心室和肺循环的体外配置应被视为生理上适当且优选的方法。这些通常包括用于气体交换的泵和膜或单独的低电阻“无泵”充氧膜。
静脉-动脉ECMO
外周静脉-动脉(VA)-ECMO是最常植入的设备,用于支持PH患者的RV衰竭。外周插管的优点是它可以在局麻下在清醒的患者床边快速植入。这种方法是首选,因为它是快速的,并且避免了作为桥接策略的一部分时由于全身麻醉和机械通气导致的血流动力学崩溃和并发症的风险。插管涉及从股静脉通过下腔静脉植入静脉插管。静脉插管的尖端位于右心房的入口处,以优化右心房引流和右心室预载减压。虽然最常见的插管是利用股静脉,但也可以使用颈内静脉和锁骨下通路。动脉插管插入对侧或同侧股动脉,其尖端定位于髂主动脉或腹主动脉。务必同时将远端灌注插管放置在股动脉中,以保护远端灌注并避免灾难性的腿部缺血。此外,对股动脉直径进行初步超声心动图测量有助于调整套管的尺寸并避免这种严重的并发症。在整个循环辅助期间应系统地监测下肢灌注(饱和度、临床检查)。将回路血流量滴定至减轻右心室负荷并恢复PH患者外周器官灌注所需的最小流量。通常,2.5–3.5L·min就足够了。VA-ECMO回路中的氧气浓度和ECMO气体扫描(流量)必须分别适应动脉血气中的氧气和二氧化碳张力水平。ECMO的主要局限性是左心室后负荷略有增加以及上半身缺乏补充氧合(“丑角综合征”)。虽然在没有急性或慢性肺部缺氧情况下不太常见,但应监测右上肢的氧饱和度或血气。此外,必须通过检查维持肱动脉或桡动脉中的脉动压力信号来确保保留肺血流。然而,由于肺动脉高压患者的氧合通常得以保留,并且左心室通常不会衰竭,因此ECMO回路导致的左心室后负荷的增加可以忽略不计。
考虑到并发症(无论是出血性、血栓栓塞性还是感染性)的显著风险,特别是在植入超过2周后,通常仅在短期内考虑使用VA-ECMO来治疗RHF。无论是作为过渡策略还是恢复策略的一部分,在所有情况下都应在ECMO植入之前预期护理轨迹。一旦建立VA-ECMO回路,应维持或增加针对PH的特定治疗,以改善内在肺血流量,特别是在恢复策略中,或者如果它们有助于维持麻烦的全身性血管麻痹,则可以在桥接策略的背景下停止使用。
一些项目建议使用中央ECMO仅作为PH序贯双肺移植或CTEPH患者动脉内膜切除术期间的心肺支持。当预计需要更长的支持并且需要动态状态时,可以使用中央插管。这种方法与较少的血栓栓塞并发症相关,但需要手术方法,无论是正中胸骨切开术还是小型右前胸廓切开术,这在很大程度上限制了其使用。
静脉-静脉ECMO和三插管ECMO
静脉-静脉(VV)-ECMO的主要适应症是为严重低氧血症和/或高碳酸血症患者提供氧合。对于RHF,它不应被视为支持患者的治疗策略,虽然它确实改善了氧合,但它不会减轻RV负荷,也不支持体循环。可以根据具体情况考虑VV-ECMO,这些具体情况是并发疾病(例如肺炎或潜在的肺实质疾病)而导致急性缺氧的PH患者,并且没有严重的RHF,以避免长时间机械通气导致RHF。另一个非常特殊的病例是由于心内右向左分流(例如通过房间隔缺损)导致的全身性低氧血症。在这种情况下,高流量VV-ECMO可能足以改善患者的氧合并增加通过右-左分流的心流量。已经提出的一种生理学上类似的替代方法是通过房间隔缺损或房间隔造口术产生的分流将VV-ECMO的流出插管推进到左心房。
使用三重插管的适应症非常有限。如果VA-ECMO发生严重的脑和心脏缺氧,由于右-左心内分流(先天性心脏缺陷或共存心内分流),可以考虑通过颈静脉引入第二个静脉插管(VAV-或VVA)-ECMO)。相比之下,如果初次植入VV-ECMO进行氧合的患者因PH而出现严重RHF,则可以建议改用VVA-ECMO。也有人建议将VAV-ECMO作为VV-ECMO或VA-ECMO的“升级版”,用于并存严重肺衰竭和心衰的患者,无论是在VA-ECMO治疗心衰期间出现肺衰竭,还是在VV-ECMO治疗肺衰竭期间出现心衰。
肺动脉至左心房ECMO(绕过高阻肺血管床的氧分流)
肺动脉至左心房(PA-LA)方法涉及在植入肺动脉的出口插管和植入左心房的返回插管之间插入氧合膜。在该装置中,不需要泵,因为血液通过系统的转移是由肺循环中的高压力直接引起的。该技术有两个主要优点。第一个优势是生理上的。该系统恢复左心室的预负荷,并确保身体上部和下部的均匀氧合。可以想象,该系统可以通过改善左心室充盈使右心室在手术前恢复,并可以训练左心室以避免与短暂性左心室功能障碍相关的术后并发症。第二个优点是无需泵,减少了血栓栓塞和出血并发症,因此比VA-ECMO的使用时间更长。我们还可以补充一点,使用该设备辅助的患者在等待移植期间可以更轻松地活动。然而,该系统的植入需要手术方法,通常是胸骨切开术,这限制了其使用。在这种情况下,PA-LAECMO最常作为VA-ECMO的转换而植入,首先将患者置于其上以迅速稳定病情。因此,PA-LA方法是对失败的PAH患者生理问题的直接生理校正,在预期ECLS时间延长时非常有用。
直接绕过RV的设备
其他右心室支持装置通过在肺动脉中放置回注插管来为右心室提供直接帮助。右心室辅助装置、ImpellaRP装置(Abiomed,马萨诸塞州,美国)或Protek导管(LivaNova,伦敦,英国)就是这种情况,它们是基于导管的微轴流泵,通过股静脉插入进入肺动脉。然而,这种策略并不是最理想的,因为人们试图“迫使”血流穿过已经高阻的肺血管床。虽然这可能会在一段时间内“帮助”失败的RV,但它在生理上并不合适,也不能解决严重PH的病理问题。所需要的是“绕过”高阻力血管床并为血液充氧,而不是试图“强行通过”高阻力肺血管系统。
哪些患者适合桥接策略?
RHF和PH患者机械循环辅助的适应症不断发展,并且随着经验的积累而逐渐增长。右心室支持装置的作用将是作为最终治疗的桥梁、恢复或肺移植的桥梁,或更罕见的是作为决策的桥梁(图2)。PH的循环辅助适应症应始终是多学科专家团队预期的明确治疗方法的一部分。
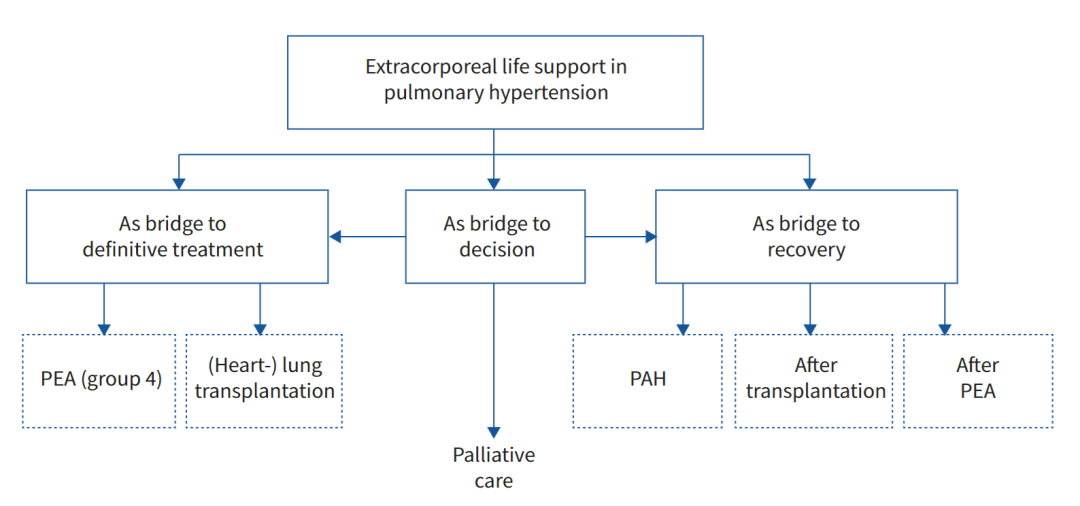
图2肺动脉高压的体外生命支持指征。PEA:肺动脉内膜切除术;PAH:肺动脉高压。
ECLS作为最终治疗的桥梁-ECLS作为肺或心肺移植的桥梁
如前所述,使用机械循环辅助作为移植的桥梁是PH患者发生RHF时最广泛使用的适应症。这种治疗方法的发展大大改善了适合肺移植的难治性RHF患者的预后。这种治疗方法的成功因移植物分配规则的随之变化而得到加强,在大多数国家,移植物分配规则的改变使得优先考虑这些患者,从而降低接受移植前因循环辅助而出现并发症的风险。许多临床病例或病例系列都强调了ECLS作为PH患者移植桥梁的有益作用,所有这些都证实了ECLS对肺移植后结果的潜在益处。在这种情况下,迄今为止唯一确定的适应症是对已经在肺移植名单上的难治性RHF患者引入ECLS,该患者对单独的药物治疗没有反应。
ECLS作为决策的桥梁
桥接更具挑战性的适应症涉及严重RHF患者,他们是尚未接受肺移植评估的潜在候选者。如果患者没有明确的肺移植禁忌症,并且没有合并症或结缔组织病等相关疾病,则ECMO作为决策桥梁的指征应被视为合理,而这需要在ECMO下不可行的额外检查。另一种证明使用VA-ECMO作为决策桥梁的情况是,在植入ECMO时患有严重器官衰竭的患者,其移植项目的条件是在循环辅助后的最初几天内器官恢复。最好让患者(和家人)有机会讨论和考虑肺移植的概念,并且护理团队充分了解患者对先进治疗的愿望。如果经过审查后发现患者不适合移植,医疗团队和患者/家属必须解决姑息治疗团队应该预见到的非常困难的护理情况。
ECLS作为CTEPH动脉内膜切除术的桥梁
严重的右心室衰竭很少会显示近端CTEPH,可以通过手术治疗。在这些特殊情况下,在面临迫在眉睫的死亡风险时提供循环辅助可以被讨论为紧急肺动脉内膜切除术和术后早期恢复的桥梁。此外,这种方法可以安全地运送到手术转诊中心。
ECLS作为恢复的桥梁-ECLS作为PAH康复的桥梁
对PH患者使用过渡至恢复循环支持仍然是一种特殊情况。成功的机会是有限的,只有满足一定数量的条件才能设想。这种治疗策略通常只能考虑用于未接受任何PAH特异性治疗且处于右心室功能暂时恶化(例如妊娠)的可逆情况的患者。只有在这些条件下,恢复的机会是可以接受的,在特殊情况下允许停止循环辅助而不需要进行肺移植。
ECLS作为肺动脉内膜切除术后恢复的桥梁
最近的一项研究表明,中央VA-ECMO作为一种桥接策略对于在动脉内膜切除术后遇到脱机体外循环困难的CTEPH患者具有潜在的益处。然而,风险在决定是否使用该策略时,必须牢记与VA-ECMO相关的因素。因此,这种选择应仅限于与RHF相关的术后即刻并发症风险较高的患者。
ECLS作为肺移植后恢复的桥梁
为PH和晚期RHF患者进行肺移植的经验表明,早期VA-ECMO作为术后即刻恢复的桥梁,可降低原发性移植物功能障碍的风险,并限制心肺移植(HLT)的适应症。桥接策略的绝对禁忌症以及姑息治疗在循环辅助中的作用桥接策略有多种类型的禁忌症。如前所述,对PH患者引入循环辅助必须始终成为明确治疗计划的一部分。如果没有可能的移植或恢复机会,在任何情况下都不应插入RV辅助装置。使用循环辅助的其他禁忌症包括血管通路问题或并发症风险过高,特别是出血。严重体循环的发展,尤其是艾森曼格综合征患者,与移植过程中较高的出血风险相关,术前长时间使用ECMO会显著增加出血风险。正如所讨论的,如果最初对循环辅助的潜在益处有疑问,可以根据具体情况启动支持,作为做出决定的桥梁,前提是患者和家属已事先被告知失败的风险,并在预期了会促使过程中断和姑息治疗启动的参数之后。因此,在尽管有循环辅助但仍不受控制的终末器官衰竭或出血或感染并发症不受控制的情况下,也应考虑限制ECMO治疗。
是否仍有循环支持替代干预措施(房间隔切开术、Potts分流术)的指征?房间隔造口术可以通过降低右心室前负荷和恢复左心室前负荷来增强净心脏功能。虽然血液饱和度降低,导致氧含量减少,但最终的结果是血流量短暂增加,但全身氧输送量减少。理论上,右心室前负荷的降低可能导致右心室壁张力降低,从而减少右心室后负荷和心肌耗氧量,改善冠脉血流。房间隔造口术只能作为选择性手术进行。当患者血流动力学不稳定或右心房压力显著升高时,发病率和死亡率会很高。因此,我们建议不要进行紧急房间隔造口术。
当肺动脉压力超过循环压力时,手术或血管内创建Potts分流器(将左肺动脉连接到降主动脉)可能会减少RV后负荷。一些早期数据表明这可能对儿童有益。然而,它仍然是一个具有高发病率和死亡率的危险手术。仅应在稳定患者中考虑将其作为评估安全性和有效性的系统研究的一部分。我们建议不要在不稳定的PH患者中建立Potts分流器或作为移植的桥梁。
参考文献:
Savale L, Benazzo A, Corris P, Keshavjee S, Levine DJ, Mercier O, Davis RD, Granton JT. Transplantation, bridging, and support technologies in pulmonary hypertension. Eur Respir J. 2024 Aug 29:2401193. doi: 10.1183/13993003.01193-2024. Epub ahead of print. PMID: 39209471.


