3000+例III类BRAF突变肿瘤基因组图谱研究揭示潜在治疗策略:结合病例分析
时间:2024-11-10 17:00:14 热度:37.1℃ 作者:网络
激酶受损的 III 类 BRAF 突变作为潜在的预后因素和治疗靶点,最近受到关注。III 类 BRAF 突变在通路激活机制和治疗敏感性方面与 I 类和 II 类突变不同。大型真实世界队列的肿瘤基因组图谱分析是进一步表征肿瘤相关分子事件和治疗敏感性的好机会。然而,BRAF III 类突变的肿瘤尚无此类数据。在 376302 例患者中探索了 BRAF III 类突变的泛癌种基因组图谱。患者通过 FoundationOne® 或 FoundationOne®CDx 对福尔马林固定石蜡包埋组织活检样本进行了全面基因组测序。另外,呈现了 2 例对抗 EGFR 治疗表现出显著反应的 BRAF III 类突变患者病例。分析显示,BRAF III 类突变可能与 RAF1、NRAS 和 HRAS 变异共存,很少与 KRAS 突变共存。此外,预测抗 EGFR 药物耐药的变异在 BRAF III 类突变肿瘤中发生率显著较低,这非常重要,因为抗 EGFR 疗法是这些肿瘤的潜在靶向治疗选择。本研究表明,BRAF III 类突变肿瘤中的致癌变异存在异质性相互作用,这对癌症发生的分子机制具有重要意义,同时揭示了潜在的治疗敏感性。
BRAF III类(BRAF vIII)突变肿瘤包括一组具有显著基因组异质性的新亚群。
BRAF vIII突变肿瘤可能对抗EGFR治疗敏感。
预测抗EGFR药物耐药的变异在BRAF vIII突变肿瘤中发生率显著较低。
治疗选择有限的罕见肿瘤应筛查BRAF vIII突变,因为可能获益于抗EGFR药物。
研究背景
BRAF 是癌症中最常见的突变基因之一。大多数 BRAF 突变发生在热点 V600 密码子处,导致丝裂原活化蛋白激酶(MAPK)通路激活。许多研究探索了靶向治疗在 BRAF 突变患者中的潜力。BRAF 密码子 V600 突变已得到全面研究,随机临床试验显示 BRAF、MEK 抑制剂单独或联合治疗黑色素瘤以及其他肿瘤的疗效超过 50%,而在 BRAF 和 MEK 抑制剂中加入抗 EGFR 药物西妥昔单抗在 BRAF V600E 突变结直肠癌中带来了显著的临床获益。
除 V600 密码子突变外,其他 BRAF 突变在靶向治疗和临床决策的背景下研究程度要小得多。Wan 等人表明,密码子 V600 以外的 BRAF 突变也可能是致癌驱动因素,临床前研究显示了不同的致癌机制,这需要不同的治疗方法。最近,在导致激酶活性受损的不同 BRAF 突变中,发现了二聚化需求和 RAS 依赖性的差异。
不同 BRAF 突变的总体差异导致 BRAF 突变分为 3 种主要亚型:I 类、II 类和 III 类。野生型 BRAF 依赖于 RAS 活性,需要二聚化以进行信号转导。I 类 BRAF 突变由密码子 V600 突变组成,不依赖 RAS,以松散二聚体的形式发出信号。II 类 BRAF 突变发生在 V600 密码子之外,激酶活性增加,具有组成型活性,不依赖 RAS 信号传导。II 类 BRAF 突变需要严格的二聚化才能进行信号传导,这使它们与 V600 突变区分开来。RAS 非依赖性导致携带 I 类和 II 类 BRAF 突变的肿瘤对抗 EGFR 单药治疗耐药。与 I 类和 II 类 BRAF 突变相比,III 类 BRAF 突变导致激酶死亡或激酶活性受损的 BRAF 蛋白表达。III 类 BRAF 突变对 RAS 具有更高的亲和力,与 CRAF 形成二聚体。这些突变的 CRAF 信号转导增加,激活取决于上游 RAS 活性。与 BRAF III 类突变肿瘤不同,携带 I 类和 II 类突变的肿瘤 对 BRAF 和 MEK 抑制剂敏感。
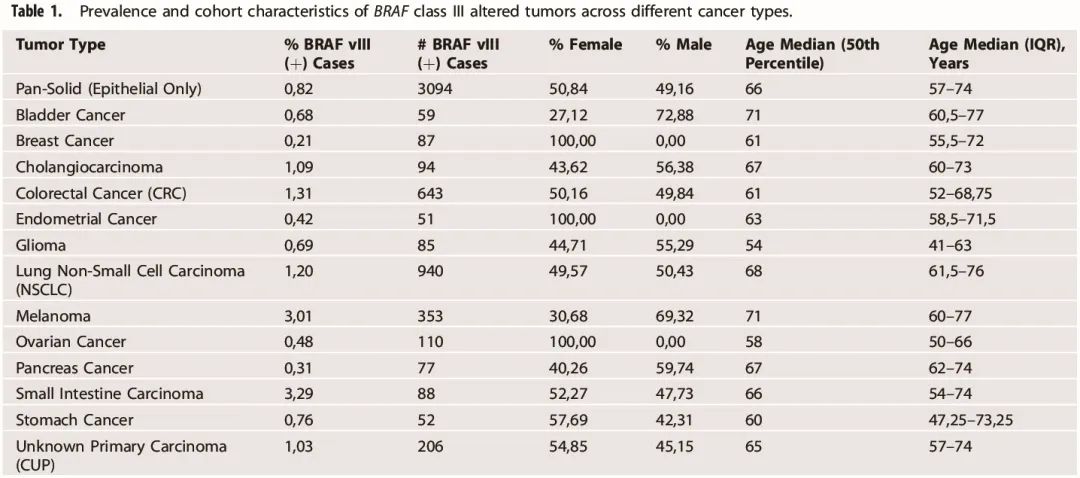
表1
与 I 类和 II 类突变相比,III 类 BRAF 突变导致 ERK 激活较弱。不太明显的 ERK 激活导致 MAPK 通路中基本负反馈信号转导受损。与野生型 BRAF 相比,从 ERK 到受体酪氨酸激酶(如 EGFR)和 RAS 的负反馈抑制不足导致 MAPK 信号转导活性增加,从而促进肿瘤发生。这种机制提示激酶受损或激酶死亡的 BRAF 突变放大了上游信号传导(图 1b)。因此,在 III 类 BRAF 突变中,由于负反馈信号被破坏,与下游成分相比,靶向上游效应分子可能更有效。
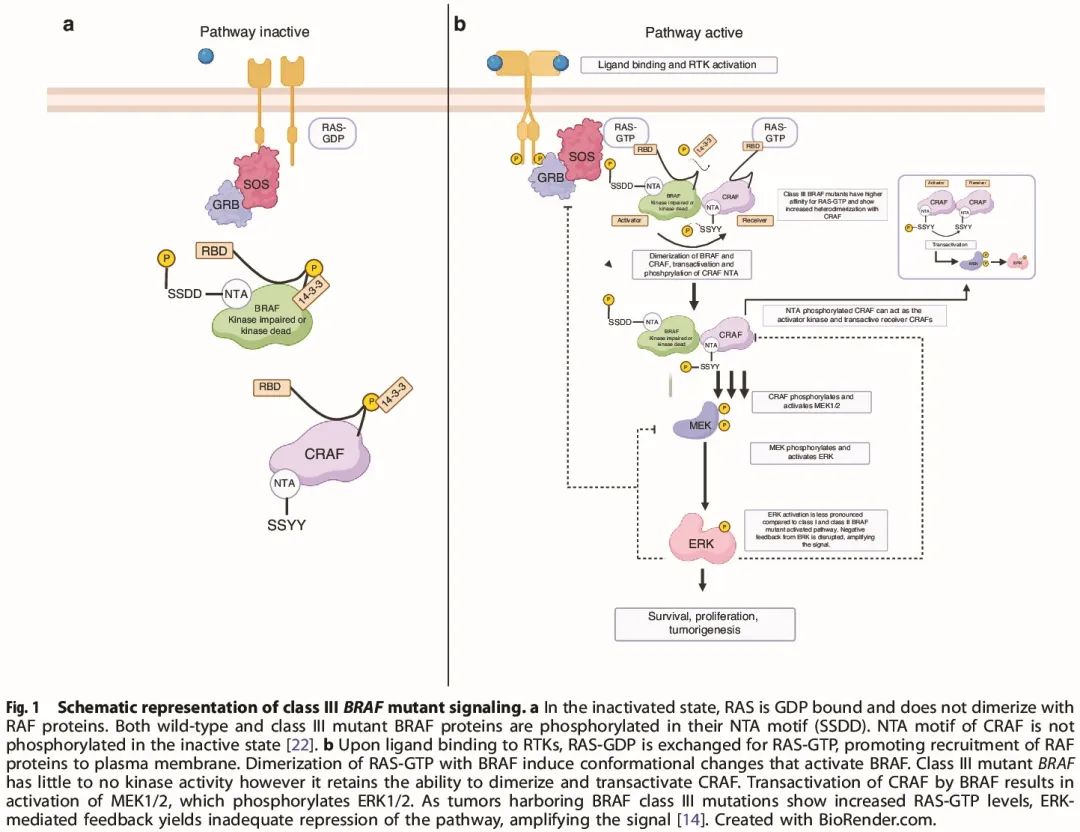
图1
虽然 BRAF III 类突变的激酶活性很低或没有激酶活性,但它们能够通过异二聚化反式激活 CRAF。RAF 蛋白需要磷酸化其 N 末端酸性(NTA)基序来反式激活其他 RAF 分子。在正常细胞中,BRAF NTA 基序被组成型磷酸化(称为激活激酶),而 CRAF 的 NTA 基序仅在被其他 RAF 原聚体(受体激酶)反式激活后才被磷酸化(图 1a)。因此,III 类 BRAF 突变二聚化和反式激活 CRAF,这反过来又可以进一步促进可及 RAF 蛋白的激活,以及激活 MEK1/2(图 1b)。
到目前为止,探索携带 III 类 BRAF 突变的患者对抗 EGFR 药物反应的研究一直受到样本量和缺乏识别这些肿瘤的测序数据的限制。在一项临床研究中,肿瘤具有 BRAF III 类突变的结直肠癌患者获益于抗 EGFR 药物的使用,II 类 BRAF 突变的患者则没有改善。一部分BRAF III类突变患者对抗EGFR治疗无反应,这可能是由于肿瘤异质性以及存在其他可能导致抗EGFR药物耐药的基因变异。在预后方面,几项研究表明,携带 BRAF III 类突变的患者预后优于携带 I 类或 II 类突变的患者。一项纳入9643例转移性CRC患者的分析显示,在携带V600E以外的BRAF突变的患者中观察到良好的预后。BRAF 密码子 594 和 596 突变通常会导致激酶活性受损,已被证明是黑色素瘤患者的预后较好因素。另一方面,在一项泛癌种研究中,与 I 类 BRAF 突变患者相比,II 类或 III 类 BRAF 突变患者的预后较差(尽管该研究未区分 II 类和 III 类突变)。
这些发现提示,不同类别的 BRAF 突变具有不同的临床意义,可能需要不同的临床管理。我们探索了共 376302 例肿瘤,发现 0.82% 的样本携带 BRAF III 类突变。总体而言,在所有肿瘤类型中,BRAF III 类突变很少与预测抗 EGFR 疗法耐药的基因变异(如 MET 和 ERBB2 扩增)共存。最后,我们呈现了两名从基于西妥昔单抗的治疗中获益的晚期结直肠癌和胆管癌患者。我们利用 Foundation Medicine 的大型基因组数据库对 BRAF III 类突变进行了泛癌种研究,揭示了基因组图谱并评估了下游治疗意义。
研究结果
队列特征
泛实体瘤队列包含 376302 例患者,对其进行 III 类 BRAF 突变分析,发现 0.82%(3094)的患者携带 III 类 BRAF 突变(表 1,图 2a)。男性与女性患者的比例为 51:49,泛实体瘤队列的中位年龄为 66 岁。
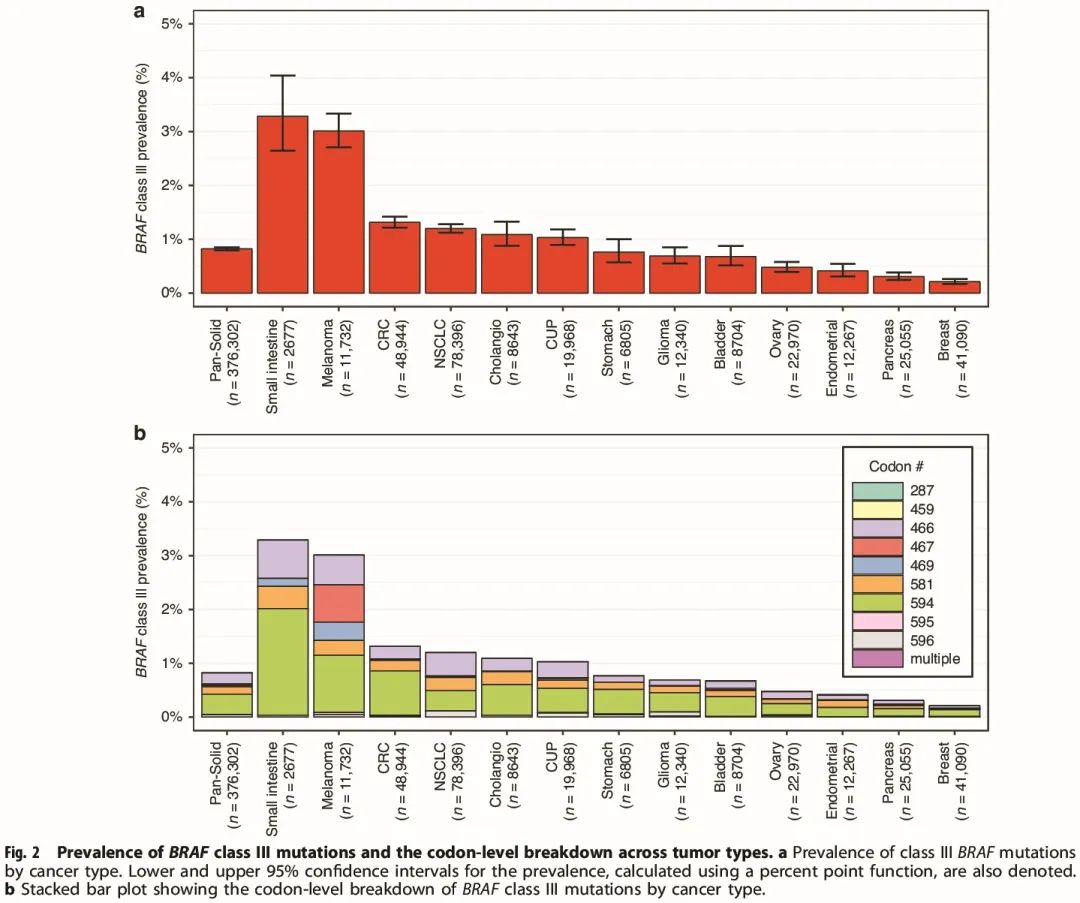
图2
分析了泛实体瘤队列和 13 种实体瘤类型中 BRAF III 类突变的发生率以及涉及的密码子(图 2)。在低肿瘤突变负荷(TMB)队列中进行了额外的分析,以说明潜在的乘客突变。BRAF III 类突变发生率最高的是小肠癌(n = 2677),其中 3.26% 的患者携带 BRAF III 类突变。其次是黑色素瘤(3%,n = 11732)、结直肠癌(1.3%,n = 48944)和非小细胞肺癌(1.2%,n = 78396)。BRAF III 类突变在子宫内膜癌(0.4%,n = 12287)、胰腺癌(0.3%,n = 25055)和乳腺癌(0.2%,n = 41090)中最少见。
分析改变密码子的频率,发现密码子 594 频率最高(0.38%,n = 299591)(图 2b)。在多种肿瘤类型中,密码子 594 在 BRAF III 类突变肿瘤中最常发生改变,除了在 NSCLC 中密码子 466 突变更常见(0.43%,n = 78396)。
BRAF III类突变肿瘤的基因组图谱
为了更好地了解 BRAF III 类突变肿瘤的突变谱,在所有实体瘤中,探索了 BRAF III 类突变患者的共突变图谱和其他生物标志物模式(图 3)。还探索了 TMB 低、BRAF III 类突变的肿瘤的共突变图谱,以说明潜在的乘客突变状态。我们发现,与没有 BRAF III 类突变的样本相比,具有 BRAF III 类突变的患者富集了 NF1 失活变异(比值比,OR = 2.8,p < 10-5)。在 NF1 之后,还发现 STK11 和 KEAP1 突变在 BRAF III 类突变肿瘤中富集。其他 RAS 通路改变,如 HRAS、NRAS 和 RAF1 激活变异,也在 BRAF III 类突变队列中富集,而 KRAS 激活变异与 BRAF III 类突变互斥(图 3)。EGFR 变异以及 11q13(CCND1、FGF3、FGF4、FGF19)扩增也与 BRAF III 类突变互斥。在平衡队列中,各种其他驱动基因(如 ALK 和 ERBB2)变异与 BRAF III 类突变互斥(图 3)。
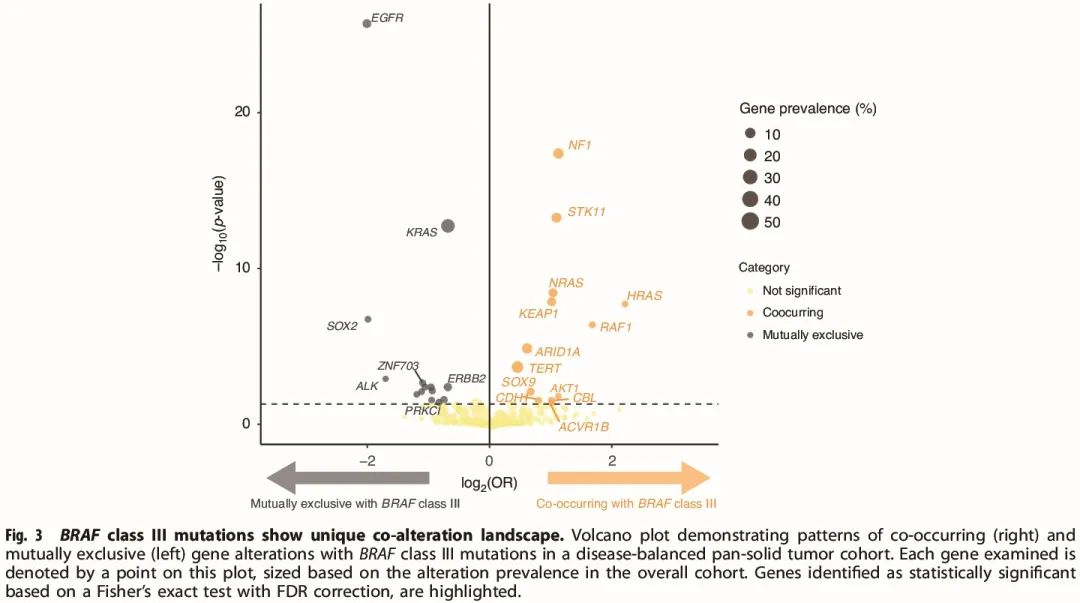
图3
BRAF III类突变肿瘤的共突变图谱
接下来,我们对共突变图谱进行了详细分析,在胆管癌、结直肠癌、黑色素瘤和非小细胞肺癌中识别经常与 BRAF III 类突变共存或互斥的基因(图 4a-d)。在胆管癌中,ARID1A 和 SMAD4 变异显著富集,而 FGFR2 变异与 BRAF III 类突变互斥。
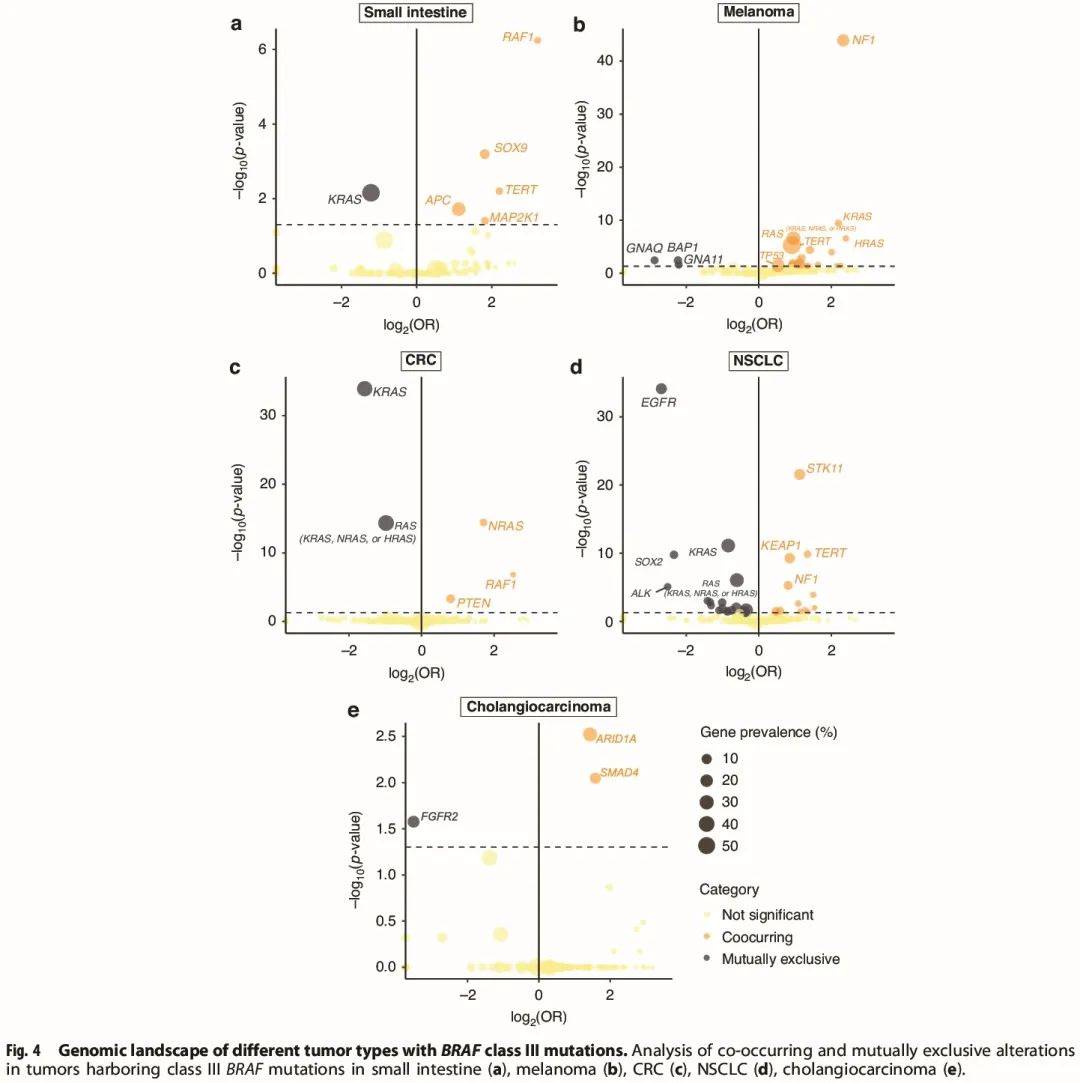
图4
在结直肠癌中,PTEN、CRAF 和 NRAS 变异在 BRAF III 类突变患者中富集,而 KRAS 变异与 BRAF III 类突变互斥。在黑色素瘤中,NF1 变异在 BRAF III 类突变患者中显著富集。与其他实体瘤类型相比,黑色素瘤队列中 KRAS 变异与 BRAF III 类突变共存。其他 RAS 通路成员,如 HRAS 变异,也在 BRAF III 类突变黑色素瘤队列中富集。在非小细胞肺癌队列中,STK11、KEAP1、NF1 和 TERT 等基因变异富集。在小肠癌队列中,CRAF 变异以及 SOX9、APC、TERT 和 MAP2K1 变异与 BRAF III 类突变显著共存,而 KRAS 变异与 BRAF III 类突变互斥。
EGFR 抑制剂(EGFRi)的常见耐药机制包括 EGFR T790M 以及 EGFR、MET 和 ERBB2 扩增(Amp)。除此之外,EGFRi 的潜在耐药机制包括 PIK3CA 致病性变异以及其他 BRAF 变异(不包括 vIII 改变)。
此外,还研究了预测抗 EGFR 药物耐药的一些变异的模式(表 2)。总体而言,在所有肿瘤类型中,BRAF III 类突变通常与预测抗 EGFR 治疗耐药的基因变异互斥,并具有额外的肿瘤类型特异性模式。在结直肠癌中,预测抗 EGFR 治疗耐药性的基因变异与 BRAF III 类突变互斥。在 NSCLC 中,潜在的 EGFR 抑制剂耐药机制与 BRAF III 类突变互斥,EGFR T790M 突变和 EGFR、MET、ERBB2 扩增与 BRAF III 类突变无显著相关性。
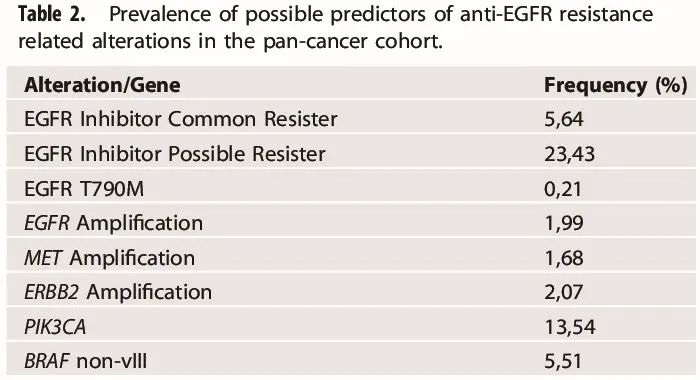
表2
BRAF III类突变肿瘤中免疫治疗相关生物标志物的模式
分析了免疫治疗相关生物标志物(包括 TMB 和微卫星不稳定性)与 BRAF III 类突变的相关性(图 5)。在每种肿瘤类型中,BRAF III 类突变患者的TMB 评分与该肿瘤类型的中位 TMB 一致,除了黑色素瘤。携带 BRAF III 类突变的黑色素瘤样本具有较高的中位 TMB(图 5a)。在每种肿瘤类型中,BRAF III 类突变患者的微卫星不稳定性发生率与该肿瘤类型总体情况一致,除了胰腺癌。微卫星不稳定性在携带 BRAF III 类突变的胰腺肿瘤中富集(图 5b)。
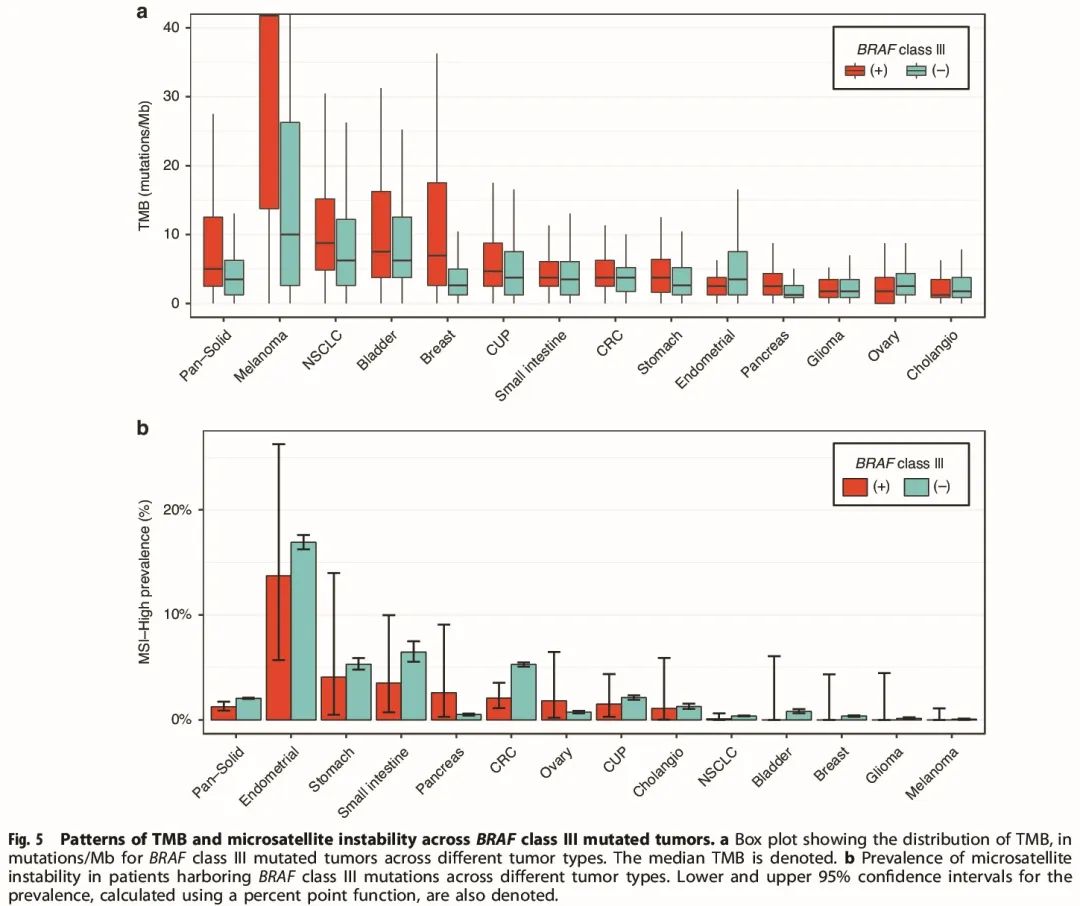
图5
病 例
病例1
第一位患者是一名 68 岁女性,2018 年被诊断为非转移性横结肠癌(图 6a)。根据第 8 版 TNM 分期系统,患者接受了 pT4 N1 M0 腺癌切除术。她接受了 XELOX(卡培他滨加奥沙利铂)辅助化疗。在 6 个疗程的辅助化疗后,开始随访。在第一次对照期间,发现 2 个新的肺转移灶。一个病灶进行了手术切除,另一个进行了立体定向放射治疗。局部治疗后,开始 FOLFIRI(氟尿嘧啶、亚叶酸钙和伊立替康)+西妥昔单抗作为转移性一线治疗方案。由于化疗相关不良反应(腹泻、疲劳、感染),患者拒绝进一步化疗,2019 年收治入我院寻求第二意见。我们建议进行全面基因组测序(CGP);之前,仅对原发性肿瘤组织进行 KRAS 和 NRAS 热点检测。
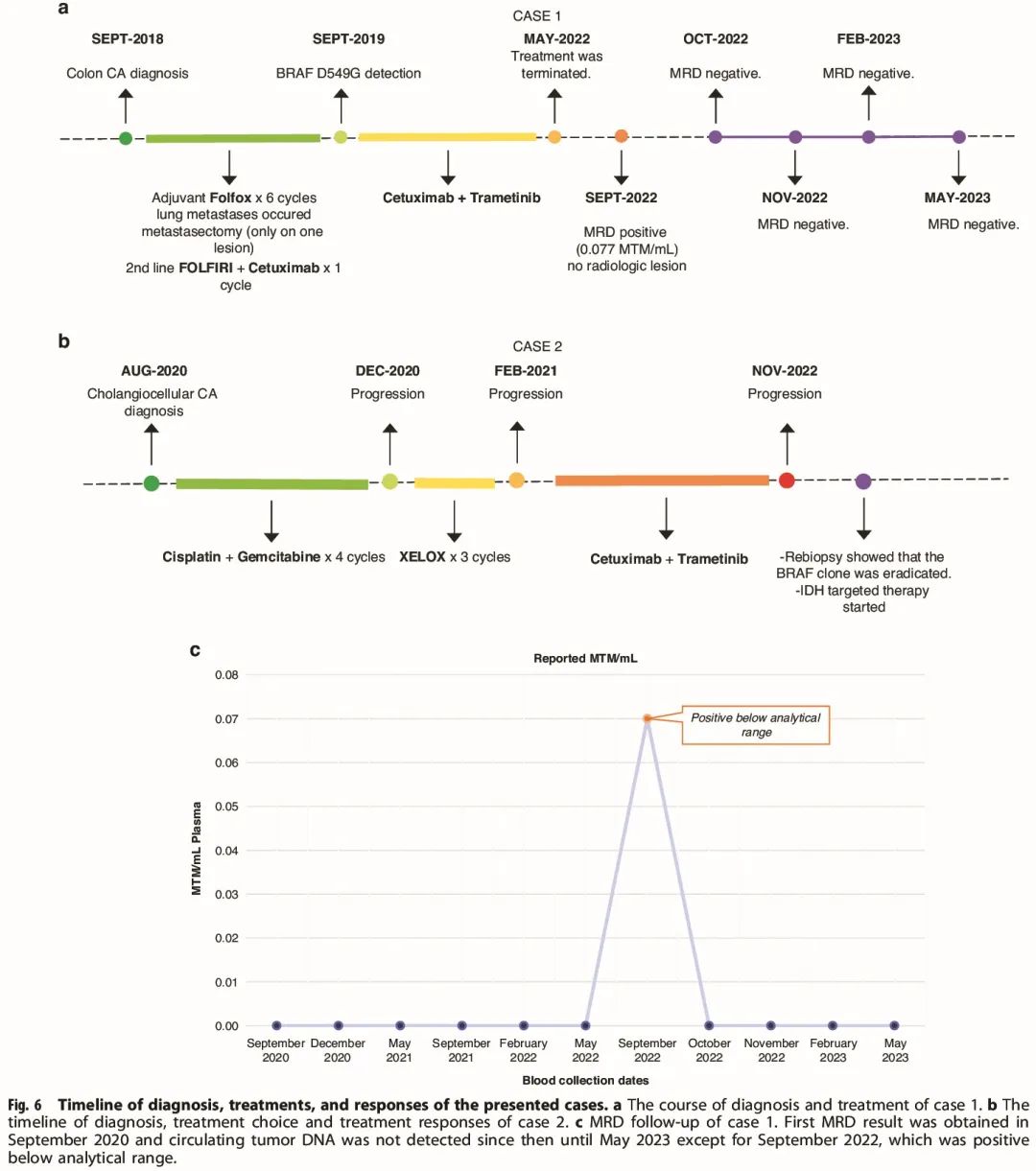
图6
对转移性肿瘤组织进行 CGP(FoundationOne®CDx)。患者微卫星稳定,TMB 为 4 mut/Mb。在转移性组织中检测到以下突变:BRAF D594G(变异丰度 [VAF]:9.4%),TP53 剪接位点 994-40_994-2del39(VAF:6.3%),APC R876*,Q1328*(VAF:10.5%, 5.0%),FBXW7 R689W(VAF:8.4%)和 CTNNB1 N426D(VAF:2.1%,亚克隆)。经过虚拟分子肿瘤委员会讨论,由于患者携带 III 类 BRAF D594G 突变,治疗改为西妥昔单抗加曲美替尼。
在随访期间,每 3 个月进行一次影像学检查,6 个月后达到影像学完全缓解。1 年后进行个性化基于循环肿瘤(ct)DNA 的微小残留病检测(Signatera TM)。在 6 次 MRD 结果为阴性且影像学完全缓解约 2 年后,患者要求进行无治疗随访。目前,她按照她的要求没有接受任何治疗,并且定期 PET 扫描和 MRD 检测显示没有疾病(图 6b)。
病例2
患者 2 是一名 50 岁女性,2020 年 8 月被诊断为肝内胆管细胞癌(图 6c)。基于影像学结果,肿瘤无法手术。胆道支架置入术后,她接受了顺铂加吉西他滨治疗。4 个周期的顺铂吉西他滨治疗后疾病进展,开始 XELOX(卡培他滨 + 奥沙利铂)方案。3 个周期后发现进展。2021 年 2 月,收治入我们精准癌症中心。对原发部位肿瘤进行 CGP(FoundationOne®CDx)。无法确定微卫星稳定性和 TMB。检测到以下基因变异:BRAF F595L(VAF 8.5%)和 IDH2 R172W(VAF 8.3%)。由于检测到 BRAF III 级改变,她接受了西妥昔单抗(500 mg/m2,每两周一次)加曲美替尼(每日 1 mg)。曲美替尼在 6 个月后因不良反应(虚弱、皮肤毒性)停药,继续接受西妥昔单抗单药治疗。3 个月和 6 个月后进行第一次和第二次对照,达到客观缓解。患者的体能状态得到改善(ECOG 1 至 0)。2022 年 10 月进行了最后一次对照,观察到病灶增大约 20%。建议她进行重新活检和 CGP。在第二次 CGP 中,检测到 IDH2 R172W(VAF 7.5%)和 TP53 剪接位点 994-1 G > A(VAF 1.4%)突变。最重要的发现是,不存在之前 CGP 检测到的 BRAF III 类突变。她继续接受西妥昔单抗治疗,并正在接受局部治疗方案评估,例如消融、手术和立体定向放疗。还考虑恩西地平与西妥昔单抗联合使用。
讨 论
本研究探索了携带 BRAF III 类突变的癌症患者的基因组图谱。本研究结果表明,BRAF III 类突变定义了一组对抗 EGFR 药物或上游 KRAS 信号抑制剂敏感的患者。引人注目的是,患有罕见肿瘤(如小肠癌)的患者可能会从这种治疗中获益,这强调了临床上全面基因组测序的潜在价值。
我们发现,除黑色素瘤外,在几乎所有肿瘤类型中,KRAS 突变与 III 类 BRAF 突变都是互斥的。而其他 RAS 成员(如 NRAS 和 HRAS)在大量 III 类 BRAF 突变肿瘤中被激活。正如预期的那样,NF1 变异在黑色素瘤中显著富集。由于黑色素瘤中基础受体酪氨酸激酶活性低基因变异导致的 RAS 激活与既往研究显示在黑色素瘤中单独的 BRAF III 类突变不会导致癌症发生一致。值得注意的是,在 BRAF III 类突变黑色素瘤样本中发现中位 TMB 较高(图 5a)。BRAF III 类突变与 TMB 之间的关联需要进一步研究,因为高 TMB 预测黑色素瘤对免疫治疗的反应。
在具有高内在受体酪氨酸激酶活性的肿瘤中,III 类 BRAF 突变通过破坏 ERK 介导的负反馈信号诱导肿瘤发生。此外,III 类 BRAF 突变体对活化的 RAS 的亲和力增加,这与突变型 BRAF 和野生型 CRAF 之间异二聚体形成的增加有关。这些肿瘤依赖于突变的 BRAF-CRAF 异二聚体的活性。与这种机制一致,我们观察到在结直肠癌和非小细胞肺癌患者中致癌 CRAF 变异与 III 类 BRAF 突变同时发生。CRAF 激活突变可能导致对抗 EGFR 药物的反应降低,而对 MEK 抑制剂敏感。几项研究表明,最常见的 CRAF 突变,S257X,对 MEK 抑制剂敏感,提示同时携带 BRAF III 类突变和 CRAF 突变的患者可能获益于抗 EGFR 药物与 MEK 抑制剂联合治疗。在 KRAS G12C 突变结直肠癌患者中,RAS 通路的垂直双重抑制被证明是有益的,帕尼单抗与索托雷塞和西妥昔单抗与阿达格拉西布或 Divarasib 联合治疗显示出较高的疾病控制率。这种情况进一步强调了全面基因组测序的重要性,还可以发现靶向治疗耐药标志物,促进联合治疗策略。
我们发现,在 III 类 BRAF 突变肿瘤中,提示抗 EGFR 治疗耐药的变异发生率显著较低。这可能解释了在这些接受抗 EGFR 药物治疗的患者中观察到的良好预后。应该注意的是,本研究未基于既往治疗对患者进行分层。患者通常会获得新的突变,导致对先前的治疗产生耐药性。在 EGFR 靶向治疗的情况下,EGFR 点突变(如 T790M)经常出现在既往接受过抗 EGFR 药物治疗的患者中,导致对多种抗 EGFR 靶向疗法耐药,而对奥希替尼敏感。因此,在设计靶向治疗时,治疗史以及对潜在获得性突变的监测至关重要。
有趣的是,大约 3.3% 的小肠癌样本携带 BRAF III 类突变。小肠癌非常罕见且致命;BRAF III 类突变的标准检测可能会增加使用抗 EGFR 药物治疗该患者亚组的机会。然而,需要注意,编码 MEK1 蛋白的 MAP2K1 在小肠癌中经常发生突变。研究表明,多种 MAP2K1 突变会干扰并阻止多种 MEK 抑制剂与 MEK1 的结合,从而导致耐药性。
在胆管癌中,发现 FGFR2 变异与 III 类 BRAF 突变互斥。胆管癌的靶向治疗主要限于携带 FGFR2 变异和 IDH1-2 突变的患者。我们的结果表明,FGFR2 IHC 结果为阴性和靶向panel测序未检出 FGFR2 或 IDH 变异的胆管癌患者可能有其他靶向治疗选择。
此外,抗 EGFR 药物的选择至关重要;抗EGFR单克隆抗体阻断野生型EGFR,而EGFR酪氨酸激酶抑制剂(如奥希替尼)对野生型EGFR的抑制活性很低。因此,由于大多数 BRAF III 类突变患者是 EGFR 野生型,单克隆抗 EGFR 抗体的疗效可能优于 EGFR 酪氨酸激酶抑制剂。使用 EGFR 酪氨酸激酶抑制剂而不是抗 EGFR 单克隆抗体可能是一些 BRAF III 类突变患者没有反应的原因。由于 EGFR 活性增加是 BRAF III 类驱动肿瘤发生的关键事件,因此与 MEK 抑制剂相比,EGFR 靶向治疗显示出更高的缓解率。本文提供的 2 例病例(图 6)显示了携带 III 类 BRAF 突变的两种不同肿瘤类型对含抗 EGFR 方案的临床反应。其中一名患者接受了西妥昔单抗单药治疗,获得 15 个月的持久缓解。两名患者对分子指导的靶向治疗有令人印象深刻的反应,即使是在多线全身治疗失败后。这些病例强调了 BRAF III 类突变作为潜在治疗靶点的价值。应该注意的是,一项对 2084 名转移性 CRC 患者的分析显示,携带 III 类 BRAF 突变的患者最佳反应为疾病稳定。然而,该研究存在缺乏治疗史和携带 III 类 BRAF 突变的患者队列较小的局限。BRAF III 类突变与其他突变共存(如 NF1 和 CRAF 突变)可能需要联合方法,这些患者可能从抗 EGFR 单克隆抗体与 MEK 抑制剂联合治疗中获益。
到目前为止,多项临床研究表明,抗 EGFR 治疗对 III 类 BRAF 突变的癌症患者有益。然而,这些研究通常由较小的队列组成,并且缺乏真实世界基因检测数据。本研究证明了携带 BRAF III 类突变的患者的基因组异质性,强调了基因检测在这些患者中评估潜在完整治疗方案的效用。虽然这些患者获益于抗 EGFR 药物,但确定可能导致无反应的其他变异至关重要。需要进一步的临床试验来评估 BRAF III 类突变的治疗价值及其在癌症中的预后作用。本研究的局限在于缺乏这部分患者靶向治疗反应的大型队列证明。我们认为,将 BRAF 突变分类为 BRAF V600 与非 V600 突变可能不如识别存在三个亚类中的哪一个那么精确,因为 BRAF III 类突变的分布和行为可能与其他 BRAF 突变不同。
参考文献:
Özgü, E., Kaplan, B.G., Sivakumar, S. et al. Therapeutic vulnerabilities and pan-cancer landscape of BRAF class III mutations in epithelial solid tumors. BJC Rep 2, 77 (2024). https://doi.org/10.1038/s44276-024-00086-2



