Nat Commun:张宏伟/王盛典/王耀和合作揭示复发性高级别胶质瘤的治疗新途径
时间:2024-11-13 17:04:07 热度:37.1℃ 作者:网络
恶性神经胶质瘤是一种高度致命的中枢神经系统恶性肿瘤,具有高复发率。溶瘤病毒提供了潜在的治疗方法,但疗效和安全性有待提高。
2024 年 11 月 8 日,首都医科大学张宏伟、中国科学院大学王盛典及伦敦大学王耀和共同通讯在 Nature Communications在线发表题为 “Non-secreting IL12 expressing oncolytic adenovirus Ad-TD-nsIL12 in recurrent high-grade glioma: a phase I trial” 的研究论文,在该试验中记录了1例患者的完全缓解(根据神经肿瘤学标准的反应评估),1例患者的部分缓解以及治疗后CD4+和CD8 + T细胞浸润到肿瘤中的情况。总之,Ad-TD-nsIL12在复发性高级别胶质瘤患者中已经证明了安全性和初步有效性。
该研究描述了一项剂量递增的I期单组试验(ChiCTR2000032402),研究Ad-TD-nsIL12(一种表达非分泌白介素-12的溶瘤腺病毒)在与心室系统相连的复发性高级别胶质瘤患者中的安全性。8例患者通过立体定向或Ommaya储库接受瘤内治疗,剂量范围为5 × 109至5 × 1010vp。主要终点是确定最大耐受剂量。次要终点包括毒性和抗肿瘤能力。在5 × 109和1 × 1010vp剂量下观察到最小的不良事件。队列3中有2例患者发生3级癫痫发作(5 × 1010vp)。因此,确定最大耐受剂量为1 × 1010vp。4例患者在随访中出现脑积水。其中2例患者在放置脑室-腹膜分流器后症状得到缓解,另外2例患者MRI扫描仅显示脑室肿大,未见神经功能恶化。

高级别胶质瘤(HGG)是最常见和致命的类型,占所有恶性原发性脑肿瘤的一半以上。虽然一些病理亚型,如III级少突胶质细胞瘤,有相对有利的生存时间,但IV级肿瘤的中位生存期仅为14-16个月。胶质母细胞瘤(GBM)的生存率更差,只有约四分之一的患者在诊断后存活2年,只有5%至14%的患者存活5年以上。目前的治疗策略包括最大肿瘤切除术联合放疗和替莫唑胺化疗。最近,在标准护理中加入肿瘤治疗领域已被证明可以改善患者的治疗效果。标准治疗(SOC)通常能够减少肿瘤进展,但复发是常见的,复发性HGG (rHGG)的预后非常差,肿瘤进展后中位生存期仅为6-8个月。肿瘤的位置可能是预后的关键,因为肿瘤生长在侧脑室附近,生存率较低,复发率较高。这些结果表明,明确和迫切需要为这些患者提供更成功的治疗方案,以改善临床结果。
肿瘤靶向复制溶瘤病毒(tov)已成为极具吸引力的癌症治疗候选药物,并与传统治疗方法和其他免疫治疗方式协同作用。tov是在肿瘤细胞中选择性复制的野生型或转基因病毒。它们具有多种作用机制,最终导致抑制性肿瘤微环境(TME)的重塑,从而产生强大的抗肿瘤免疫反应。复制型溶瘤腺病毒( AdV )由于其易于生产、易于遗传操作和良好的安全性,是TOV的热门候选者。2005年,Oncorine ( H101 )成为我国首个获得上市许可的AdV,用于头颈部肿瘤的治疗。然而,尽管安全,包括恶性胶质瘤在内的多种肿瘤类型的临床疗效尚未得到证实,并且H101的治疗导致很少的客观反应。
对引入腺病毒5型(Ad5)基因组以产生H101的遗传修饰的功能影响的评估表明,E1B55K和E3基因区域的缺失(用于促进肿瘤选择性复制)对这些病毒在肿瘤细胞内有效复制的能力产生了重大影响。与野生型Ad5相比,H101在感染和复制后被更快地清除,细胞毒性较差。疗效差与E3B区域缺失导致的肿瘤中明显的巨噬细胞浸润有关,在脑肿瘤模型中,这种表型与疗效差有关。第二代溶瘤AdV(如dl922-947/Delta-24病毒)也存在类似的低疗效问题。这些病毒通过保留对调节病毒mrna的转运和稳定至关重要的E1B55K基因,在第一代迭代中得到了改进。相反,引入早期E1A基因的24个碱基对缺失来赋予肿瘤选择性。从第一代病毒中保留有害的E3基因区域缺失可能是第二代AdV临床疗效降低的一个因素。
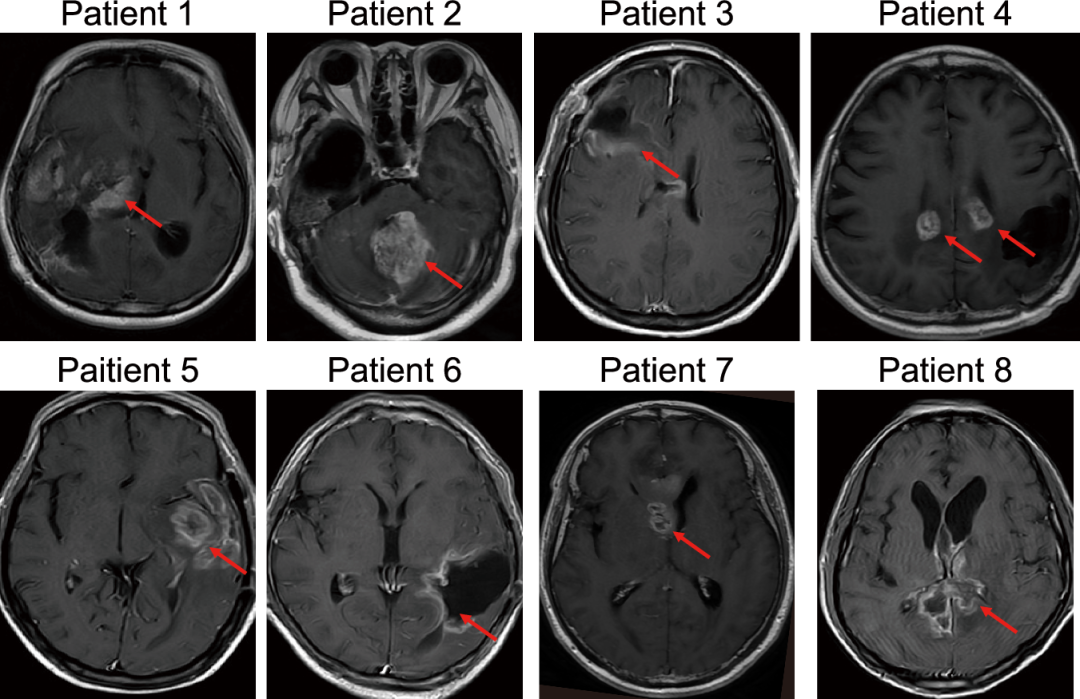
MRI确定肿瘤部位和肿瘤与心室系统的位置(图片源自Nature Communications )
基于改进AdV的明确需求和对其生物学知识的深入了解,作者报道了具有三个基因缺失(E1A CR2, E1B19K和E3gp19K)的新一代可复制AdV Ad-TD。重要的是保留了完整的E3B区域,克服了先前AdV候选体的局限性。纳入免疫刺激有效载荷被认为是新一代溶瘤疗法的一个重要方面,需要实现更强和长期的抗肿瘤疗效。在这方面,白细胞介素-12 (IL-12)被认为是免疫系统中最有效和多效性的细胞因子之一,具有多种相关的抗肿瘤功能。然而,IL-12的成功临床应用因其显著的毒性而受阻。为了克服与IL-12表达相关的毒性并利用其强大的抗肿瘤活性,作者报告了一种系统,通过修改细胞因子的信号肽来产生非分泌IL-12分子,从而在TME内实现持久的低水平IL-12表达。当在Ad-TD中表达时,未修饰的IL-12在全身递送后是有毒的,但修饰的IL-12 (nsIL12)始终是安全的。此外,在不同的肿瘤模型中,Ad-TD-nsIL12的疗效远远优于H101。
在这项研究中,作者提供了Ad-TD-nsIL12在连接心室系统肿瘤的rHGG患者中的临床安全性和初步抗肿瘤功效的数据。已经证明了1×1010vp给药的一致性安全性,并发现重复注射是可行的,不会导致毒性累积。虽然有4例患者出现脑积水,但这并不能完全归因于病毒注射,因为由于肿瘤本身暴露于脑室,可能会出现脑积水。其中2例仅在影像学上显示脑室肿大。作者还证明了改良的IL-12细胞因子载荷的临床安全性,它可以通过启动有效的免疫反应来改善结果。
原文链接:
https://www.nature.com/articles/s41467-024-53041-7


