Mol Cancer:温州医科大学纪建松/涂建飞发现肿瘤免疫微环境重塑与免疫治疗中的铜死亡、铁死亡和泛凋亡的综述
时间:2024-11-17 11:01:05 热度:37.1℃ 作者:网络
正常的生命需要细胞分裂来产生新的细胞,但细胞死亡是维持平衡所必需的。细胞死亡的失调可导致异常细胞的存活和增殖,促进肿瘤的发展。与细胞凋亡、坏死和自噬不同,新发现的调节细胞死亡(RCD)形式铜死亡、铁死亡和PANoptosis为肿瘤治疗提供了新的治疗策略。越来越多的研究表明,这些新发现的细胞死亡形式介导的肿瘤和免疫细胞死亡可以调节肿瘤微环境(tumor microenvironment, TME),影响肿瘤免疫治疗的有效性。
2024 年 11 月 15 日,温州医科大学纪建松及涂建飞共同通讯在 Molecular Cancer在线发表题为 “Cuproptosis, ferroptosis and PANoptosis in tumor immune microenvironment remodeling and immunotherapy: culprits or new hope” 的综述论文,该文章就铜死亡、铁死亡和泛凋亡的分子机制及其对肿瘤细胞和TME的复杂影响作出了综述。

细胞死亡在机体组织中反复发生,是保护组织功能和形态的不可逆转的过程。根据细胞形态、生物化学和功能,细胞死亡命名委员会将细胞死亡分为偶发性细胞死亡和调节性细胞死亡。细胞意外死亡是一个不受生物学控制的过程,是对意外损伤刺激的反应。RCD被认为是由一系列分子机制和信号通路介导的受控被动过程。对肿瘤细胞和治疗方法的广泛研究表明,RCD诱导的细胞死亡可能重塑肿瘤微环境(TME)的免疫学特性,影响其阻碍癌症进展和转移的能力。我们熟悉的死亡模式包括坏死、凋亡、自噬和坏死凋亡,它们可以通过不同的分子机制和信号通路诱导肿瘤细胞死亡,以响应外源环境和细胞内紊乱。
坏死是指细胞的非自愿死亡,通常由外部伤害或压力因素(如感染、创伤或缺血)引发,并伴有炎症反应。相反,细胞凋亡代表了一种蓄意的细胞死亡,由内部和外部信号启动,并通过特定的生化途径执行。自噬作为一种细胞防御系统,通过破坏和再利用受损细胞器来确保细胞存活。以炎症细胞死亡为特征的焦亡,经常发生在病原体感染过程中,导致炎症因子的释放。坏死性凋亡是程序性坏死的一种调控形式,涉及与某些蛋白质相关的信号通路,包括RIPK3和MLKL。每一种形式的RCD都有独特的生物学功能和标记。然而,在治疗过程中,恶性肿瘤细胞可以进化出多种机制来逃避这些RCD途径,导致对癌症化疗的抵抗或细胞死亡抵抗。因此,发现能够对抗肿瘤进展和迁移防御机制的新型RCD是对抗肿瘤进展的新策略。
近年来,利用新兴的细胞死亡模式来指导细胞死亡得到了广泛的研究。铁死亡和铜死亡是依赖于特定金属离子的细胞死亡形式,分别由铁和铜代谢紊乱引起。PANoptosis涉及多种死亡途径的综合作用。所有三种形式的RCD都涉及以前未知的细胞死亡机制、特征和生物标志物,它们在肿瘤中的作用越来越受到关注(图1)。此外,在癌症中已经报道了铜沉和铁沉之间的相互作用。铁下沉激活剂索拉非尼和erastin可以增强脂酰化蛋白的铜基聚集,从而通过抑制线粒体基质相关蛋白酶诱导的FDX1蛋白降解和通过下调半胱氨酸的进口减少细胞铜螯合剂GSH的合成,从而增强HCC中的铜基硬化。铜螯合剂可以减弱对铁死亡的敏感性,但不能抑制其他方式的细胞死亡。
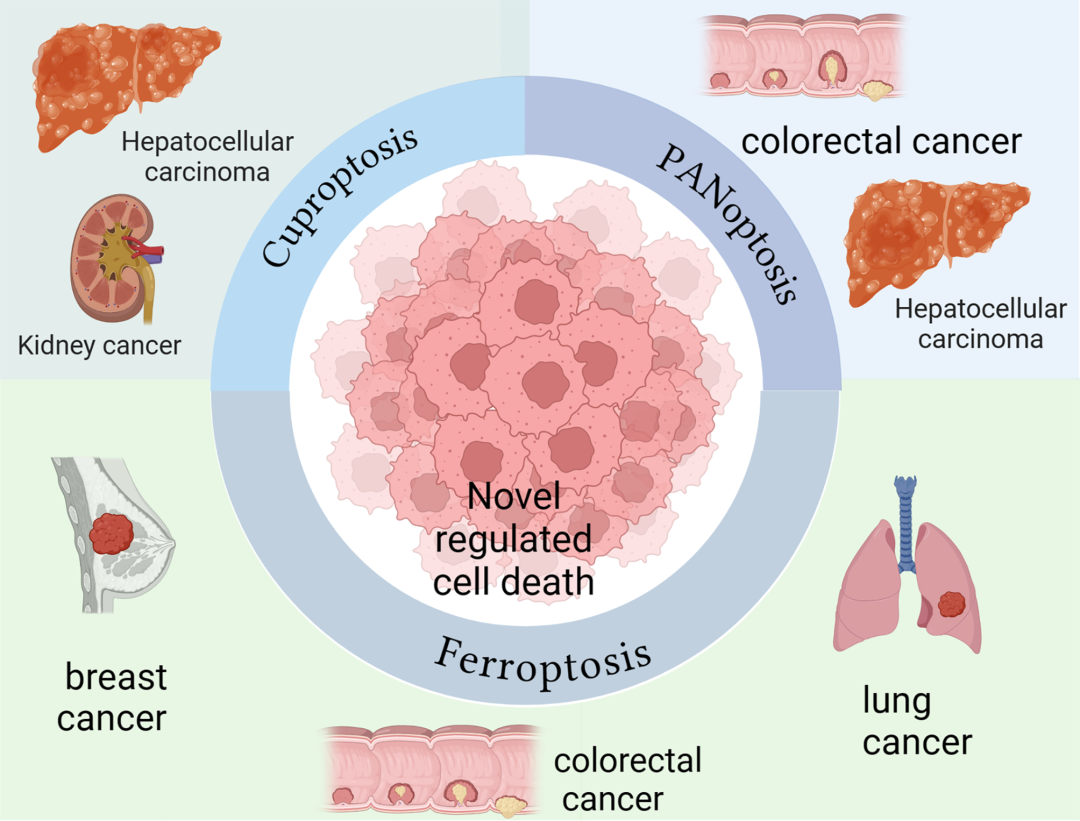
图1:肿瘤免疫微环境重塑与免疫治疗中的铜死亡、铁死亡和泛凋亡:罪魁祸首还是新希望(图源自Molecular Cancer )
然而,对TME中出现的细胞死亡形式,如铁死亡、铜死亡和泛凋亡的研究是有限的。许多潜在的机制仍不清楚,还需要更多的基础研究,如特异性细胞敲除。构建转基因小鼠模型对于探索免疫和肿瘤细胞死亡引起的TME变化至关重要。此外,特异性靶向抑制剂和激动剂必须进一步开发,这也是后续翻译和临床研究的潜在挑战。
存在许多可预见的机会来阐明新出现的细胞死亡形式的调控机制。利用TME中这些形式的细胞死亡具有抑制肿瘤进展和开发个性化抗肿瘤方案的巨大潜力。作者还预测,基于新出现的细胞死亡形式的新疗法将很快被开发出来并投入临床使用,以特定的生物标志物、对患者疾病背景的精确评估和个性化治疗为指导。
参考消息:
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-024-02130-8


