Nature子刊揭示:抑制粘附分子途径能够有效提升肿瘤内iNKT细胞浸润和功能,进一步增强iNKT细胞疗法的抗肿瘤功效!
时间:2024-11-22 15:00:31 热度:37.1℃ 作者:网络
亮点
1.肿瘤细胞通过VCAM1/CD49d/CDC42途径,限制肿瘤内iNKT细胞运动,抑制iNKT细胞激活,加快肿瘤的生长进程;采用“抗CD49d抗体+α-GalCer注射”疗法有望进一步增强iNKT细胞的抗肿瘤功效。
2.CDC42是促进肿瘤内iNKT细胞浸润、增加IFN-γ 含量,改善iNKT细胞抗肿瘤功效的关键。
随着肿瘤发病率的逐年增长,恶性肿瘤作为主要死因的情况日渐加剧。近年来,细胞免疫疗法作为治疗体系中的重要组成部分,通过激发机体的自然免疫防御、重建免疫微环境等方式,控制和杀伤肿瘤细胞,为众多患者带来了希望。其中,基于恒定自然杀伤T(invariant natural killer T cell,iNKT)细胞的新一代细胞免疫疗法展示出良好的抗肿瘤潜力。
恒定自然杀伤T细胞是CD1d限制的T淋巴细胞,具有固有免疫特性,表达半恒定T细胞受体(T cell receptor, TCR)。iNKT细胞除了抗肿瘤功能外,还具有低细胞毒性和异体移植安全等优势,具有广泛的应用前景。然而,肿瘤组织iNKT细胞功能异常和浸润能力低下是限制该疗法发展的重要原因,因此,探寻瘤内iNKT细胞浸润和功能的动态调控机制显得尤为重要。
为填补这一空白,中国科学技术大学白丽教授课题组于近期在Nature Communications上发表了题为Motility and tumor infiltration are key aspects of invariant natural killer T cell anti-tumor function的研究,他们发现肿瘤细胞通过VCAM1/CD49d抑制肿瘤内iNKT细胞CDC42的表达,进而限制肿瘤内iNKT细胞运动、抑制肿瘤内iNKT细胞与树突状细胞(dendritic cells, DCs)互作,最终抑制iNKT细胞激活、加快肿瘤的生长进程。

为了探索iNKT细胞在肿瘤中的运动调控功能障碍,研究人员对小鼠的iNKT细胞进行了荧光标记,随后检测了其在肿瘤中的分布。果不其然,他们发现肿瘤内(距边缘约100 μm)iNKT细胞密度远低于肿瘤外围密度,瘤内iNKT细胞仅在小范围内运动,位移长度和速度都很低——这表明,iNKT细胞无法有效地浸润到肿瘤中,并且肿瘤微环境显着抑制了其运动性。
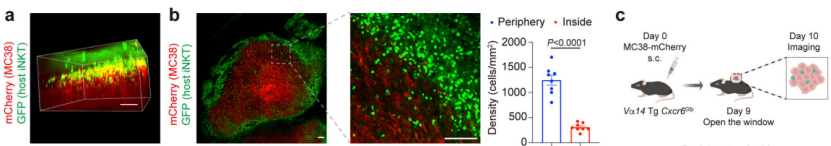
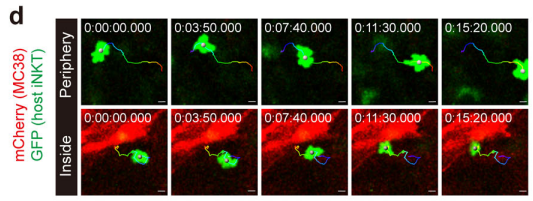
肿瘤中的iNKT细胞表现出低密度和运动受损
众所周知,运动性对iNKT细胞在体内的抗原识别至关重要,那么瘤内iNKT细胞的抗原识别、活化是否受损呢?
为回答这一问题,研究人员构建了CD1d条件性基因敲除小鼠模型。α-半乳糖基神经酰胺(α-GalCer)是iNKT细胞的激活剂,通过注射α-GalCer,他们发现当DCs中缺失CD1d时,肿瘤内iNKT细胞产生的α-GalCer诱导的IFN-γ显著减少,说明DCs是激活和诱导体内肿瘤iNKT细胞抗肿瘤反应的主要抗原递呈细胞。值得注意的是,在注射α-GalCer后,iNKT细胞在正常组织(如脾脏)比在肿瘤内更有效地与DCs形成集群;同样,与脾脏iNKT细胞相比,肿瘤内iNKT细胞产生的IFN-γ较少。
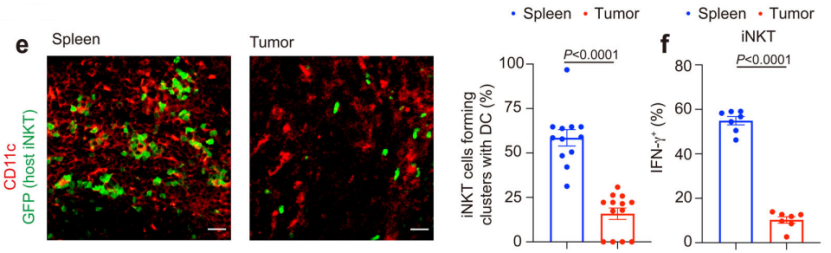
iNKT 细胞无法与肿瘤中具有正常抗原递呈能力的DCs相互作用
已有研究报道,粘附分子可以控制免疫细胞迁移。血管细胞粘附分子1 (VCAM1)在肿瘤中具有较高的mRNA水平,因此研究人员假设VCAM1可能影响iNKT细胞运动。有趣的是,在敲低VCAM1后,他们发现肿瘤细胞的凋亡增加,iNKT细胞更多的浸润到肿瘤内部,瘤内iNKT细胞具有了更长的迁移轨迹、随机方向、速度和位移长度,iNKT细胞产生的IFN-γ 含量大幅增高。这些迹象表明, VCAM1限制了肿瘤内iNKT细胞的运动,并阻碍了它们的抗原识别和激活。
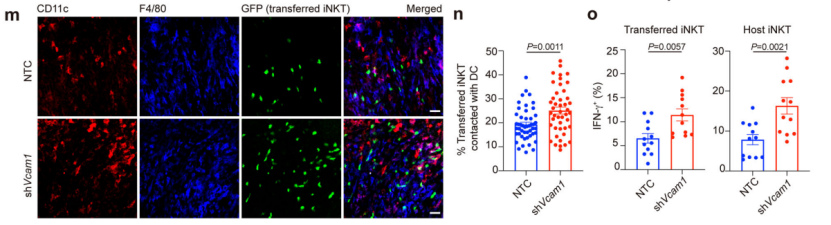
肿瘤细胞中的VCAM1抑制iNKT细胞的抗原识别与激活
为了进一步了解VCAM1控制瘤内iNKT细胞行为的机制,研究人员比较了Vcam1敲低肿瘤中iNKT细胞的转录组。意外的是,他们发现了iNKT细胞CDC42 信号转导得到改善。已有研究表明,CDC42可控制细胞迁移和免疫突触形成。于是,他们使用抑制剂ZCL278,证明了CDC42活性是iNKT细胞运动(包括体外随机迁移、速度和位移长度)所必需的;甚至,iNKT细胞中IFN-γ的产生都依赖于CDC42。总之,CDC42是导致iNKT细胞的肿瘤浸润、IFN-γ 产生和抗肿瘤功效增强的关键。
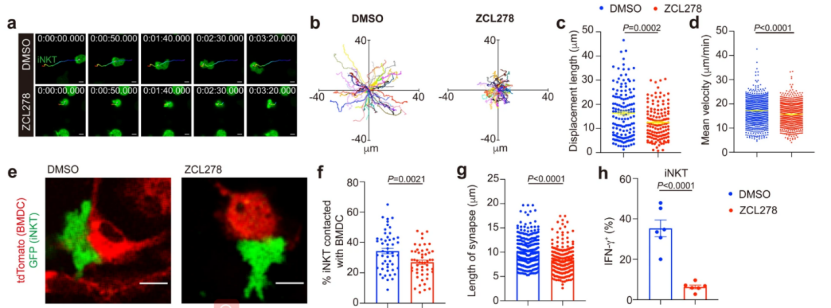
CDC42表达降低抑制瘤内iNKT细胞的运动和活化
最后,为了评估iNKT细胞疗法的治疗效果,研究人员将扩增的iNKT细胞转移到肿瘤小鼠中,并给它们注射α-GalCer。果不其然,iNKT细胞转移+α-GalCer注射显著抑制肿瘤生长,而Vcam1的敲除更是增强了iNKT细胞对肿瘤的浸润和IFN-γ的产量。
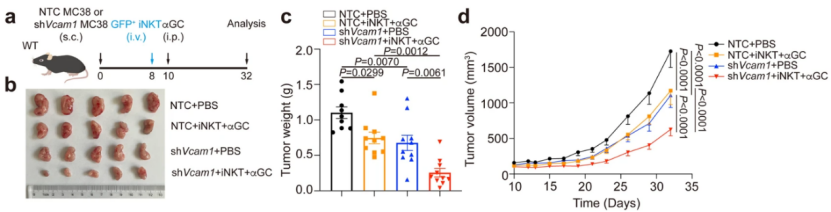
iNKT细胞的抗肿瘤作用
此外,已知CD49d是VCAM1受体的一个亚基,研究人员通过使用抗CD49d抗体干扰小鼠肿瘤VCAM1受体信号传导,同时进行iNKT细胞转移+α-GalCer注射,发现抗CD49d抗体+iNKT细胞转移+α-GalCer注射可显著增强iNKT细胞的抗肿瘤功效,增加iNKT细胞的肿瘤浸润,并增强肿瘤内iNKT细胞中IFN-γ的产生。由此,他们真正的串通了肿瘤内部依赖VCAM1/CD49d/CDC42调控iNKT细胞活性的级联通路。
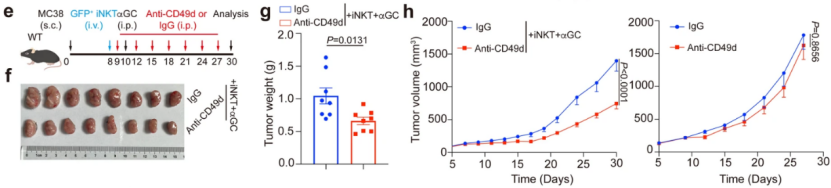
阻断VCAM1-CD49d信号传导增强了iNKT细胞的抗肿瘤功效
综上所述,本研究从动态调控角度解析了iNKT细胞免疫应答的分子机制,为提高iNKT细胞治疗效果提供了新的思路和策略。相信在iNKT细胞疗法的加持下,肿瘤必不再如“滔天猛兽”,令人谈之色变。
来源:
微信公众号: 基因启明
参考文献:
Tian, C., Wang, Y., Su, M. et al. Motility and tumor infiltration are key aspects of invariant natural killer T cell anti-tumor function. Nat Commun 15, 1213 (2024). https://doi.org/10.1038/s41467-024-45208-z


