TIM-3棕榈酰化促进免疫耗竭并抑制抗肿瘤免疫
时间:2024-11-23 16:00:48 热度:37.1℃ 作者:网络
棕榈酰化:作为一种PTM,负责调控蛋白质的定位和稳定性,它通过修饰免疫受体和效应物,从而精确地调节它们在细胞膜上的动态表达,在抗肿瘤免疫方面起着重要作用。
TIM-3 (T cell immunoglobulin and mucin domain-containing protein 3)是一个新兴的免疫检查点,TIM-3的高表达加重了CD8+ T细胞和NK细胞的功能障碍和衰竭,而阻断TIM-3可以增强它们的抗肿瘤功能,为癌症免疫治疗提供新策略。
与以PD-1/PD-L1抗体为代表的免疫检查点阻断疗法(ICB)相同,TIM-3相关的肿瘤免疫疗也备受关注。然而,目前有关PTM对TIM-3影响的研究较少,也没有研究解释TIM-3的降解途径。
最新,在Sci Immunol上,山东大学齐鲁医院马春红、武专昌共同发表的Palmitoylation of TIM-3 promotes immune exhaustion and restrains antitumor immunity的文章中,(研究亮点便聚焦于TIM-3棕榈酰化中的作用,发现了一种由棕榈酰基转移酶DHHC9影响TIM-3的稳定性和表达的翻译后调控机制,并通过设计阻断TIM-3棕榈酰化的蛋白多肽,提供靶向棕榈酰化修饰降解TIM-3以增强抗肿瘤免疫治疗的新策略)。

实验思路解析如下:
1.人TIM-3的胞质11-aa尾控制着其表面表达和蛋白的稳定性
首先,作者探讨是否可以在蛋白水平上调控TIM-3。
通过氨基酸序列比对发现,人Tim-3在细胞质有11-aa尾巴,且序列保守。为了验证11-aa是否参与TIM- 3在细胞表面的表达,作者从全长TIM-3中删除了11-aa获得TIM-3Δ11aa,免疫荧光染色和共聚焦实验结果显示全长TIM-3主要定位于细胞膜;超过一半的TIM- 3Δ11aa主要定位于细胞器。除此之外,在CHX-chase检测中发现TIM-3Δ11aa的半衰期比全长TIM-3的要短,说明人TIM-3的细胞质11-aa尾巴在决定其表面表达和稳定性方面起着至关重要的作用。
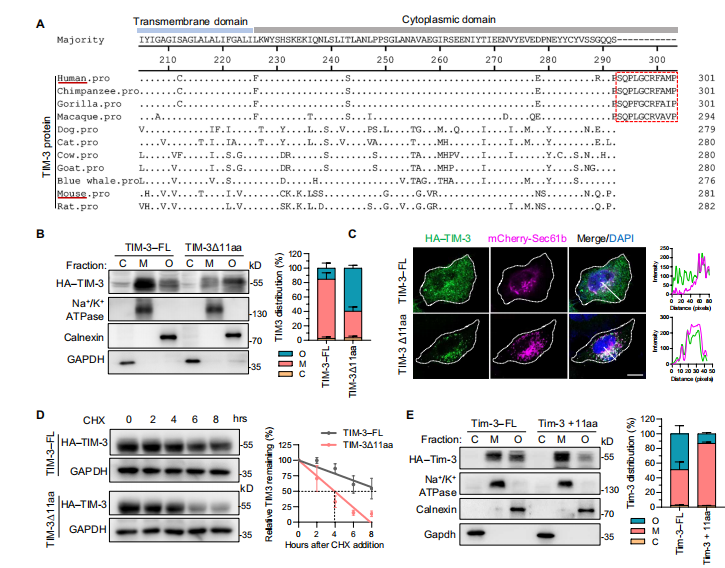
图1.细胞质中11-aa尾巴增强了人TIM-3的表面表达和稳定性。(图源[1])
2.人TIM-3在Cys296位点的棕榈酰化对其表面表达和稳定性至关重要
那么11-aa尾巴是通过何种方式调控TIM-3呢?
作者基于PTM对蛋白质定位和稳定性的作用,利用在线PTM预测工具预测到11-aa尾部仅有一种PTM,即棕榈酰化,且Cys296位点似乎是潜在残基。接下来,作者通过ABE实验和Click-iT标记实验验证TIM-3棕榈酰化,更重要的是,Cys296的突变(C296A)消除了这种修饰。
那这种修饰是否调节TIM-3的稳定性和表面表达呢。在分布方面,免疫印迹和共聚焦成像提示,棕榈酰化抑制剂2-BP降低NK细胞膜组分中TIM-3的表达,TIM-3-C296A突变体也有相同表现;在稳定表达方面,免疫荧光共定位和流式细胞术显示,2-BP以剂量依赖的方式降低各种免疫细胞中TIM-3总蛋白丰度,加速了内源性TIM-3的降解。
总之,所有这些发现表明,TIM-3在Cys296位点的棕榈酰化有助于稳定蛋白,并促进其表面表达。
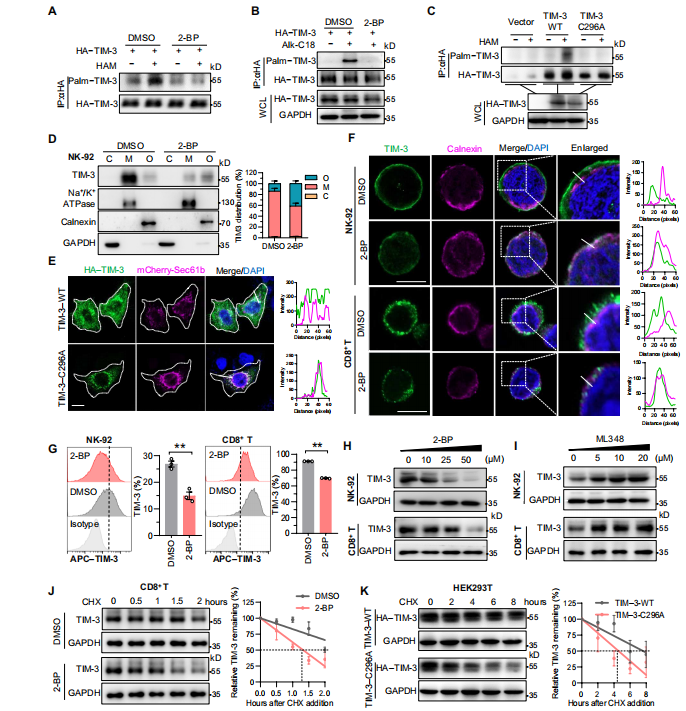
图2. Cys296位点的棕榈酰化稳定了人类TIM-3。(图源[1])
3.TIM-3的棕榈酰化减弱了其与HRD1的相互作用和ER降解
TIM-3棕榈酰化增强蛋白稳定性,那么接下来,作者进一步探讨了在棕榈酰化缺失条件下,TIM-3是如何降解的。
作者首先发现MG132阻断了2-BP诱导的TIM-3降解,并且此诱导增加泛素化水平,说明TIM-3降解是泛素-蛋白酶体引起的,并在ERAD抑制剂处理下发现TIM-3降解通过ERAD。除此之外,作者还发现ERAD的E3泛素连接酶HRD1负责连接TIM-3,并且Cys296的棕榈酰化能够减弱TIM-3与HRD1之间的相互作用,防止其泛素化和降解。
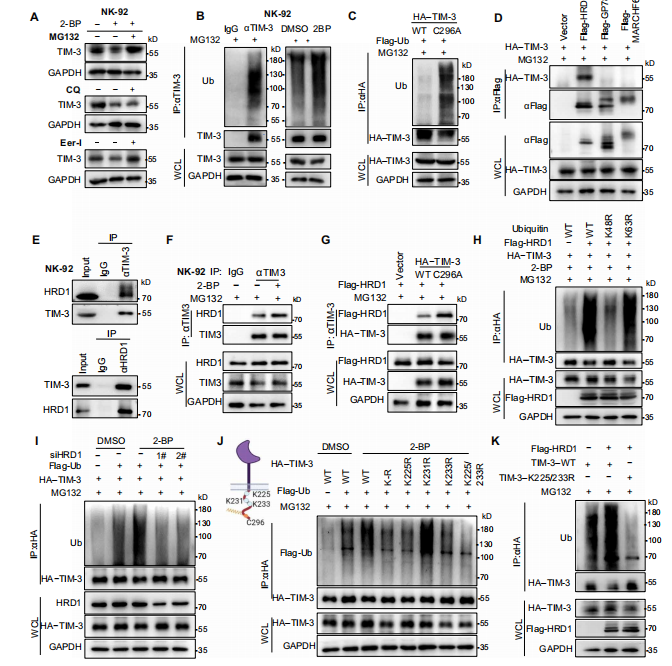
图3.在棕榈酰化的缺失下,TIM-3通过HRD1介导的ERAD促进其降解。(图源[1])
4.DHHC9棕榈酰化TIM-3,阻断其与HRD1的相互作用和泛素化降解
蛋白质棕榈酰化是由蛋白棕榈酰基转移酶(DHHCs)促进的,具体是哪一个成员负责TIM-3棕榈酰化呢?
首先,作者通过免疫共沉淀初步筛选6种与TIM-3相互作用的棕榈酰基转移酶,接下来,利用siRNA发现仅下调DHHC9,才能抑制了TIM-3蛋白的表达和棕榈酰化作用,且共聚焦和Co-IP检测进一步证实了TIM-3与DHHC9的相互作用,并在Cys296处使其棕榈酰化。紧接着,作者发现在NK细胞和CD8* T细胞中,过表达DHHC9增加TIM-3稳定性,而沉默DHHC9则促进TIM-3与HRD1的相互作用,加速TIM-3泛素化降解,降低TIM-3蛋白质稳定性。
综上所述,上述数据表明DHHC9介导的棕榈酰化抑制了TIM-3与HRD1的相互作用,降低TIM-3蛋白泛素化,增强其稳定性。
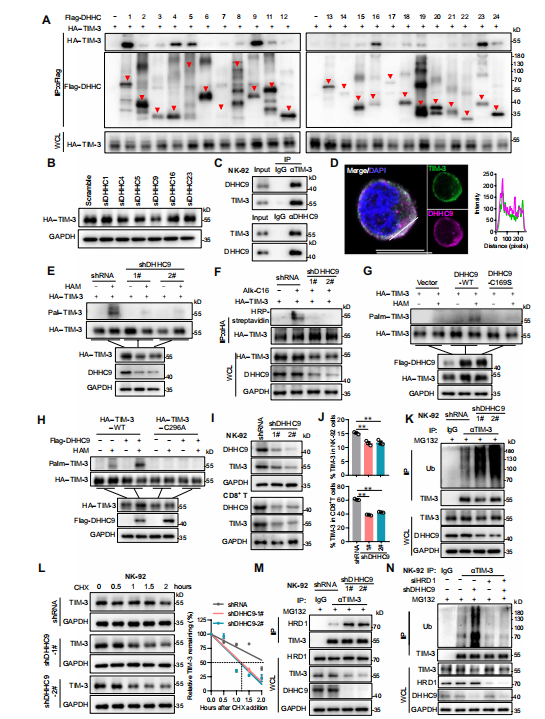
图4.DHHC9棕榈酰化TIM-3以抑制HRD1介导的TIM-3泛素化。(图源[1])
5.DHHC9增强TIM-3的表达并加重肿瘤微环境中免疫衰竭
进一步,作者探究了DHHC9增强TIM-3表达的影响。
作者通过相关性分析发现,在HCC组织CD8+ T细胞和NK细胞中TIM-3的表达与DHHC9呈正相关,且其高表达和肝癌患者的不良预后密切相关。
基于TIM-3对抗肿瘤免疫的作用,作者通过诱导细胞衰竭,在敲除DHHC9的Tex细胞中发现,DHHC9沉默抑制了TIM-3蛋白表达,且显著降低了CD8+T细胞耗竭,减少TNF-α和IFN-γ分泌,
总之这些发现支持了在肿瘤微环境中,DHHC9增强TIM-3的表达并加重免疫衰竭。
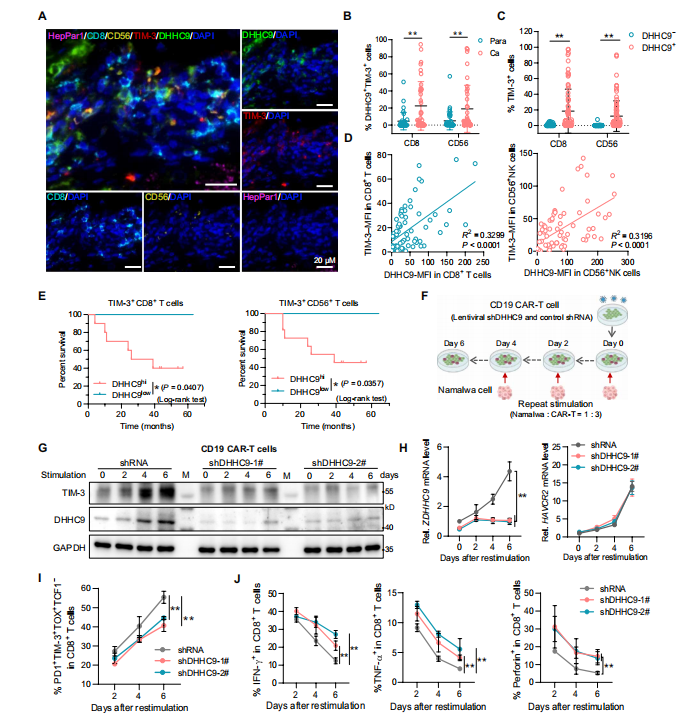
图5 .DHHC9在CD8+ T细胞和NK细胞中表达上调,并与TIM-3的表达和免疫衰竭呈正相关。(图源[1])
6.TIM-3棕榈酰化的多肽抑制剂增强体内外的抗肿瘤免疫力
为了证实上述靶向DHHC9介导的TIM-3棕榈酰化在抗肿瘤免疫治疗中的潜力。
作者通过蛋白结构和分子互作分析,设计开发了一段蛋白多肽,能够竞争性抑制TIM-3棕榈酰化。CO-IP实验结果发现此多肽抑制DHHC9介导的TIM-3棕榈酰化,促进TIM-3的降解。随后在体外实验中发现,多肽抑制剂减少IFN-γ、TNF-α和颗粒酶B的分泌并降低 Tex细胞的百分比;在NCG小鼠的HCC模型中也显著抑制了腹膜肝癌的生长。
总之,体内外实验证实,此多肽特异性抑制DHHC9结合和TIM-3棕榈酰化,有效提高CAR-T细胞和NK细胞的抗肿瘤免疫治疗。
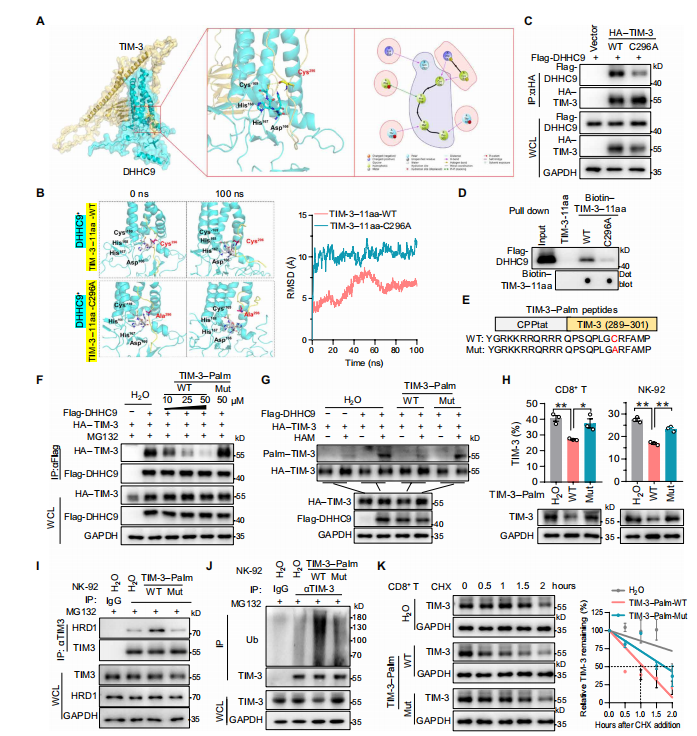
图6 .设计针对DHHC9介导的TIM-3棕榈酰化的多肽。(图源[1])
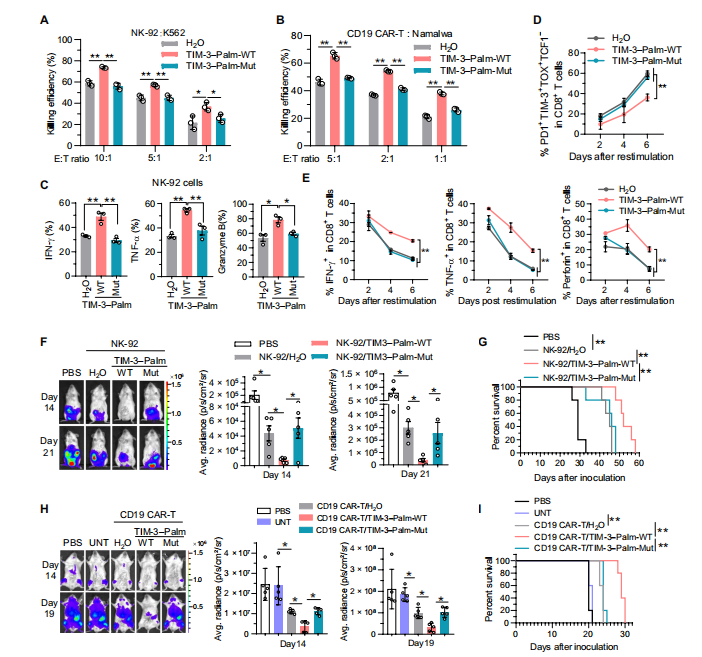
图6 .一种靶向TIM-3棕榈酰化的肽抑制剂可促进NK细胞和CAR-T细胞为基础的肿瘤免疫治疗。(图源[1])
讨论与展望
主要发现:
1.TIM-3在Cys296位点的棕榈酰化决定其表面表达和稳定性。
2.TIM-3棕榈酰化由DHHC9调控,DHHC9通过阻断TIM-3与HRD1的相互作用,抑制TIM-3泛素化降解,增强TIM-3蛋白稳定性。
3.多肽特异性抑制TIM-3棕榈酰化,降低TIM-3活性。
思路借鉴:
免疫检查点的表达和调控细胞信号转导的功能,均与翻译后修饰PTM密切相关。靶向PTM以诱导免疫检查点的降解,提出了一种耗竭而不是阻断免疫检查点的抗肿瘤免疫治疗新途径[2]。在韩瑶等人的研究中,PD-L1在Cys 272位点通过棕榈酰基转移酶进行棕榈酰化,能避免泛素化和降解;通过设计多肽,抑制PD-L1棕榈酰化会清除癌细胞中的溶酶体并加速PD-L1降解[3]。
以该思路研究各类免疫检查点的PTM,探讨其作用机制与具体功能,设计靶向多肽,或为抗肿瘤免疫治疗提供特异性抑制剂。
参考文献:
[1]Zhang Z, Ren C, Xiao R, Ma S, Liu H, Dou Y, Fan Y, Wang S, Zhan P, Gao C, Yue X, Li C, Gao L, Liang X, Wu Z, Ma C. Palmitoylation of TIM-3 promotes immune exhaustion and restrains antitumor immunity. Sci Immunol. 2024 Nov 15;9(101):eadp7302. doi: 10.1126/sciimmunol.adp7302. Epub 2024 Nov 15. PMID: 39546589.
[2]J. Xu, J. P. Brosseau, H. Shi, Targeted degradation of immune checkpoint proteins: Emerging strategies for cancer immunotherapy. Oncogene 39, 7106–7113 (2020).
[3]H. Yao, C. Li, F. He, et al. A peptidic inhibitor for PD-1 palmitoylation targets its expression and functions. RSC Chem. Biol. 2, 192–205 (2021).


