Cell:利用天然细胞融合蛋白,创造出新型基因治疗递送载体,可特异性靶向骨骼肌
时间:2023-04-21 14:24:25 热度:37.1℃ 作者:网络
如果我们把细胞比作一间屋子,那么细胞膜就是这间屋子的墙壁,而各种受体就是墙壁上的门窗。然而,这间屋子是“活的”,有时候细胞与细胞也会像泡泡一样融合在一起,这种膜融合过程对于细胞间的分子运动、受精、多核细胞的发育,以及病毒感染至关重要。
2023年4月18日,美国辛辛那提儿童医院医学中心的研究人员在 Cell 期刊发表题为:Enveloped viruses pseudotyped with mammalian myogenic cell fusogens target skeletal muscle for gene delivery 的研究论文。
该研究报道,将骨骼肌特异性细胞融合蛋白——Myomaker和Mymerger构建到用于基因治疗的包膜病毒载体上,从而开发出了用于骨骼肌细胞特异性递送的新型病毒载体。
研究团队表示,局部和全身注射这种重组包膜病毒能给杜氏肌营养不良(DMD)小鼠模型的骨骼肌递送微型抗肌萎缩蛋白(μDystrophin),减轻其病理状况。

上世纪90年代,美国开展了首例基因治疗临床试验,有效恢复重症联合免疫缺陷(SCID)患者的腺苷脱氨酶(ADA)合成,自此开创了基因治疗的先河。
如今,基因治疗发展了四十余年,并在单基因和多基因遗传病、癌症、感染性疾病等难治性疾病中展现出强大的治疗潜力,为治疗选择有限的患者带来了希望。
一般来说,基因治疗是将外源的正确基因片段导入到人体细胞中,以纠正或补偿缺陷和异常基因,从而缓解或治愈疾病的一种治疗手段。基因治疗成功的关键是将外源基因安全、有效地导入到目的细胞中,因此递送载体是其中的关键。
近年来,包膜病毒成为基因治疗的重要载体。相比于常用的腺相关病毒(AAV)载体,治疗性包膜病毒具有其独特的优点,包括更大的包装容量、可以整合到基因组中、可对干细胞进行转导,以及可以重复给药。然而,包膜病毒载体通常使用病毒抗原(如水疱性口炎病毒G蛋白,VSV-G)介导靶细胞的膜融合过程,容易引起机体的免疫反应而导致递送效率相对较低,并且尚未实现全身递送。
在这项最新研究中,研究团队将目光聚焦于那些可以介导膜融合的、细胞中天然存在的分子。他们首先注意到,骨骼肌的发育也需要成肌细胞之间的膜融合事件来形成多核肌纤维。于是,研究团队从骨骼肌细胞中找到了两种肌肉特异性的细胞融合蛋白——Myomaker和Mymerger(分别简称Mymk和Mymg)。
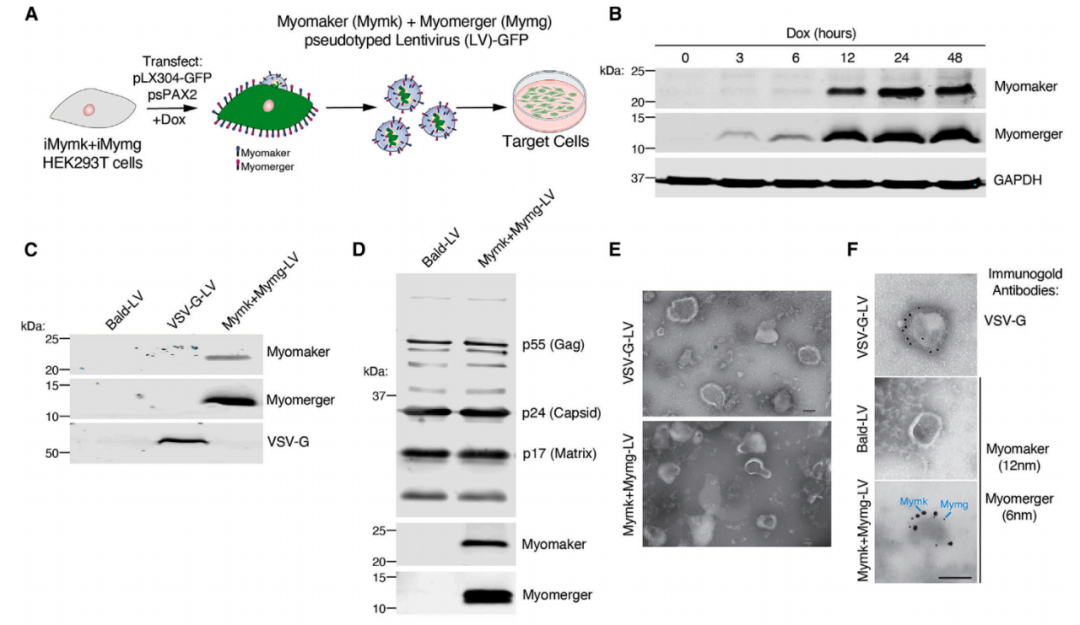
将Myomaker和Myomerger构建到包膜病毒载体上
Myomaker和Myomerger是成肌细胞融合所必需的膜蛋白,其表达在肌肉中受到空间和时间的控制,它们仅在活化的肌原细胞中表达,而在成熟的肌纤维中不表达。更重要的是,当这两种蛋白在其他细胞中表达时,可以诱导正常情况下不融合的细胞发生膜融合。
研究团队将Myomaker和Mymerger构建到包膜病毒基因治疗载体上,并确定这两种细胞融合原可以在功能上替代融合蛋白(例如VSV-G)驱动细胞膜的融合,实现在骨骼肌上的特异性转导。
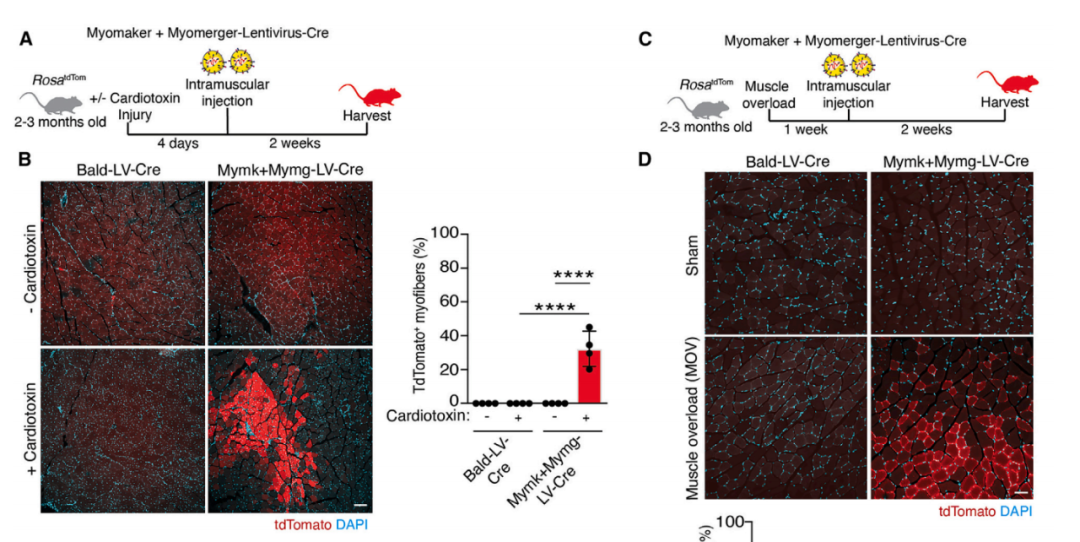
Mymk-Mymg包膜病毒载体在骨骼肌细胞上驱动膜融合
杜氏肌肉营养不良(DMD),是一种发病率相对较高的致命性神经肌肉遗传病,全世界每3500-5000名新生男婴中就有一人患上该单基因遗传病。具体病因是由表达抗肌萎缩蛋白(Dystrophin)的Dystrophin基因的2号外显子异常复制,基因疗法是治疗DMD的有效方法。
研究团队证明,在DMD小鼠模型中,局部和全身注射Mymk-Mymg包膜病毒载体,可以将优化后的微型抗肌萎缩蛋白(μDystrophin)基因特异性递送到骨骼肌中,并显着减轻了DMD小鼠的病理情况。
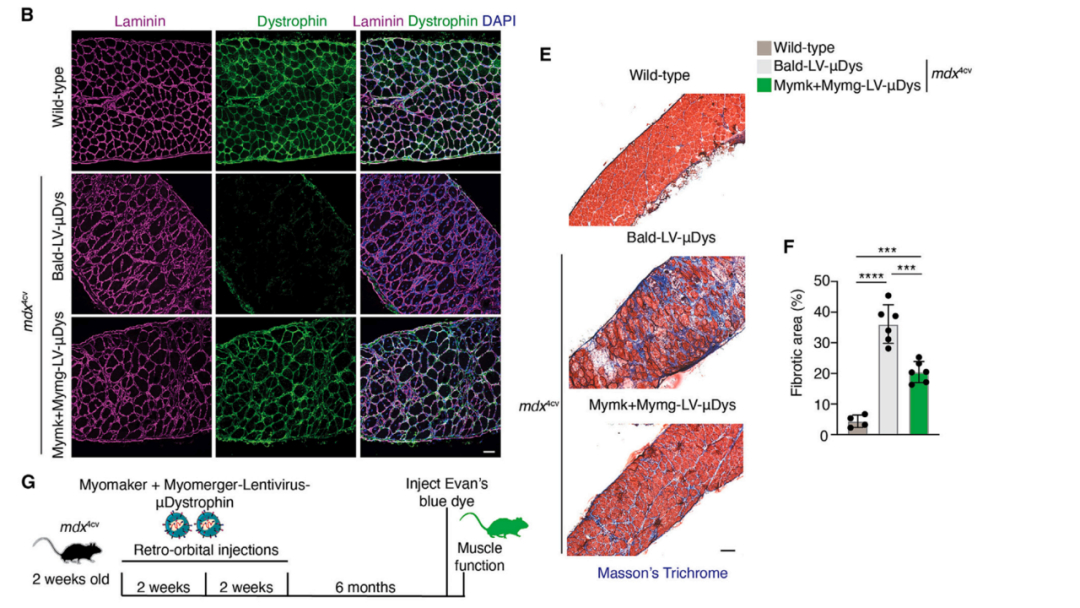
Mymk-Mymg包膜病毒载体将μDystrophin基因靶向到骨骼肌细胞中,改善DMD小鼠的病理情况
不仅如此,相比于腺相关病毒(AAV)载体的智能一次性给药,Mymk-Mymg包膜病毒载体可以重复给药,这允许在不同时间点增加基因治疗的剂量,并且该载体还表现出免疫逃逸,减少因发生免疫反应而导致的递送效率降低。
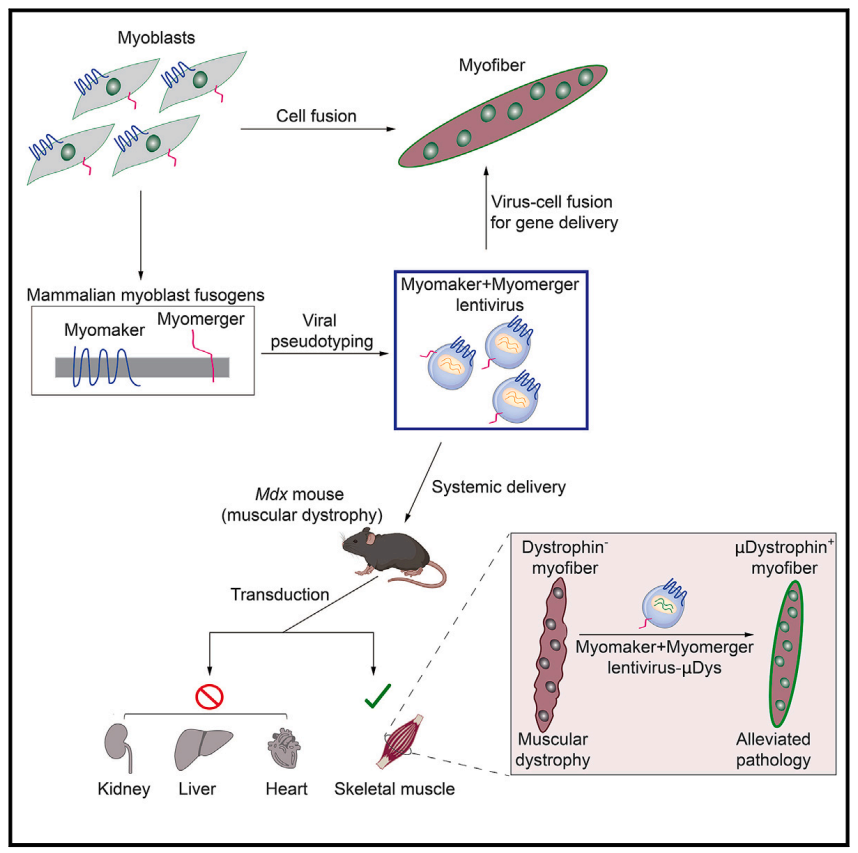
研究模式图
总而言之,这项发表在 Cell 的研究表明,骨骼肌细胞中的天然存在的细胞融合蛋白——Myomaker和Mymerger,可以构建到基于包膜病毒的基因治疗载体上,从而建立一类特异性靶向骨骼肌的专用递送载体,为针对肌肉疾病的基因治疗开辟新道路。
原始出处:
Sajedah M. Hindi, et al. Enveloped viruses pseudotyped with mammalian myogenic cell fusogens target skeletal muscle for gene delivery. Cell,April 18,2023.


