【JMC】JAK/HDAC双特异性抑制剂的设计,对恶性白血病和实体瘤有效
时间:2023-04-28 10:20:49 热度:37.1℃ 作者:网络
2023年4月14日,钱海研究员等人在Journal of Medicinal Chemistry 上发表了题为Exploration of Janus Kinase (JAK) and Histone Deacetylase (HDAC) Bispecific Inhibitors Based on the Moiety of Fedratinib for Treatment of Both Hematologic Malignancies and Solid Cancers的文章。作者设计合成了基于菲卓替尼部分的新型JAK/HDAC双靶向抑制剂。其中,化合物21和30在纳摩尔水平上有效地抑制了HDAC3/6和JAK1/2,并对一组76个激酶显示出对JAK2的极好的选择性。文章验证了JAK/HDAC双靶向抑制剂为血液系统恶性肿瘤和实体肿瘤的靶向治疗提供了有价值的线索。
表观遗传调控是肿瘤发生发展的重要调节因子,其中组蛋白脱乙酰酶(HDACs)通过去除多种蛋白质底物的乙酰化基团,改变DNA与蛋白质的相互作用,调节抑癌基因和DNA修复基因的表达,在诱导肿瘤细胞凋亡和分化中发挥关键作用。近年来,与表观遗传调控相关的组蛋白脱乙酰酶抑制剂(HDACi)已成为一种新的靶向肿瘤治疗模式,并在T淋巴细胞瘤和多发性骨髓瘤等血液系统恶性肿瘤的治疗中取得了令人满意的疗效。JAK是一个由JAK1、JAK2、JAK3和TYK2组成的非受体蛋白酪氨酸激酶家族。 JAK与细胞因子结合,通过诱导自身磷酸化使相邻的JAK多聚化和激活。激活的JAK使特定受体的尾部磷酸化,受体磷酸化部位招募STAT结合。与受体尾部结合的STATs也被JAK磷酸化,然后形成二聚体,转位到细胞核,从而驱动相关基因的表达。开发同时针对JAKs和HDACs的治疗剂是治疗恶性肿瘤的必要手段。
作者等人研究设计合成了27个新的2-氨基-4-苯氨基嘧啶类JAK/HDAC双靶点抑制剂(化合物7−33),有望提高单靶点药物的疗效,发挥双靶点抑制剂在血液系统恶性肿瘤中的协同作用,扩大实体瘤双靶点抑制剂的治疗范围。
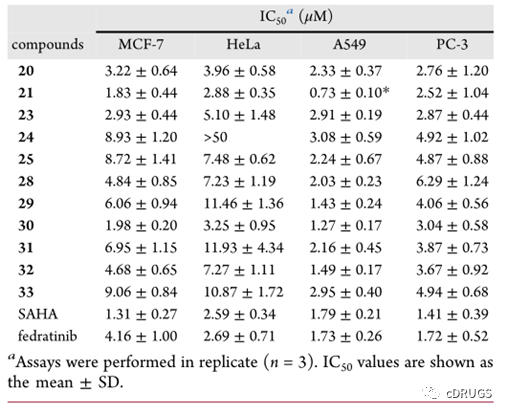
作者等人设计优化了一系列化合物7-33.并测试对JAK2和HDAC的体外抑制活性,发现化合物20,31对JAK2和HDAC均具有较好的抑制活性。
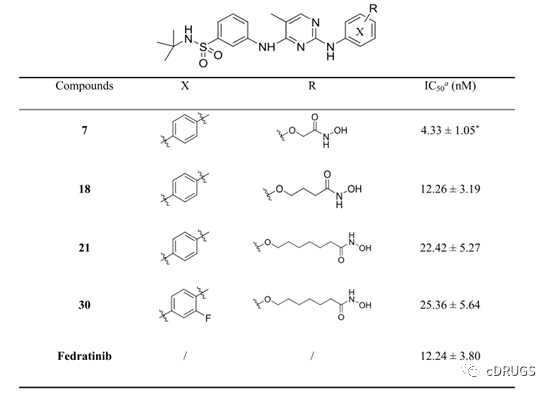
图1 化合物7、18、21和30的JAK2抑制活性
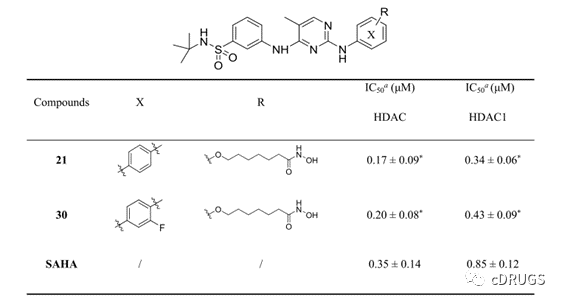
图2 化合物21和30的HDAC和HDAC1抑制活性
在JAK和HDAC活性的基础上,作者考察了化合物对血液系统恶性肿瘤细胞系和实体瘤细胞系的增殖抑制活性。探讨了具有代表性的化合物对三种血液系统恶性肿瘤(HEL、K562和HL-60)的抗增殖活性。化合物21(IC50值分别为1.87、2.26和0.33μM)和30(IC50值分别为1.22、3.37和0.24μM)具有最好的综合活性。此外,化合物21和30对HEL细胞的抑制作用尤为显著,其IC50值分别为0.33和0.24μM,均优于阳性参照物菲卓替尼(IC50=2.01μM),与阳性参照物SAHA相当(IC50=0.18μM)。
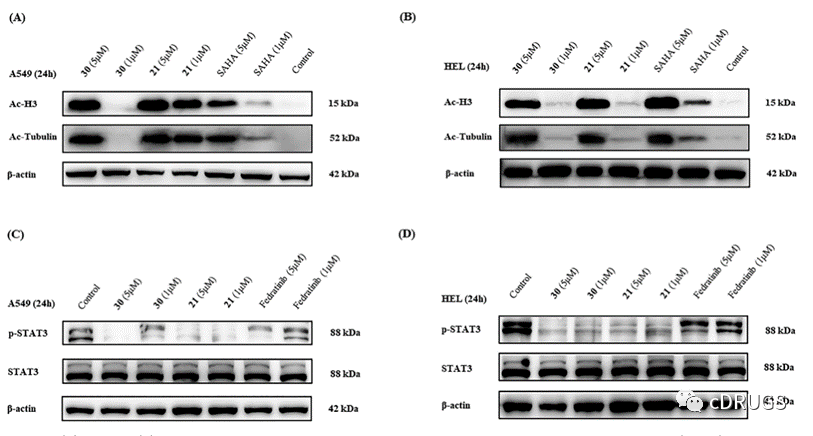
随后作者等人采用Western blotting方法验证JAK/HDAC双抑制剂的细胞内机制,图4A,C中的结果证实,化合物21和30明显上调A549细胞乙酰化H3和乙酰微管蛋白的表达水平,并呈剂量依赖关系,这表明化合物21和30对HDAC1/2/3和HDAC6信号通路有较强的阻断作用,同时降低了p-STAT3-Tyr705的表达水平。结果表明,JAK−STAT通路被强烈阻断,该通路调节相关基因的表达,从而抑制细胞增殖。同时,它们的HDAC抑制活性优于SAHA,JAK抑制活性优于菲卓替尼。为了探讨化合物21和30在血液系统恶性肿瘤中的双重作用,作者研究了化合物21和30对HEL细胞JAK和HDAC的抑制作用。图4B,D中的结果证实,与对照组相比,化合物21和30以剂量依赖的方式增加乙酰H3和乙酰微管蛋白的表达水平,同时降低p-STAT3Tyr705的表达水平。它们对HDAC的抑制作用与SAHA相当,对JAK的抑制作用优于菲卓替尼。上述结果表明,化合物21和30通过抑制HDAC和JAK而显著地抑制血液系统恶性肿瘤HEL细胞和实体瘤A549细胞的组蛋白去乙酰化和STAT3磷酸化,这表明化合物21和30具有JAK/HDAC双重抑制活性。
图4 (A)A549和(B)HEL细胞分别用化合物21和30在1和5μM作用24 h,用免疫印迹法检测乙酰H3(Ac-H3)和乙酰微管蛋白(Ac-α微管蛋白)的水平。(C)将化合物21和30分别作用于A549和(D)HEL细胞1和5μM,用免疫印迹法检测p-STAT3和STAT3的表达水平。
为了进一步探讨化合物21和30的抗肿瘤活性,作者等人用流式细胞仪检测了化合物21和30对HEL细胞和A549细胞的促凋亡活性,如图5。结果表明,化合物21和30具有明显的促凋亡作用,优于菲卓替尼,与SAHA相当,并表现出一定的浓度依赖性。化合物对A549细胞的促凋亡作用如图5B所示,结果表明,化合物21和30的促凋亡作用弱于菲卓替尼,与SAHA相当,并在一定程度上表现出浓度依赖性。总之,化合物21和30在HEL细胞中具有良好的促凋亡活性,在A549细胞中具有中等的促凋亡活性。
图5 (A)不同浓度的化合物21和30在作用24小时后诱导HEL细胞凋亡的效果。(B)不同浓度的化合物21和30作用36h后诱导A549细胞凋亡的效果。
随后作者等人用21和30分别在HEL和A549裸鼠移植瘤模型中进行了体内抗肿瘤活性的评价。结果如图6所示,化合物21和30显著降低了HEL和A549移植瘤的重量和体积,尤其是化合物21,其效果优于化合物30和SAHA与菲卓替尼的合用,而化合物30的抑制活性与SAHA和菲卓替尼的合用相当。从图6C、H可以看出,化合物21和30对体重没有显著影响,这意味着化合物21和30具有安全性。
图6 体内抗肿瘤实验 (A)肿瘤重量,(B)肿瘤体积,(C)原始体重百分比,(D)照片图像;(E)Ac-H3,Ac-tubuin,p-STAT3,和STAT3在HEL移植瘤组织中的表达水平;(F)肿瘤重量,(G)肿瘤体积,(H)原始体重百分比,和(I)照片图像;(J)A549移植瘤组织中Ac-H3、Ac-微管蛋白、p-STAT3和STAT3的表达水平。
在这项工作中,作者等人综述了JAK、HDAC及其抑制剂的研究进展,并总结了JAK/HDAC双靶点抑制剂的优势和前景。首次将菲卓替尼的2-氨基-4-苯氨基嘧啶与SAHA的异羟甲酸烷基酯融合,设计合成了27个新型JAK/HDAC双靶向抑制剂。对所有化合物的生物活性和结构−活性关系进行了探讨。其中,化合物21和30对JAK1/2、HDAC和HDAC3/6有明显的抑制作用,对JAK2有明显的选择性。化合物21和30具有明显的抗肿瘤增殖和促凋亡作用,其机制可能是通过改变JAK-STAT和HDAC途径相关蛋白的表达来实现的。重要的是,化合物21和30显示出协同的抗肿瘤效果。综上所述,化合物21和30对血液系统恶性肿瘤和实体瘤中的JAK和HDAC具有双重抑制活性。有望克服HDACi治疗实体瘤疗效差的缺点。为JAK/HDAC双靶点抑制剂的开发提供了理论依据。
原文链接:https://doi.org/10.1021/acs.jmedchem.3c00036