Clin Transl Med:沈琳团队发现乳酸菌可能促进胃癌免疫疗法疗效
时间:2023-07-10 07:09:33 热度:37.1℃ 作者:网络
导读:转移性/不可切除的HER2阴性胃癌的常见治疗方法包括化疗、免疫检查点抑制剂单药治疗和化疗加免疫检查点抑制剂。然而,无论哪种治疗方案,都存在明显的耐药性。本研究纳入了117名HER2阴性的晚期胃癌或胃食管交界处腺癌患者,他们分别接受了单纯化疗、单纯抗PD-1/PD-L1免疫治疗或联合治疗方案。乳酸菌相对丰度较高的患者拥有更高的微生物组多样性,对抗PD-1/PD-L1免疫疗法的反应明显更好,并有获得更好的无进展生存期的趋势。另一个由101名患者组成的队列已被用作外部验证集,以确认这些发现的稳定性和可靠性。
6月28日,来自北京大学的彭智和沈琳团队在《Clinical and Translational Medicine》上发表了名为“The gut microbiome affects response of treatments in HER2-negative advanced gastric cancer”的研究文章,文章通过分析接受不同治疗的患者在基线和整个治疗过程中的肠道微生物组特征,发现在癌症治疗和管理中考虑肠道微生物组的重要性。

https://doi.org/10.1002/ctm2.1312
对于HER2阴性的晚期胃癌或胃食管交界处(GEJ)腺癌,基于铂金、氟尿嘧啶和紫杉醇的化疗是过去几十年来最有效的治疗方法。然而,该疗法的效果有限。随着免疫检查点抑制剂(ICI)的临床应用,胃癌的治疗策略发生了革命性变化。然而,总反应率(ORR)只有11%-15%。只有那些罕见的亚型的患者可能从这种治疗中受益。这意味着大多数患者很难从ICI单药治疗中获益。此外,如何克服ICI的耐药性也是一个关键的临床问题。化疗加ICI是一个可行的方法,可以部分克服药物耐药。在CheckMate 649试验中,联合治疗策略在程序化死亡配体1(PD-L1)联合阳性评分≥5分的患者中显示了更好的临床获益。虽然CheckMate 649试验取得了积极的结果,但反应和生存率并没有达到预期。参与调控化疗加免疫疗法的抗性的因素仍不清楚。
肠道微生物组和免疫系统之间的相互作用在癌症患者对免疫疗法和化疗的反应中起着关键作用。在黑色素瘤中已经显示,肠道微生物组可以通过介导CD8+T细胞的浸润来改变肿瘤微环境,从而直接影响到对抗PD-1/PD-L1免疫疗法的反应。此外,一些研究表明,肠道微生物组的组成,特别是某些细菌种类(如核酸镰刀菌),可以影响宿主对化疗的反应。
在我们以前的研究中,我们证明普雷沃特氏菌/细菌的比例与胃肠癌的ICI耐药性有关,而这种趋势在胃癌或GEJ癌中并不明显。基于此,我们进一步操作了一项前瞻性队列研究,招募接受ICI单药治疗、标准化疗或化疗加ICI治疗的患者。为了更准确地揭示肠道微生物组与胃癌疗效之间的相关性,我们首先研究了每种治疗方式下反应者和非反应者的微生物特征和差异,并探讨了这些微生物组的时间变化。此外,我们还调查了这些微生物群与无进展生存期(PFS)之间的相关性。有趣的是,我们发现在发现和验证队列的所有分析中,乳酸菌始终与应答者相关,包括差异分析、时间分析和生存分析。我们进一步探讨了具有高丰度乳酸菌的个体的微生物特征。
研究过程
为了调查癌症患者的肠道微生物群和治疗反应之间的关系,我们分析了每种治疗方式的反应者和非反应者的微生物特征,包括化疗、免疫治疗和ICI加化疗。我们还探讨了这些微生物群在治疗过程中的时间变化。此外,鉴于PFS是癌症患者的一个关键临床结果,我们研究了这些微生物与无进展生存期(PFS)之间的相关性。
在ICI单药治疗组应答者中富含的微生物分类群中,我们观察到粘液杆菌和唾液杆菌与免疫治疗患者的良好反应有关。PFS获益与乳酸菌的丰富程度之间存在明显的相关性,这在外部验证队列中得到了进一步验证。时间序列结果证实了这种关联,显示乳酸菌的丰度,特别是粘液杆菌的丰度在应答者中不断富集,而在无应答者中则被耗尽。在我们以前的研究中,乳酸菌被证明与消化道泛癌患者的抗PD-1/PD-L1治疗效果有关。乳酸菌使免疫治疗获益的机制似乎很复杂,有待于理解。以前对鼠李糖乳杆菌GG(LGG;)的研究显示其通过诱导cGAS/STING依赖的I型干扰素具有免疫激活作用。其他对嗜酸乳杆菌606的研究显示其通过分泌可溶性多糖具有抗癌作用。此外,我们观察到乳酸菌相对丰度高的患者呈现出较高的α-多样性,并倾向于从免疫疗法中获益。因此,乳酸菌可能有助于通过介导更多样化的肠道微环境来间接提高免疫疗法的疗效。在化疗加ICI组中,乳酸菌也被发现在外部验证队列的反应者中明显富集,乳酸菌丰度较高的患者也拥有较高的α-多样性。以前有报道说,在恶性黑色素瘤15和非小细胞肺癌患者中,较高的α-多样性与较好的反应呈正相关。除了乳酸菌,还发现了与免疫疗法有关的其他微生物。
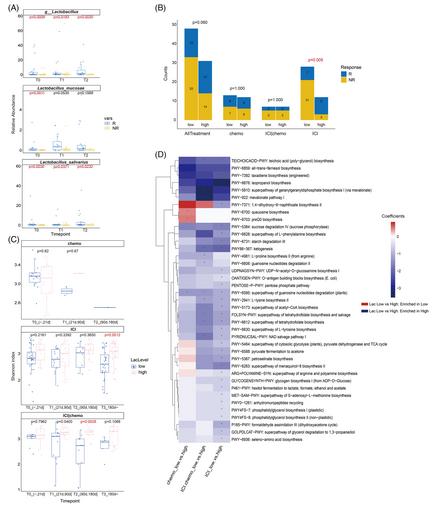
ICI和传统的抗肿瘤方案(如化疗)相结合是临床实践中常见的策略,目前还不清楚这些联合策略是否具有协同抗肿瘤作用,或只是简单的叠加。在我们的队列中,我们发现接受ICI加化疗的患者具有与ICI或单独化疗不同的反应相关的微生物组特征。具体来说,我们发现反应者的链球菌丰度明显低于非反应者。唾液链球菌和副血链球菌之间的丰度差异是最重要的,携带高丰度的链球菌的患者的PFS明显缩短了。链球菌的改变以前与胃癌和肝转移有关。关于胃癌,链球菌已被证明与萎缩和肠道化生的出现和持续有关。对肿瘤抑制基因的靶向分析显示,链球菌的存在与MLH1启动子高甲基化明显相关,这促进了肿瘤的进展。总之,大量的链球菌不仅可能促进胃癌的发生,也会影响癌症的治疗效果,这可能是癌症诊断和/或病人分层的潜在生物标志物。
研究结论
我们研究的新颖之处在于调查了肠道微生物群与不同胃癌治疗方式的疗效之间的关系,这在以前还没有得到广泛的探讨。虽然化疗以前是胃癌的主要治疗方法,但最近的研究表明,一些患者可以从单独的免疫治疗中受益。通过对三种不同的治疗方法进行综合比较,我们的研究评估了与联合治疗方案相关的肠道微生物群是否与免疫治疗或单独化疗相关的微生物群相重叠。这一分析可能有助于从肠道微生物群的角度阐明联合治疗在发挥抗肿瘤作用方面的独特作用模式。
随着这些发现在外部验证队列中的进一步验证,本研究提供了一套全面的概况,将三种主要的胃癌治疗方案的疗效与患者肠道微生物群中特定细菌分类群的丰度不同联系起来。我们的研究显示,肠道微生物组可能是临床常见胃癌治疗方案反应的潜在预测性生物标志物,并在此为新兴的粪便微生物群移植的辅助治疗提供了坚实的基础。尽管这些发现提供了有价值的见解,但仍需要进一步深入的机理探索,以充分了解其背后的生物机制并确定因果关系。总的来说,我们的研究为癌症患者的肠道微生物群和治疗反应之间的关系提供了重要见解。我们的研究结果表明,乳酸菌可能是这一关系中的一个关键角色,针对乳酸菌和其他有益细菌可能有望改善癌症患者的治疗效果。这些结果还强调了在癌症治疗和管理中考虑肠道微生物组的重要性,并表明基于微生物组的干预措施可能是改善患者结果的一个有希望的途径。
参考资料:https://doi.org/10.1002/ctm2.1312
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。


