Science:微生物与癌症
时间:2021-03-30 09:01:31 热度:37.1℃ 作者:网络
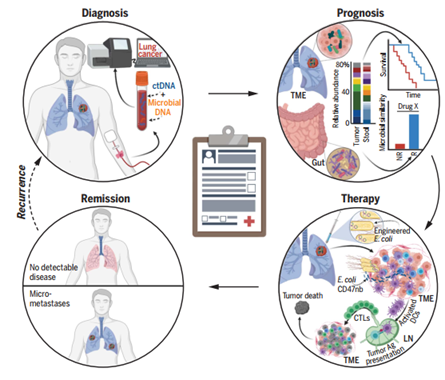
微生物影响癌症治疗的机会。诊断:癌症特异性、血液传播的微生物DNA可能补充无细胞肿瘤DNA(CtDNA)。预后:肠道和瘤内微生物区系可能会影响患者的预后(NR,无反应;R,有反应;TME,肿瘤微环境)。治疗:瘤内注射产生CD47纳米体(CD47nb)的大肠杆菌可通过增强树突状细胞(DC)吞噬功能、淋巴结(LN)抗原(Ag)提呈和细胞毒性T淋巴细胞(CTL)活性而产生系统抗肿瘤免疫。
将癌症和微生物联系起来的历史记载最早可以追溯到4000年前。在传染病的细菌理论建立后,微生物对癌症影响的临床研究始于1868年,当时William Busch报道了化脓性链球菌感染患者的自发肿瘤消退。在接下来的一个世纪里,糟糕的重复性、错误的微生物学声明和严重的毒性导致许多人低估了细菌在致癌和癌症治疗中的作用。然而,这些研究提供了癌症免疫疗法的第一个粗略演示。与此同时,在1911年发现劳斯肉瘤病毒的推动下,癌症的病毒理论蓬勃发展。劳斯肉瘤病毒使鸡的良性组织转变为恶性肿瘤。长达数十年的寻找每一种人类癌症背后的病毒的努力最终都以失败告终,许多癌症都与体细胞突变有关。现在,该领域遇到了一些耐人寻味的说法,称包括细菌和真菌在内的微生物在癌症和癌症治疗中的重要性。Gregory D. Sepich-Poore等Science发表综述。

这篇综述从现代癌症生物学和免疫学的角度对这一证据进行了批判性的评估,通过检查提出的机制、诊断和调控策略的进展来描述微生物在癌症中的作用。
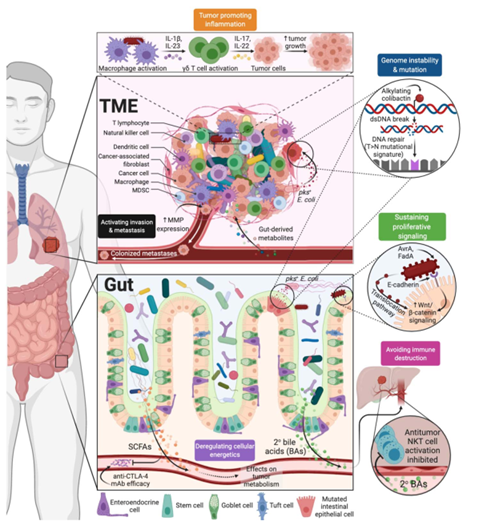
微生物机制与癌症特征的交叉例子。微生物来源的代谢物、基因毒素和抗原影响宿主的抗肿瘤免疫、炎症、能量学、细胞信号传导和转移。
很少有微生物直接导致癌症,但许多微生物似乎参与了癌症的生长,通常通过宿主的免疫系统起作用;相反,有几种微生物具有免疫刺激特性。肠道微生物-免疫系统相互作用的机制分析表明,通过调节初级和次级淋巴组织的活动,对抗肿瘤免疫有很强的作用。这些途径中的许多都调用Toll样受体启动的细胞因子信号,但微生物代谢效应和与癌细胞的抗原模拟也很重要。在临床前模型中,微生物代谢物还调节肿瘤体细胞突变的表型,并调节免疫检查点抑制剂的疗效。
新的证据表明,肿瘤内细菌存在并活跃,免疫组织化学、免疫荧光、电子显微镜和测序数据在大约10种癌症中重叠。初步研究进一步表明真菌和噬菌体会导致胃肠道癌症。然而,与癌细胞相比,肿瘤内微生物细胞的丰度较低,对其功能谱系和效力的了解仍然有限。需要在不同的队列和治疗环境中进一步验证它们的流行率和影响。
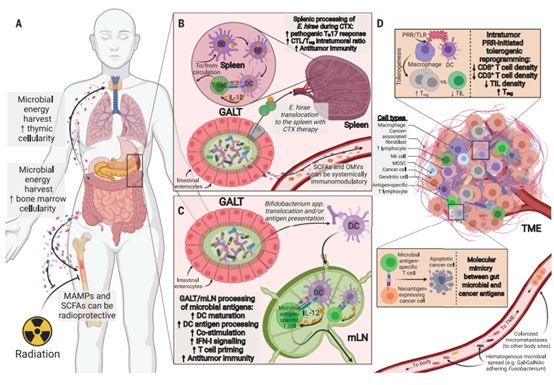
定义IOM轴。肠道和TME微生物群调控宿主的代谢和免疫,最终影响抗肿瘤免疫。(A)肠道微生物代谢产物和副产物影响宿主的淋巴和骨髓生成,包括异基因造血干细胞移植和放疗期间。(B)环磷酰胺(CTX)引起的肠道上皮损伤可使E. hirae易位和抗肿瘤免疫(689,69)。(C)双歧杆菌或其抗原的肠道易位可增加IFN-I信号通路和抗肿瘤免疫。(D) TME中的微生物既可以是免疫抑制的(通常是prr介导的),也可以是免疫原性的,包括形成对免疫治疗的反应。癌症(neo)抗原可能通过分子拟态与微生物共享抗原表位。微生物血行播散或定殖微转移可能完成这个源自肠道的反馈回路。
宿主微生物区系的免疫调节作用重振了改变其组成作为免疫疗法的一种形式的努力。尽管有广泛的临床前证据,但将微生物区系调节方法转化为人类尚未实现商业化治疗。合成生物学方法也正在获得吸引力,工程细菌癌症疗法正在临床前和临床试验环境中。
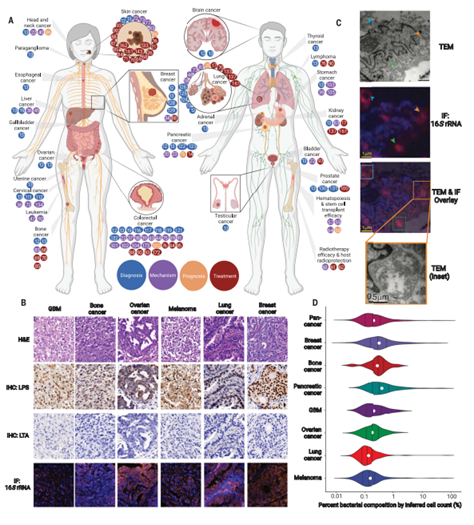
癌症微生物群的现状。(A)目前与微生物区系有关的所有癌症的身体示意图,其中彩色圆点反映参考号,并根据参考论文的主要主题(诊断、机制、预后或治疗)进行着色。DOTS是基于现有的临床前和临床数据纳入的。(B)6例癌组织的代表性组织学、脂多糖(LPS)和脂磷壁酸(LTA)的免疫组化(IHC)和细菌16S rRNA的免疫荧光(IF)。(C)乳腺癌细胞内细菌(箭头)16SrRNA免疫荧光的典型透射电子显微镜(TEM)图像。(D)假设组织同质性和每个癌细胞的DNA含量为8pg,估计七种癌症类型中的肿瘤细菌成分百分比。黑线表示分布分位数(25%-50%-75%);白点表示平均值。(B)至(D)中的图像改编自Nejman等人。

调节内源性癌症微生物群时的考虑因素。饮食、药物和益生菌、后生菌、益生菌和抗生素都有能力改变肠道和肿瘤微生物群。这些微生物群与癌症治疗(化疗和免疫治疗)之间可能存在双向影响。例如,化疗可以引起肠道微生物群的组成变化,进而提高治疗效果;在其他情况下,化疗可能会被微生物降解。因此,肠道和/或肿瘤微生物群的修饰对于一种治疗方式可能是有利的,而对另一种治疗方式是不利的。虚线箭头表示文献中的空白。
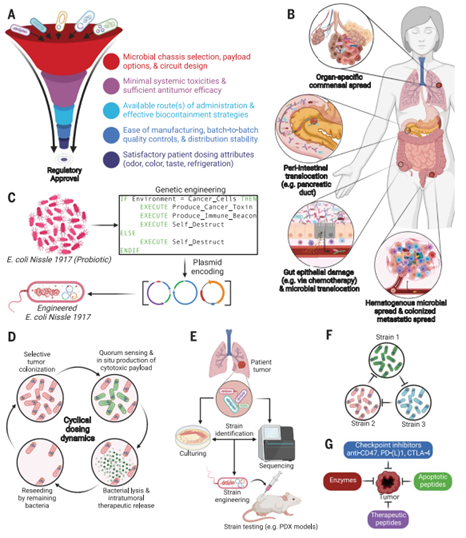
外源性癌症治疗的合成生物学。(A) 工程细菌对抗癌症的调控考虑。(B)肿瘤内细菌的不同来源包括器官特异性共生、肠道沟通、血源性扩散和转移内扩散。(C)一些益生菌,如大肠杆菌Nissle 1917,具有很强的安全性记录,在动物模型中被证明可以自然迁移到实体肿瘤,并且可以被编程在实体肿瘤内生产和提供疗法。(D)可以设计复杂的人口动态,以产生治疗药物的周期性递送。(E)未来的努力可能集中在设计和测试在特定患者肿瘤中自然发现的菌株上。PDX,病人来源的异种移植。(F)工程生态可以被设计成产生量身定做的、肿瘤特异性的治疗鸡尾酒。(G)多种药物有效载荷可由一个或多个抗肿瘤工程菌株编码
更好地了解微生物在癌症中的作用为改善癌症护理周期的每个阶段提供了机会,但主要挑战依然存在。在肿瘤、粪便和血液样本中通过黄金标准的污染控制来确定与癌症相关的微生物区系的共同努力将极大地帮助这一进展。这将类似于癌症基因组图谱在描述癌症体细胞突变图景方面的作用。大规模的临床试验目前正在测试微生物区系调节方法的有效性,范围从改变饮食到瘤内注射工程菌。这些细菌癌症疗法,如果安全有效,可能会极大地扩大癌症治疗的范围。
总之,整合以宿主为中心和以微生物为中心的癌症观点可能会改善患者的预后,同时提供对癌症宿主-微生物进化的细微差别的理解。
原文出处:
Sepich-Poore, G. D., Zitvogel, L., Straussman, R., Hasty, J., Wargo, J. A., & Knight, R. (2021). The microbiome and human cancer. Science (New York, N.Y.), 371(6536), eabc4552. https://doi.org/10.1126/science.abc4552


