NAT MED:反义寡核苷酸疗法改善遗传性视网膜疾病患者视力:病例报告
时间:2021-04-14 22:01:56 热度:37.1℃ 作者:网络
遗传性视网膜疾病(IRD)是一组由300多种单基因突变导致的遗传性眼部疾病,全球发病率为1:1,000。目前只有一种IRD形式是可以治疗的,此外,针对其余IRD的几十种遗传疗法正在评估中,其最终目标是改善视力,并以可接受的治疗干预次数和优化的患者负担来持久地改善视力。
已知的最严重的IRD形式之一是Leber先天性黑矇(LCA),这是一种可以导致患者儿童期失明的疾病。三分之一的LCA患者存在的主要分子病理是由于控制光感受器内段(ISs)和外段(OSs)之间交通的睫状体过渡区蛋白突变所致。最常见的LCA纤毛病是由CEP290(Centrosomal protein 290)的突变引起的。
越来越多的研究表明,在一个广泛的年龄窗口,CEP290-LCA中保留但功能障碍的蜂窝锥体感光受体可以保持足够的后受体连接,从帮助患者接受干预策略,并改善视力。

目前,人们正在探索用反义寡核苷酸(AON)来治疗由CEP290纤毛病引起的Leber先天性黑矇。研究人员通过拼接修饰来纠正一种常见的c.2991+1655A>G(p.Cys998*)CEP290突变,设计了一种17-mer 2′-O-甲基修饰的硫代磷酸酯RNA AON,sepofarsen,来治疗该突变导致的疾病,并进行了临床试验(ClinicalTrials.gov NCT03140969)。一名属于较大队列的患者接受了单次玻璃体内注射sepofarsen的治疗,而后进行了15个月的研究。
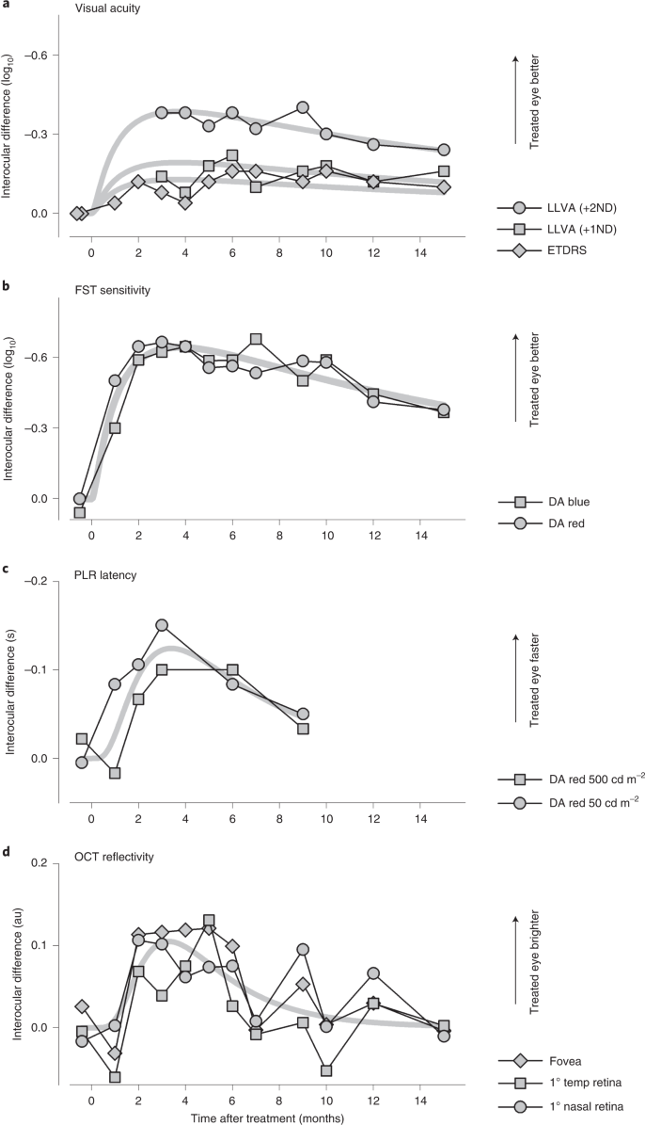
单次治疗后15个月内视力改善情况
结果显示,患者的视觉功能和视网膜结构的协调测量在注射后3个月附近达到了一个实质性的疗效高峰。在15个月时,尽管有证据表明从峰值反应减少,但仍有持续的疗效。
疗效动力学可以通过AON驱动的新的CEP290蛋白合成和人蜂窝锥体光感受器中CEP290蛋白自然降解的缓慢速度的平衡来解释。
原始出处:
Artur V. Cideciyan et al. Durable vision improvement after a single treatment with antisense oligonucleotide sepofarsen: a case report. NATURE MEDICINE (2021).


