Nat Commun:单核细胞中昼夜节律钟基因改变是慢性肾病介导的心脏炎症和纤维化的基础
时间:2021-06-01 23:01:44 热度:37.1℃ 作者:网络
慢性肾病(CKD)会影响其他器官的功能,从而导致心血管疾病和脑神经紊乱等并发症。心力衰竭是CKD患者的一个主要心血管并发症,其患病率随着肾功能下降而增加。此外,超过40%的慢性心力衰竭患者也患有CKD。这些临床观察均表明了心脏和肾脏之间存在着重要的病理生理学联系。
在CKD的发生发展过程中,高血压通常是由体液膨胀和肾素-血管紧张素-醛固酮系统 (RAAS) 的激活所引起的。尽管CKD引起的高血压与心血管发病率和死亡率的风险升高密切相关,但几种体液和细胞免疫反应也与 CKD的心血管并发症相关。
既往研究显示,昼夜节律钟的功能障碍已被认为与心血管疾病的发病机制相关。CLOCK蛋白是昼夜节律振荡器的核心分子组成成分,因此携带有Clock基因突变(Clk/Clk)的小鼠也在许多生理过程中表现出异常的节律。
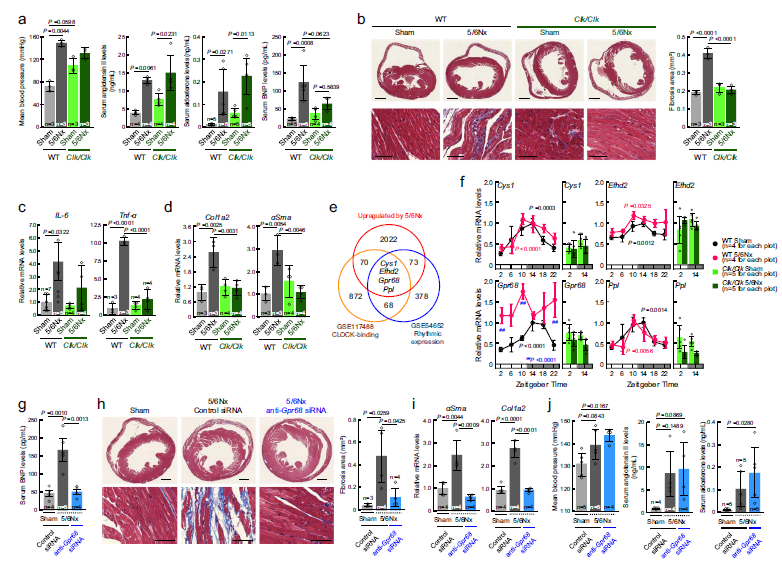
在该研究中,研究人员发现在Clk/Clk小鼠中,CKD引起的心脏炎症和纤维化得到了缓解,即使其具有高血压和血清中血管紧张素II的高水平。
Clock基因突变抑制5/6Nx小鼠的心脏并发症
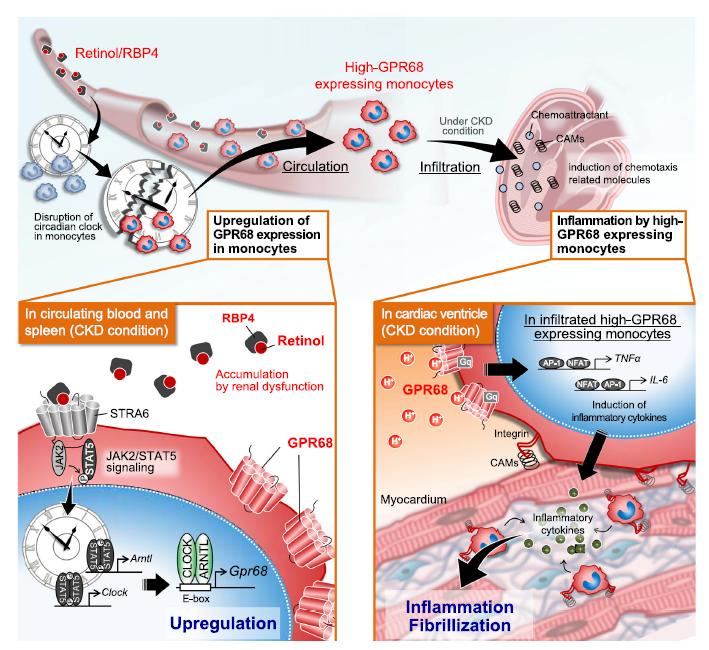
通过在Clk/Clk小鼠中进行5/6肾切除术(5/6Nx)以及减轻心脏疾病,研究人员发现,在单核细胞中表达的GPR68(G蛋白偶联受体68)是CKD介导的心脏炎症和纤维化的一大危险因素。
5/6Nx可通过增加血清视黄醇及其结合蛋白RBP4的水平来改变CLOCK的活性,从而在单核细胞中诱导GPR68的表达。高表达GPR68的单核细胞具有产生炎性细胞因子的潜力,且在CKD条件下上述因子的心脏浸润会加剧了心脏炎症和纤维化。进一步的研究发现,CKD患者的血清视黄醇和RBP4水平也足以诱导单核细胞中GPR68的表达。
相关研究示意图
综上,该研究结果主要揭示了在CKD诱发的心力衰竭中单核细胞Clock基因的新功能。
原始出处:
Yoshida, Y., Matsunaga, N., Nakao, T. et al. Alteration of circadian machinery in monocytes underlies chronic kidney disease-associated cardiac inflammation and fibrosis. Nat Commun 12, 2783 (13 May 2021).