J Hematol Oncol :我国首个不限瘤种PD-L1快要来了, 晚期实体瘤患者精准治疗新选择!
时间:2021-07-07 06:02:12 热度:37.1℃ 作者:网络
2021年6月,国际著名肿瘤学术期刊《血液学与肿瘤学杂志》(Journal of Hematology & Oncology)发表了一篇由中国研究者开展的免疫治疗药物临床II期研究数据。

其中两大亮点引发广泛关注:
一,研究药物恩沃利单抗有望成为中国自主研发的全球首个可皮下注射的PD-L1单抗。其在中国的上市申请已获得国家药监局优先审评资格。
二,该临床研究的适应证不是按照瘤种,而是一种生物标志物——高度微卫星不稳定/错配修复缺陷(dMMR/MSI-H)。在dMMR/MSI-H的各类实体瘤中,恩沃利单抗均展现出良好的疗效和安全性,因此其有望成为中国首个不限瘤种PD-L1抗体药物。
以生物标志物为标准的癌症疗法前景如何?与已上市的的PD-(L)相比,恩沃利单抗又有哪些不同?本文将为您进行解读和梳理。
免疫治疗?检测先行!
肿瘤的发生发展与人体自身免疫系统的功能息息相关。免疫细胞表面存在一种“刹车分子”,叫作免疫检查点,“踩下刹车”就可以抑制免疫细胞的激活,这一生理性结构是保持人体免疫系统平衡的重要因素,但聪明的癌细胞却同样也会利用它来逃过免疫细胞的追杀,从而在体内“茁壮成长”。因此,从另一个角度来说,如果能阻止肿瘤细胞“踩刹车”,那就可以让免疫系统恢复正常工作,击杀肿瘤细胞,治疗疾病……2018年,诺贝生理学或医学奖就颁给了发现这一机制的两名科学先驱,而阻止肿瘤细胞“踩刹车”的疗法也应运而生,这就是以PD-(L)1代表的免疫检查点抑制剂(ICIs)。
免疫检查点抑制剂前所未有的延续了癌症患者的生命,但它的疗效却受到了一定的制约:并不是所有患者免疫检查点抑制剂的治疗中获益。这是因为这一疗法作用机制与传统的化疗、靶向治疗不同,是通过激活人体自身的免疫系统来杀伤肿瘤,因此只对能够产生有效免疫应答的患者有效,而这个比例在PD-(L)1单药使用时约为20%~40%,也就是仅三成左右的患者能产生反应。
这也就意味着,使用PD-(L)1的前需要识别出那些能够产生有效应答患者,以避免盲目用药。在临床上,筛选这些潜在获益人群的手段是检测免疫治疗疗效预测的生物标志物(biomarks)。
经过科学家的一番探索后,在免疫检查点抑制剂治疗中,目前检测比较广泛的是PD-L1(程序性细胞死亡蛋白1的配体)表达,主要应用在肺癌中。但PD-L1有其局限性:一方面,PD-L1在其他肿瘤类型中的作用还不确定;另一方面,PD-L1还不够精准:虽然PD-L1表达阳性提示有效,但PD-L1阴性也并不排除潜在获益的可能。因此在PD-L1之余,研究人员仍然在探索其他更好的生物标志物。
MSI-H/dMMR——精准免疫治疗的新标杆
微卫星 (Microsatellite) 是遍布于人类基因组中的短串联重复序列。与正常细胞相比,肿瘤细胞内的基因由于插入和缺失突变,微卫星长度会发生改变,从而导致微卫星不稳定性(MSI)的现象。根据不稳定的程度,MSI又可分为高度不稳定(MSI-H)、低度不稳定(MSI-L)及稳定(MSS)。
早在1993年,文献就首次报道了在结直肠癌(CRC)存在微卫星不稳定,开启了MSI的探索先河。目前,除结直肠癌外,科学家们还发现MSI-H现象存在于多种实体瘤中,包括子宫内膜癌(20%~30%)、胃癌(15%~20%)等。
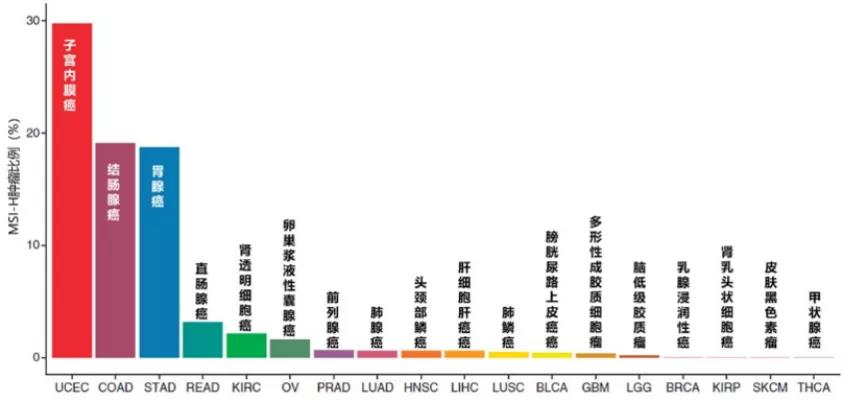
MSI的意义在于,它的发生与一种错配修复基因缺陷(dMMR)有关,这种基因缺陷会导致细胞的基因组出现高频突变,从而造成癌变风险增加,因此MSI具有重要的临床价值。
多项临床研究已证实,MSI-H/dMMR的实体瘤患者在接受免疫检查点抑制剂治疗时有显着获益。更进一步的研究显示,患者能否从免疫检查点抑制剂治疗中受益,关键要看MSI-H,而不是具体的癌种。
基于MSI-H/dMMR在肿瘤免疫治疗中强烈的疗效预测价值,检测MSI状态及相应的免疫疗法在多项国内外指南中推荐等级接连得到提升。
今年,美国国立综合癌症网络(NCCN)发布的胃癌和结肠癌两大指南均对MSI-H/dMMR免疫获益人群的诊疗进行了更新。其中,胃癌指南建议所有新诊断的胃癌患者都应该进行MSI或MMR的检测。结肠癌指南则新增了纳武利尤单抗±伊匹木单抗(O±Y)或帕博利珠单抗(优选)用于MSI-H/dMMR患者的术后辅助治疗,以及适合高强度化疗、不可手术切除的晚期或转移性结肠癌的一线治疗。这意味着免疫治疗打破了结肠癌中化疗±靶向的一线独揽地位,患者有了更多新选择。
2021年,中国临床肿瘤学会(CSCO)的结直肠癌诊疗指南在晚期结直肠癌患者的治疗中把MSI-H/dMMR患者单独列出,无论一线、二线还是三线治疗,均推荐PD-1单抗,免疫治疗地位进一步提升。
我国首个MSI-H/dMMR适应症的纳米PD-L1即将获批
2017年,美国食品药品监督管理局(FDA)批准了首款不针对肿瘤类型,而是MSI-H/dMMR的抗肿瘤疗法(帕博利珠单抗),让MSI正式走入临床实践。
在我国,今年国家药品监督管理局批准了中国首个基于“多重荧光PCR-毛细管电泳法”的微卫星不稳定(MSI)检测试剂盒,使得MSI再次成为免疫治疗的关注重点。
时至今日,虽然我国已上市的PD-(L)1中还没有一款获批了MSI-H/dMMR适应证,但这在不远的未来将会成为现实——我国自主研发的PD-L1抑制剂恩沃利单抗注射液在2020年11月向国家药监局提交了新药上市申请,用于治疗既往标准治疗失败的MSI-H/dMMR晚期结直肠癌、胃癌及其他实体瘤。该上市申请已被纳入优先审评,有望引领中国MSI-H/dMMR实体瘤领域的免疫治疗。此外,该药物此前还获得了美国FDA关于治疗胆道癌和软组织肉瘤的两项孤儿药认定。
与目前已经上市及在研的PD-(L)1抑制剂相比,恩沃利单抗的独特之处在于它是一种纳米抗体,兼具了传统抗体与小分子药物的优势:分子量小、水溶性高、稳定性高、组织穿透力强,从而表现了出不俗的抗肿瘤疗效和安全性:
在中国MSI-H/dMMR晚期实体瘤患者中开展的的II期临床试验中,恩沃利单抗治疗二线以上患者的客观缓解率(ORR)为42.7%,中位无进展生存期为11.1个月,1年总生存率为74.6%。在安全性上,免疫相关性不良事件(irAE)发生率和发生情况与同类产品相似。
恩沃利单抗另一大优势在于,它有着国际上独一无二的皮下注射给药方式,无输注反应,可用于不适合静脉输液的患者,用药更加方便。
基于这种独特的机制和剂型,相信在不久的将来,恩沃利单抗将为中国MSI-H/dMMR晚期实体瘤患者带来新的治疗选择和生存希望,同时也将引领中国肿瘤免疫治疗朝精准治疗时代更进一步。
原始出处:
Tang, B., Yan, X., Sheng, X. et al. Safety and clinical activity with an anti-PD-1 antibody JS001 in advanced melanoma or urologic cancer patients. J Hematol Oncol 12, 7 (2019). https://doi.org/10.1186/s13045-018-0693-2.


