晚期、复发、转移性宫颈癌的靶向与免疫治疗
时间:2021-09-22 14:01:58 热度:37.1℃ 作者:网络
2014 年美国食品和药物管理局 (FDA)基于GOG-240批准了抗血管生成药物贝伐珠单抗联合化疗用于晚期和转移性宫颈癌,OS较单独化疗提高3.5 个月 。近年来,人们开始转向开发分子靶向和免疫治疗药物,以延长癌症患者亚群的生存时间。
本文总结了目前正在探索的主要靶向药物,回顾宫颈癌对靶向治疗的反应率。最近的一项3期试验显示,在铂类化疗进展后,使用cemiplimab单药治疗复发或转移性宫颈癌的OS得到改善。在此重点讨论特定致病变异的生物单克隆抗体(MAb)、酪氨酸激酶抑制剂(TKIs)、EGFR、HER2、PI3K/Akt/mTOR通路和DNA损伤修复通路、抗血管生成剂以及其他早期研究药物。不对PD-L1、PD-1和CTLA-4的免疫治疗和免疫调节剂进行讨论。
抗血管生成药物
宫颈癌预后不良和早期复发与VEGF表达增加有关。抗血管生成药物不仅可以促进肿瘤细胞凋亡,还可以使肿瘤血管“正常化”,从而增加氧和药物向肿瘤微环境的输送。
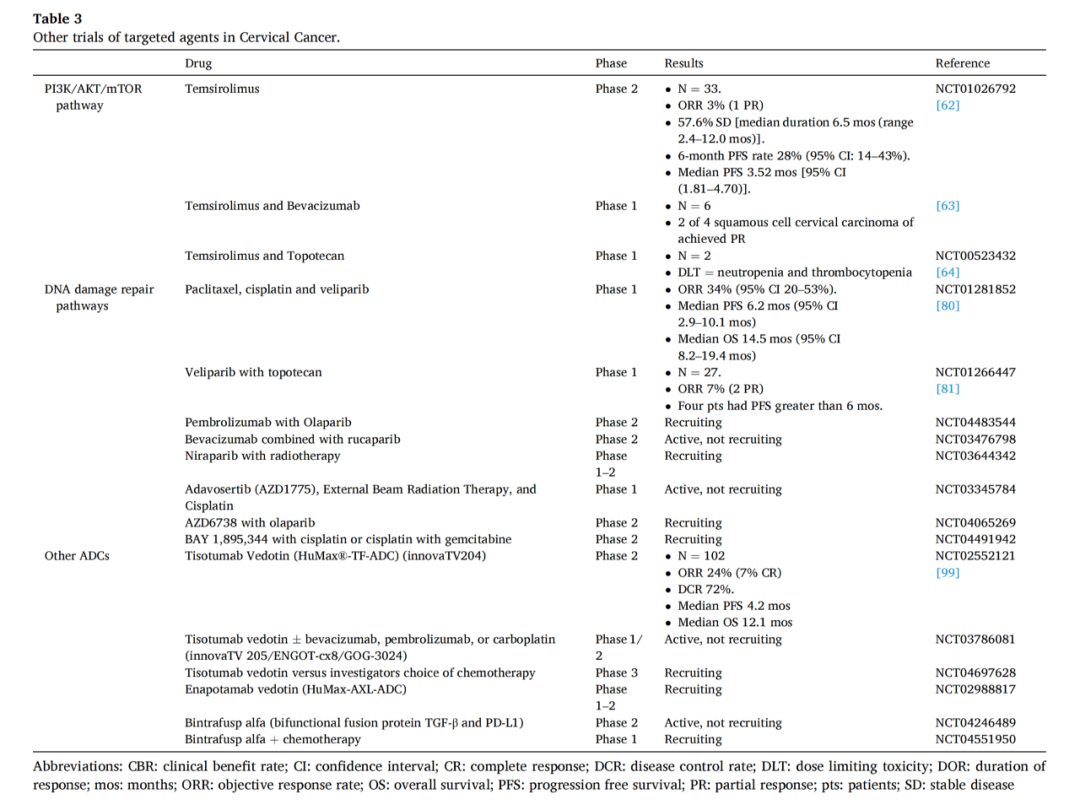
贝伐单抗是一种针对VEGF-A的重组人源化单克隆免疫球蛋白(Ig)-G1抗体。GOG-240确定了贝伐单抗与标准化疗的生存益处。化疗联合贝伐单抗组与单纯化疗组的中位OS分别为16.8个月和13.3个月(风险比[HR]0.77;95%CI,0.62-0.95;p=0.007)。CECILIA 2期研究结果与GOG-240一致。贝伐单抗的未来研究方向是与其他新药联合应用,表1中总结了有关研究。
小分子抗血管生成 TKI cediranib (AZD2171) 是 VEGFR 1、2 和 3以及PDGFR和 c-kit 的有效口服抑制剂。在CIRCCA试验随机、双盲、安慰剂对照的2期研究中,试验组PFS显著延长(8.1vs6.7月;HR0.58;80%CI,0.40至0.85;p=0.032),但OS在两组间无显著差异(13.6vs14.8月;HR0.94;80%CI,0.65至1.36;p=0.52)。试验组的2-3级高血压发生率更高(34%:11%)。
其他有关抗血管生成TKIs的单一活性研究也在进行中,结果各不相同。Apatinib在2期研究中显示出单药活性;CLAP试验研究Apatinib和Camrelizumab(PD-1抑制剂)联合治疗,该联合的应答率和生存结果良好,但也观察到了明显的毒性。抗血管生成药物与其他化合物(如免疫检查点抑制剂或ADC)的结合可能有助于提高疗效,无重叠的毒性,且协同增强活性。
靶向 EGFR/ HER2
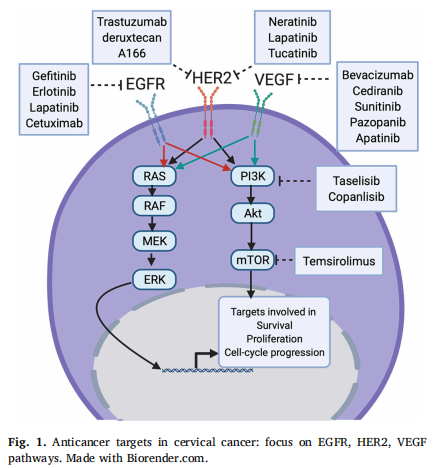
EGFR和HER2/neu与宫颈癌患者的不良预后相关。过度表达EGFR已被证明与宫颈鳞癌对放化疗的耐药性有关。西妥昔单抗是一种针对EGFR的单克隆抗体,与顺铂联合应用的耐受性良好,但在MITO CERV-2试验发现,在化疗组合中加入西妥昔单抗OS并不获益。对20个肿瘤样本的生物标志物分析表明,西妥昔单抗在PIK3CA野生型亚组(HR0.09;95%CI,0.01-0.87)中获益,在PIK3CA突变队列中不获益(HR1.69;95%CI,0.46-6.47;p=0.001)。
HER2/neu过度表达见于1%-12%的宫颈癌,HER2突变估计为3-6%。有证据表明,在进展期宫颈癌中,HER2会随着时间的推移过度表达或突变,因此可能成为更晚期疾病的治疗靶点。Neratinib是一种不可逆的TKI,对多种HER2突变的癌症(包括宫颈癌)具有单药活性。SUMMIT 试验评估了neratinib对具有多种HER2突变的实体肿瘤患者的安全性和有效性(NCT01953926)。
其他EGFR和HER2/neu靶向化合物在晚期宫颈癌中的研究总结于表2。这些耐受性良好的药物未来可能会在某些EGFR或HER2/neu变异或过度表达的宫颈癌亚型中发挥作用。
靶向PI3K/AKT/mTOR 通路
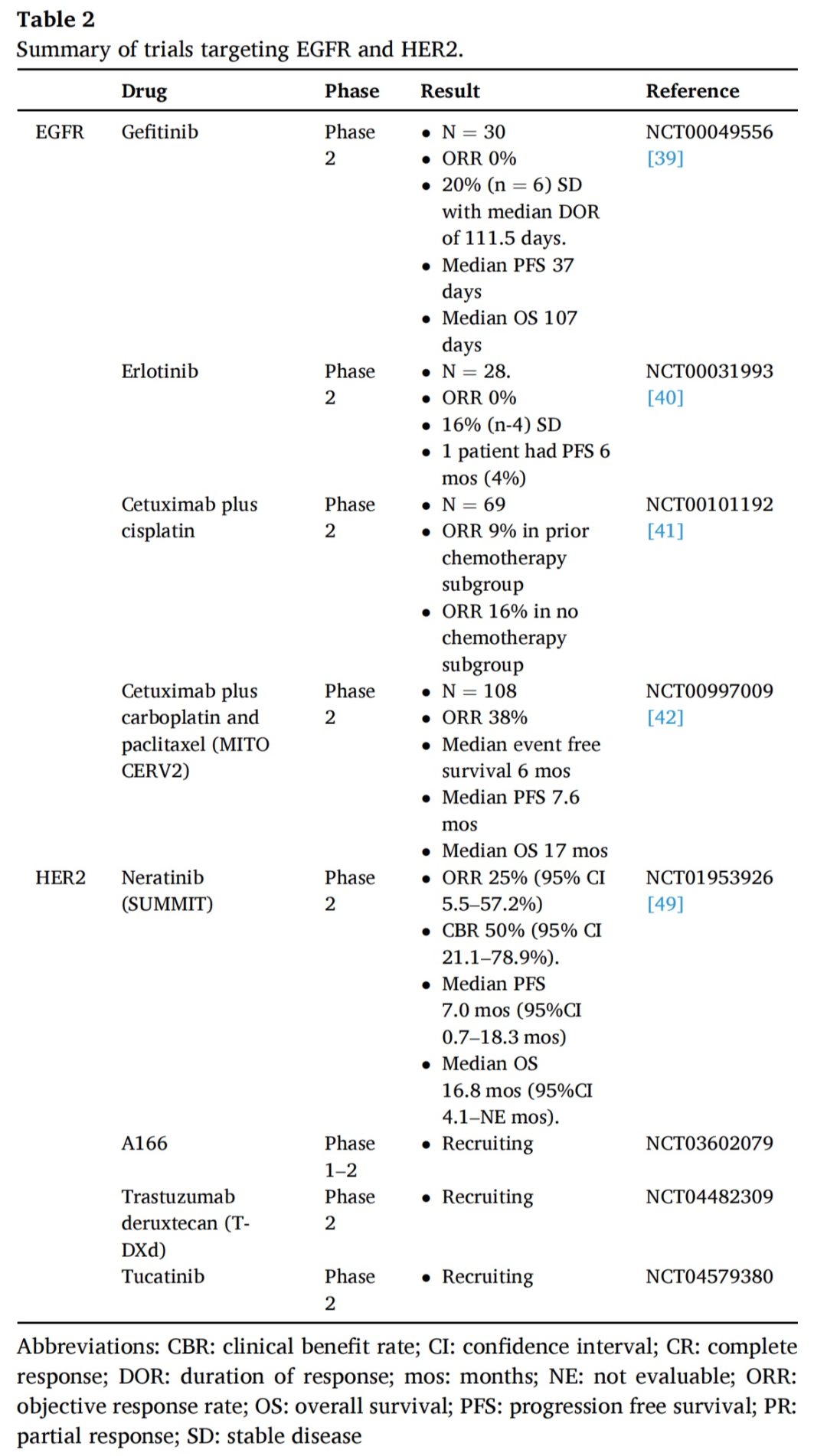
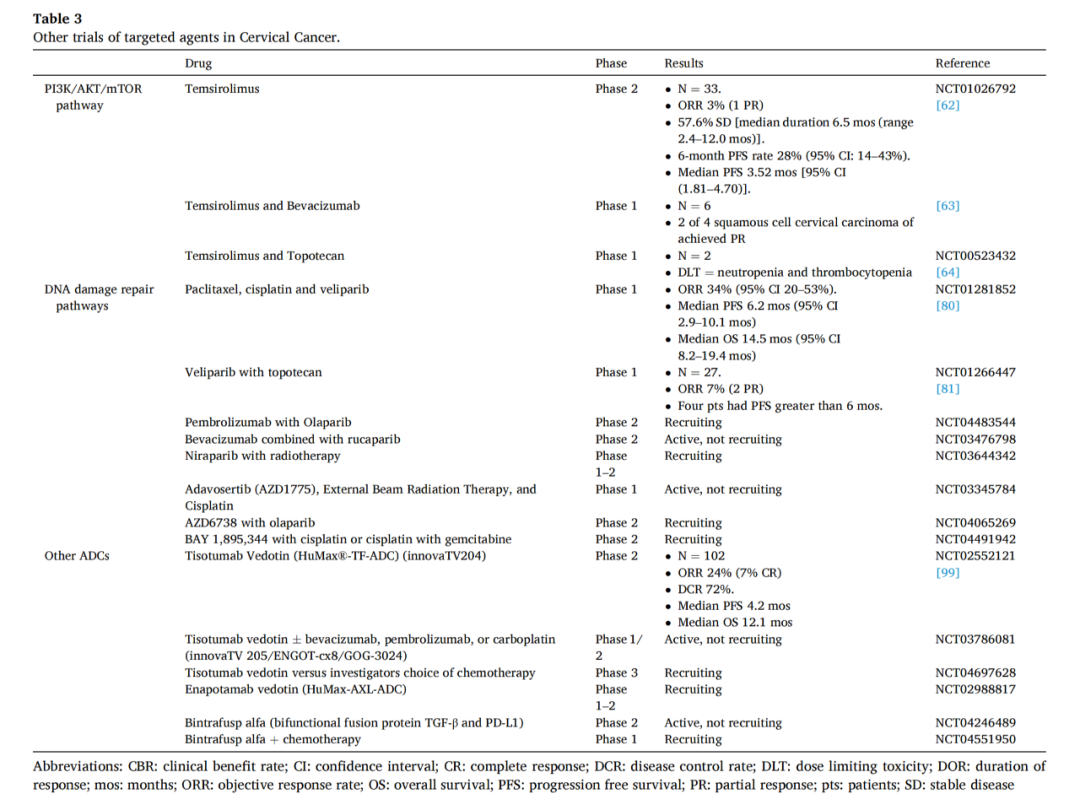
PI3K/AKT/mTOR通路通常与HPV相关肿瘤关联。Temsirolimus(CCI-779)是一种mTOR抑制剂。一项针对复发性、不可切除、局部晚期或转移性宫颈癌的Temsirolimus的2期研究显示,单药活性良好。一项包括2名宫颈癌患者的I期研究发现骨髓抑制呈剂量依赖性毒性。表3总结了相关试验。
靶向DNA损伤修复途径
PARP是一种针对单链DNA断裂修复的细胞内蛋白。在HRR缺陷细胞中抑制PARP1会导致合成致死。最近,通过免疫组化发现PARP1在LSIL、HSIL和浸润性鳞癌中的表达率分别为86%、77.5%和94%,在正常宫颈组织中没有或极少表达。紫杉醇、顺铂和维拉帕利(ABT-888)联合治疗持续性或复发性宫颈癌的1期试验发现该联合治疗是安全可行的。目前一些1/2期临床试验正在研究各种PARP抑制剂用于晚期宫颈癌。
对于因p53失活而绕过G1检查点的肿瘤,DDR可能变得完全依赖G2检查点。超过90%的宫颈癌患者在其原发肿瘤中表现出HPV E6介导的p53失活,因此G2检查点激酶Wee1抑制剂可能成为宫颈癌的潜在治疗靶点。
在没有外部DNA损伤信号的情况下,HPV会诱导ATR途径的激活,因此抑制ATR激活可以抑制HPV基因组的稳定扩增。用ATR抑制剂VE-822处理体外HPV阳性细胞可引起DNA断裂和病毒附加体碎裂。
Triapine是一种小分子RNR抑制剂。RNR过度活跃是80%以上宫颈癌的标志性分子驱动因素,其介导DNA损伤修复。评估Triapine联合顺铂在晚期宫颈癌和阴道癌放射治疗的2期研究中的II-III 期治疗组的结果表明,添加Triapine将代谢完全反应率从 69% 提高到 92% (p = 0.32),并将 3 年 PFS 率从 77% 提高到 92%(HR 0.30; p = 0.27) 。
其他药物
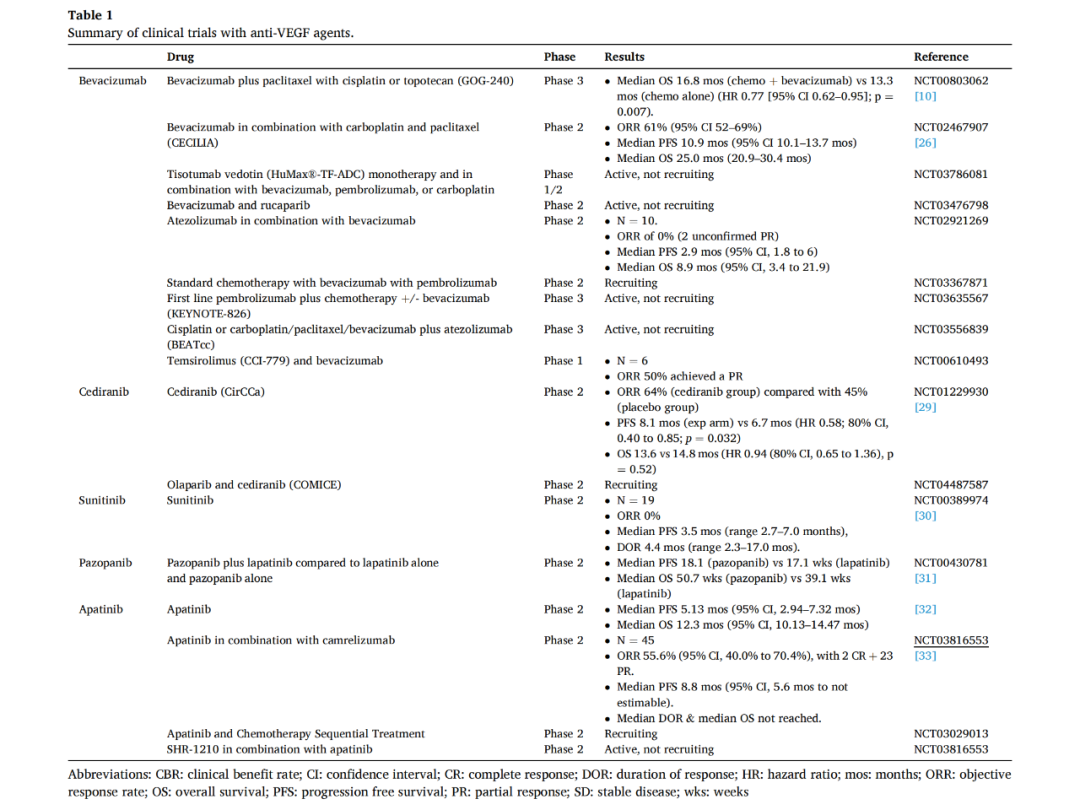
Tisotumab vedotin是由一种针对TF的全人单克隆抗体与微管干扰剂偶联组成。Tisotomab vedotin的作用机制如图2所示。
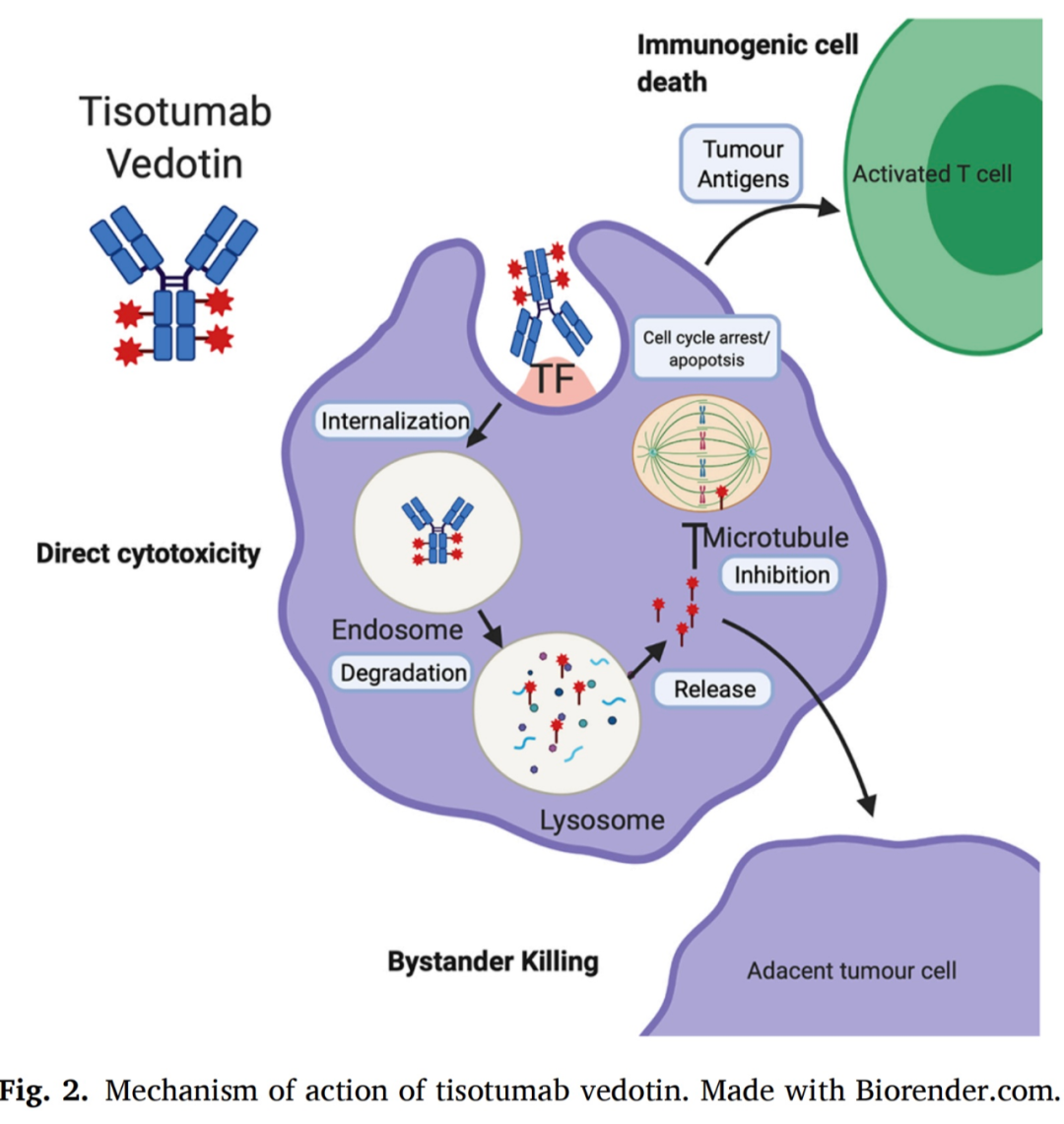
2020年,对tisotomab vedotin用于实体肿瘤的InnovaTV201 1-2期的宫颈癌研究显示,ORR为22%(95%CI,12%−35%),中位DOR为6个月(范围为1.0±0.7),6个月无瘤生存率为40%(95%CI,24%−55%)。无论组织学亚型、组织因子表达水平或既往治疗情况如何,均观察到有临床意义的反应。这表明在单药治疗取得积极结果的基础上,有望通过将Tisotumab vedotin与其他药物联合使用以进一步改善疗效。
Enapotamab vedotin是一种针对AXL的ADC,目前正在实体肿瘤患者(包括宫颈癌)的临床试验中进行。一种新的双功能融合蛋白bintrafusp alfa主要针对转化生长因子β和PD-L1,在HPV相关恶性肿瘤中显示出良好的临床活性。
结语
晚期宫颈癌的预后仍较差,治疗核心仍是以紫杉醇和铂为基础的化疗加或不加贝伐单抗。目前多种针对宫颈癌基因靶点的药物正在研发中。宫颈癌靶向治疗的未来无疑将涉及单独或联合化疗、其他靶向药物和/或免疫治疗化合物的治疗选择。此外,改进生物标记物识别,个体化治疗,将毒性降至最低,将使肿瘤对靶向治疗策略的反应最大化。
原始出处:
F.J.Crowley; R.E. O'Cearbhaill; D.C. Collins;Exploiting somatic alterations as therapeutic targets in advancedand metastatic cervical cancer;Cancer Treatment Reviews2021;https://doi.org/10.1016/j.ctrv.2021.102225


