Br J Pharmacol:阿米替林阻断TLR4和IL1R介导的先天免疫反应:OA和痛风的临床前和临床证据
时间:2021-10-29 10:01:49 热度:37.1℃ 作者:网络
现代社会中,肌肉骨骼疾病日益增多,这对我们的社会造成不利影响。尤其令人担忧的是,骨质疏松症、痛风、类风湿性关节炎(RA)和骨关节炎(OA)的发病率较高,这是大多数致残病例的罪魁祸首。OA的发病特点是关节软骨进行性退化,周围组织改变,包括软骨、滑膜和肌腱。总而言之,这些变化会导致疼痛、残疾和关节退化。缺乏有效的OA治疗方法,考虑到研发新药发现是一个漫长的、没有保证的过程,这是一个关键问题。因此,需要在目前批准的安全药物中寻找新的既省钱又省时的治疗方案。Toll样受体4(TLR4)的激活和先天免疫反应(IIR)因子参与了OA进行性软骨降解。然而,目前还没有临床可用的TLR4抑制剂。有趣的是,抗抑郁药阿米替林可以阻断这种受体。因此,我们评估了阿米替林抗TLR4对人骨性关节炎软骨细胞(HOCs)的作用,以期将其作为关节炎症病理中IIR的抑制剂。

实验方法:通过电子对接分析、RT-PCR、siRNA、ELISA、蛋白质组学以及药物使用的临床数据挖掘,探讨阿米替林阻断hOCs中TLR4介导的IIRs的临床意义。
实验设计:确定四种方案:对照组(未处理和未刺激的细胞),药物(阿米替林[0.1-1µM]),炎症刺激(LPS [100ng/ml]或IL1β [0.1ng/ml]),以及药物+炎症刺激(LPS [100ng/ml]或IL1β[0.1ng/ml] +阿米替林[0.1-1µM])。随机&盲法在本实验不适用。
在具体实验过程中,用CLI-095[1µM]或NLRP3 siRNA[15 nm]代替阿米替林。根据以前的报道选择内毒素和白细胞介素1β的浓度,而阿米替林的浓度与阿米替林治疗患者观察到的血清浓度重叠。
在样本量方面,初级细胞的可用性非常少,但我们建立了一个由6个独立的生物副本组成的组(n),每个副本有3个技术依赖的副本,适用于所有细胞类型的测定。值得注意的是,hOC的每一个独立的生物复制品都来自不同的患者。然而,基于蛋白质的实验需要10倍以上的细胞才能进行可靠的测定,因此,一组3个独立的实验副本。保留所有样本,这足以进行可靠的统计分析。此外,用于DDA或SWATH的MALDI/TOFF方法使用累加信号方法,因此每个输出数据都来自数千次技术复制运行累加后的结果。
结果:阿米替林可与TLR4结合,但不能与IL1受体(IL1R)结合。有趣的是,阿米替林与TLR4结合可抑制hOCs、滑膜细胞和成骨细胞中TLR4和IL1R介导的IIRs。此外,阿米替林降低基础IIR,促进hOCs的合成代谢作用。为了支持其抗IIR作用,阿米替林下调了NLR家族嘌呤结构域3(NLRP3)的基础和诱导表达,NLRP3是IL1R信号转导的炎症体成员,与OA和痛风病理相关。因此,对107.172名老年患者(>65岁)的分离和聚合药物消耗数据的挖掘显示,阿米替林的消耗与较低的秋水仙碱消耗量显著相关,与炎性痛风发作治疗相关。
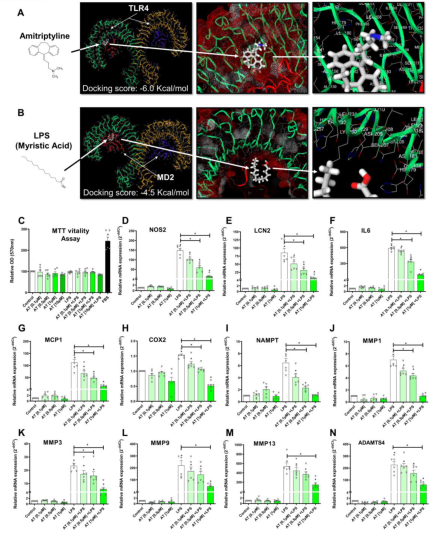
图1 阿米替林对TLR4介导的先天免疫反应因子的影响。所有实验都是独立的,由对照组进行标准化处理,并表示为平均值±SEM。A:阿米替林(白色)进入TLR4细胞外结构域的最佳对接评分(-6.0 Kcal/mol)。TLR4二聚体的潜在口袋(绿色和黄色)使用邻近附属蛋白MD2(红色和蓝色)的蛋白质序列位置(154到208)。B: LPS(白色)进入TLR4细胞外结构域的最佳对接评分(-4.5 Kcal/mol)。TLR4二聚体的潜在口袋(绿色和黄色)使用邻近附属蛋白MD2(红色和蓝色)的蛋白质序列位置(154到208)。用tlr4激活的人OA软骨细胞(LPS [100ng/ml])与AT[0.1, 0.5, 1.0µM]共处理24h (n=6),测定MTT细胞活力和mRNA表达(RT-PCR)固有免疫反应因子。

图2 阿米替林逆转TLR4介导的蛋白质组学改变。所有实验都是独立的,由对照进行标准化处理,并表示为平均值±SEM。A:LPS [100ng/ml]刺激人OA软骨细胞(hOC),阿米替林(AT)[1µM]联合作用24h。A:定性分析(DDA)数据中TLR4信号抑制和蛋白质组数鉴定示意图(n=3)。B:从tlr4激活的hOC蛋白组中定性数据(DDA)聚类到分子功能类别(n=3)。C:定量数据(SWATH)显示了阿米替林在tlr4激活的hOC中蛋白表达变化的火山图(p值vs倍变化)(n=3)。D:定量数据(SWATH)通路富集分析阿米替林对tlr4激活的hOC的影响(n=3)。E:阿米替林对tlr4激活的hOC作用的定性分泌数据(DDA)途径富集分析(n=3)。F:蛋白IL6分泌水平(pg/ml) (ELISA)和绿孔雀石总磷蛋白组相对光密度(OD) (n=3)。G:在hOC中CLI-095抑制的背景下TLR4和IL1R串扰图。H:检测lc -095[1µM]预处理3h后TLR4或IL1R (IL1β [0.1ng/ml])激活24h (n=6)的hOC细胞MTT细胞活力和固有免疫反应因子mRNA表达(RT-PCR)。
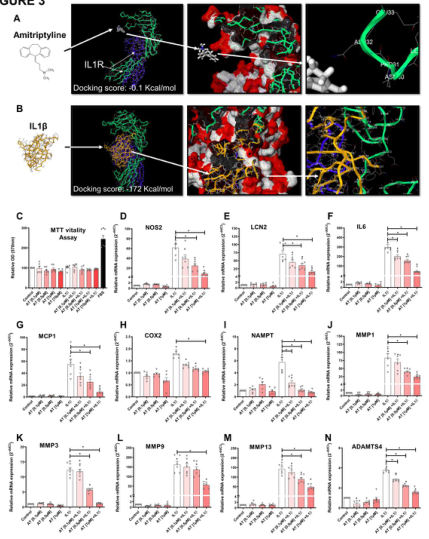
图3 阿米替林对Il1R介导的先天免疫反应因子的影响,所有实验都是独立的,由对照组标准化处理,并表示为平均值±SEM。A:阿米替林(白色)进入IL1R细胞外结构域的最佳对接评分(-0.1 Kcal/mol)。Amitriptyline不结合囊袋,而是结合在IL1R亚基IL1R1(绿色)远离IL1RAP亚基(蓝色)的蛋白质序列位置(第232位)的一个能量上不可行的自由基上。B: IL1β(黄色)与IL1R细胞外结构域的最佳对接评分(-172 Kcal/mol)。该口袋包括整个IL1R亚基IL1R1(绿色),它紧挨着IL1RAP亚基(蓝色)。检测il - 1r激活(il - 1β [0.1ng/ml])人OA软骨细胞(hOC)与AT[0.1, 0.5, 1.0µM]共处理24h (n=6), MTT细胞活力测定和固有免疫应答因子mRNA表达(RTPCR)。
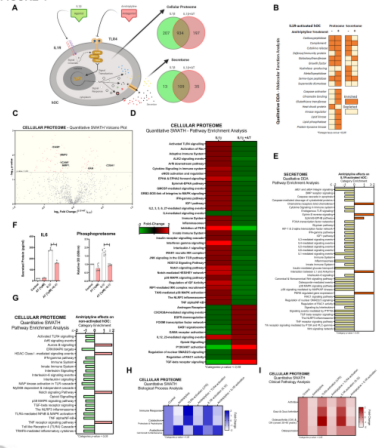
图4 阿米替林逆转IL1R介导的蛋白质组学改变。所有实验都是独立的,由对照标准化,并表示为平均值±SEM。A:IL1β[0.1ng/ml]刺激人OA软骨细胞(hOC),阿米替林(AT)[1µM]联合作用24h。A:从IL1R激活的hOC蛋白组中TLR4信号抑制和定性数据(DDA)蛋白数量鉴定示意图(n=3)。B:从IL1R激活的hOC蛋白组中定性数据(DDA)聚类到分子功能类别(n=3)。C:定量数据(SWATH)显示的蛋白表达变化的阿米替林火山图(p值vs倍变化)从IL1R激活的hOC蛋白组(n=3)。D:定量数据(SWATH)通路富集分析阿米替林对IL1R激活的hOC的影响(n=3)。E:阿米替林对IL1R激活的hOC作用的定性分泌数据(DDA)途径富集分析(n=3)。F:蛋白IL6分泌水平(pg/ml) (ELISA)和绿孔雀石总磷蛋白组相对光密度(OD) (n=3)。G:使用定量(SWATH)蛋白质组数据,阿米替林对非激活hOC通路富集的影响(n=3)。H:定量数据(SWATH)从IL1R激活的hOC蛋白组聚类到生物过程类别(n=3)。I:使用定量数据(SWATH)的临床病理学分析阿米替林对受激和非受激hOC的影响(n=3)。

图5 阿米替林阻断NLRP3炎性小体。所有实验都是独立的,由对照组标准化处理,并表示为平均值±SEM。A-C:在TLR4活化(LPS [100ng/ml])或IL1R活化(IL1β [0.1ng/ml])前,用cli095[1µM]处理人OA软骨细胞(hOC),并与AT[1µM]共同处理24h,检测NLRP3、IL1β mRNA (n=6)和IL1β分泌水平(n=3)的基因表达。D-G:在TLR4活化(LPS [100ng/ml])或IL1R活化(IL1β [0.1ng/ml])前,用cli095[1µM]或NLRP3 siRNA [15nM]联合处理ATDC5软骨细胞24h (n=6),检测NLRP3和IL1β mRNA的基因表达(RT-PCR)。H-K:在TLR4活化(LPS [100ng/ml])或IL1R活化(IL1β [0.1ng/ml])以及AT[1µM]或NLRP3 siRNA [15nM]联合处理24h (n=6)前,用cli095[1µM][1µM]或NLRP3 siRNA [15nM]处理3h的人SW982滑膜细胞,检测NLRP3和IL1β mRNA的基因表达(RT-PCR)。L-N:用OA (n=6)或痛风(n=4)滑膜液(10% v/v)联合AT(1µM)处理人SW982滑膜细胞24h,检测MTT细胞活力及NLRP3和IL1β mRNA的基因表达(RTPCR)。
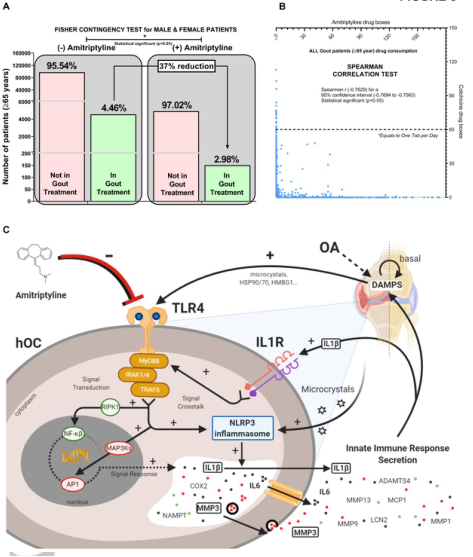
图6 阿米替林减少秋水仙碱治疗痛风的需要,对来自圣地亚哥-德孔波斯特拉(西班牙)医疗保健区107.172名老年人(>65岁)进行了5年的临床数据挖掘。A: Fisher试验比较老年人(>65岁)是否需要秋水仙碱和阿米替林。B:采用Spearman相关试验比较秋水仙碱用量(剂量:最多0.5mg;确切平均剂量为0.66mg)和阿米替林(最常使用剂量为25mg;老年(>65岁)患者个体消费的药盒。C:阿米替林对TLR4和IL1R串扰信号激活和抑制的影响,包括NLRP3/IL1B轴、NFκβ和AP1 myd88依赖通路和hOC。
结论:我们证明了阿米替林能够阻断依赖TLR4、IL1R和NLRP3的IIRs。这种活性和临床数据表明,阿米替林可用于不同关节炎症病理的全身或局部IIR治疗。
原文出处:
Franco-Trepat E, Alonso-Pérez A, Guillán-Fresco M,et al.Amitriptyline blocks innate immune responses mediated by TLR4 & IL1R: preclinical and clinical evidence in OA and gout.Br J Pharmacol 2021 Oct 13


