综述:C反应蛋白在Covid-19发病机制中的作用
时间:2021-11-17 15:01:54 热度:37.1℃ 作者:网络
SARS‐CoV‐2通过肾素‐血管紧张素系统(RAS)激活,与血管紧张素II转化酶(ACE2)结合,启动其发病过程,并引发一系列促炎事件,可诱发细胞因子风暴。C反应蛋白(CRP)是SARS‐CoV‐2与ACE2相互作用产生的分子,不仅是炎症急性期的指标,还与Covid‐19的预后和严重程度有关。因此,CRP是Covid‐19过程中细胞损伤的重要因素。本综述旨在描述SARS‐CoV‐2在感染过程中可通过增加CRP诱导细胞损伤的不同机制及可考虑通过CRP治疗本病的选择。
1. 方法
利用NCBI‐PubMed数据库对Covid‐19与免疫、炎症反应和C反应蛋白进行文献检索,查找2019年12月至2020年12月发表的文章。将所有术语作为一般术语进行检索,以获得最大的检索结果。
2. C-反应蛋白概述
C反应蛋白是正五聚蛋白家族的一种炎性蛋白,在急性炎症期产生。1930年由Tillet和Francis在应对肺炎球菌感染时首次发现。CRP基因的转录诱导主要发生在肝细胞对炎性细胞因子水平升高的反应中,尤其是白细胞介素-6(IL‐6)与IL‐1增强作用。C反应蛋白在类风湿性关节炎、一些心血管疾病和感染等炎症过程中呈高表达。
CRP在细菌炎症中的主要作用倾向于围绕补体分子C1q的激活导致病原体的调理素化。在钙存在的情况下,CRP与微生物上的磷酸胆碱等多糖结合,通过激活C1q的经典途径触发补体激活。此外,CRP与细胞表面的Fc受体结合,导致促炎性细胞因子释放。因此,CRP不仅是炎症的标志物,而且有助于炎症反应。考虑到SARS‐CoV‐2感染时CRP水平升高,高水平的CRP与该感染的死亡率相关,CRP已被确定为在SARS‐CoV‐2感染过程中能够引起损伤的分子。
3. C反应蛋白水平和COVID‐19
C反应蛋白长期以来被用作急性期炎症的指标;然而,在目前的Covid‐19大流行中它与组织损伤和疾病的不良预后有关。通过计算机断层扫描评估的肺部改变分析显示,在肺部病变出现之前存在高水平的CRP,进展为肺炎与循环CRP水平升高相关。涉及CRP水平和呼吸功能的研究显示,CRP水平升高与动脉血氧分压下降与吸入氧分数比值(PaO2/FiO2)呈负相关,提示CRP是肺功能衰竭的预测因素。其他研究显示,高水平CRP和低水平白蛋白与死亡率增加相关。
CRP/淋巴细胞比值升高已被用作重症监护室使用的重要预测因素。高水平的CRP和IL‐6(CRP的肝脏诱导剂)和IL‐10已被用作Covid‐19的预测因素。荟萃分析研究显示,高水平CRP伴白细胞增多可预测Covid-19患者的不良预后。在死于Covid‐19的个体中高水平CRP的持续存在,表明CRP是SARS‐CoV‐2诱导死亡的预测因子。尽管高水平CRP与Covid-19的不良预后和死亡率相关,但应研究CRP亚型的类型,因为一些亚型具有促炎特性,而其他亚型是抗炎分子。
4. SARS‐COV‐2感染和C‐反应蛋白产生
SARS‐CoV‐2感染的一个重要步骤是病毒S蛋白与其RAS成员受体ACE2结合。这种病毒感染可引起涉及呼吸、肾、心血管、中枢神经和胃肠道系统的多器官功能障碍疾病。
在结构上,SARS‐CoV‐2是一种被脂质包膜覆盖的球形病毒。它的基因组由正义RNA链形成,被核衣壳覆盖。在外部,这种病毒为其发病机制呈现重要的蛋白质,包括对其ACE2受体结合很重要的S蛋白(刺突)、提供结构支持的M蛋白、病毒组装所必需的E蛋白和血凝素酯酶。在蛋白S与ACE2结合发生之前,蛋白S被几种蛋白酶进行蛋白水解修饰。修饰后的S蛋白与ACE2结合有利于病毒进入细胞,降低细胞表面ACE2的表达。
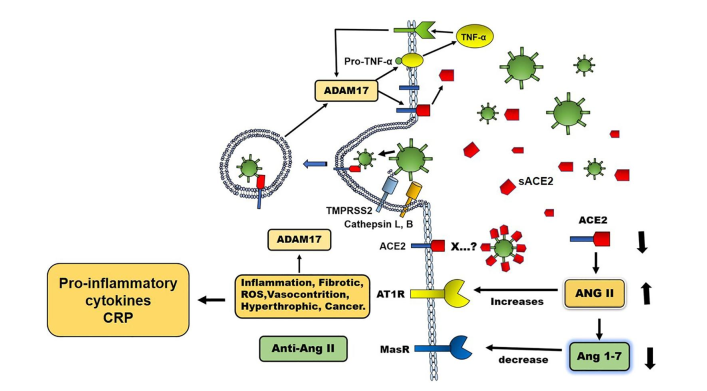
ACE2结合病毒通过内吞作用引入细胞。最初,ACE2通过将Ang II转化为Ang 1-7(作用于其受体Mas),产生与Ang II相反的作用,对血管紧张素II(Ang II)的有害作用(炎症、纤维化、氧化应激、血管收缩、癌症)发挥保护作用。病毒/ACE2复合物的细胞内化使Ang II活性增加。由于AngⅡ对其AT‐1受体的活性增加,并通过NF‐kB的核转位,AngⅡ诱导CRP、促炎细胞因子、氧化应激、纤维化、血管收缩的产生和ADAM17的活性增加等有害作用。
这一过程由于AngⅡ转化为Ang 1-7的恶化,导致AngⅡ的功能夸大,从而导致炎症作用和细胞因子生成的急剧增加,随之而来的是RAS介导的有害作用。在此机制下SARS‐CoV‐2可诱导AngⅡ活性增加介导的CRP的产生(图1)。因此,AngⅡ的过度活跃参与了Covid‐19的严重程度。通过阻断AngⅡ受体(AT1)和使用ACE抑制剂降低RAS活性可改善Covid‐19演变,减少促炎性细胞因子的产生,尤其是IL‐6是肝脏CRP的高诱导剂。在同样的背景下,阻断AngⅡ的产生可降低循环中CRP的含量。其他研究显示,ACE抑制降低了Covid-19中肺炎的存在,并伴随循环中CRP水平的降低。这些数据表明Ang II在Covid‐19过程中作为CRP产生诱导剂的作用。
图1:肾素血管紧张素系统(RAS)在SARS‐CoV‐2感染发病机制中的作用
5. C反应蛋白介导的细胞损伤机制
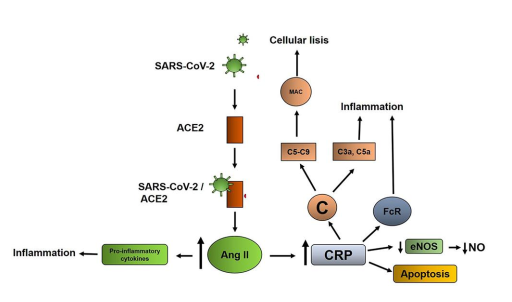
CRP的发病机制由其亚型类型介导。CRP有三种不同的亚型,天然CRP(nCRP)、单体(mCPR)和混合亚型(mCRPm)。在这方面,nCRP是由5个单体(五单体)形成的天然蛋白。该亚型主要在肝脏中合成,储存在内质网中,并缓慢释放到循环中,炎症状态除外,炎症状态下通过促炎性细胞因子的作用迅速消除到循环中。nCRP解离并产生单体(mCRP)。这两种亚型在炎症过程中具有不同的生物学特性,这一现象与每个分子的配体连接的点有关。还有第三种亚型mCRPm,它起源于nCRP部分解离时,留下保留部分nCRP的亚型。这发生在nCRP与细胞膜结合时,使mCRPm具有高容量激活补体。
补体激活是CRP生物学中至关重要的阶段。该分子通过激活C1q的经典途径激活补体。对此,C1q的激活诱导C4、C2和C3的链激活。活化的C3可诱导以下效应:通过产生C3b和C4b的调理素作用;通过激活C5‐C9导致膜攻击复合物(MAC)的细胞裂解;通过产生C3a和C5a诱导的炎症。
CRP通过以下几种机制诱导细胞凋亡:
(1)诱导促凋亡细胞因子如TNF‐α和IL‐1‐β,并通过激活Fc‐γ受体诱导活性氧。
(2)诱导p53上调通过激活Fc‐γRII改变细胞周期。
(3)激活与粘附分子和趋化细胞因子表达有关的基因。
(4)诱导与细胞周期阻滞和DNA损伤有关的GADD153基因表达。
(5)caspase‐3的激活额外促进凋亡细胞的调理素化。
由于CRP介导的对机体的多种有害作用,CRP水平升高与Covid‐19的不良预后和严重程度之间的关系是合理的(图2)
图2:Covid‐19感染中C反应蛋白(CRP)损伤的可能机制。
6. 阻断C反应蛋白并对COVID‐19产生潜在治疗作用的药物
四环素是一种具有抗病毒特性的抗生素,已被提出用于治疗Covid‐19。四环素类的抗CRP特性也已得到证实。
多西环素通过其抗氧化能力降低成骨细胞产生5-α-二氢睾酮中CRP的氧化作用。多西环素还可降低db/db糖尿病小鼠循环中CRP和其他炎症标志物的水平,并改善葡萄糖代谢。人体研究显示,多西环素可降低外周动脉疾病、小腹主动脉瘤和牙周病患者的循环CRP水平。CRP水平的降低可能与四环素类的抗炎特性有关。多西环素还可诱导Ang II AT2受体的表达,当受到刺激时,可诱导与参与CRP生成的AT1受体相反的作用。
米诺环素可降低持续输注AngⅡ治疗的大鼠和自发性高血压大鼠AngⅡ的血管加压和炎症作用。这些研究表明,四环素类药物可能通过作用于Ang II诱导的CRP的生成,改变CRP的生成和/或作用。
Janus激酶(JAK:JAK1/JAK2)参与促炎性细胞因子的诱导。抑制Janus激酶可抑制人肝细胞中CRP的诱导,因此阻断该通路的药物代表了合理的治疗策略。已报告了几种JAK抑制剂。Baricitinib是一种通过内吞作用阻断SARS‐CoV‐2通过进入细胞的药物,也是JAK1/JAK2通路的强效抑制剂,可抑制多种细胞因子尤其是IL‐6的促炎信号,IL‐6可促进参与Covid‐19中报道的细胞因子风暴的CRP合成。
芦可替尼另一种JAK1/JAK2抑制剂已用于CRP升高的晚期HER2阴性乳腺癌患者,获得了健康相关生活质量的有利变化。据报告,其他JAK抑制剂(如托法替布和GSK2586184)可降低CRP药物。
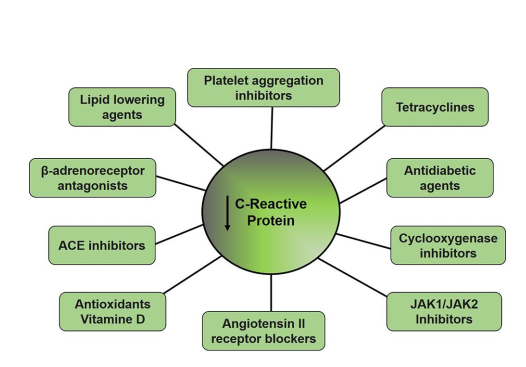
还报告了其他几种降低循环CRP浓度的药物。β受体阻滞剂可能影响CRP浓度。环氧合酶抑制剂(塞来昔布、罗非昔布)、血小板聚集抑制剂(氯吡格雷、阿昔单抗)和ACE抑制剂(雷米普利、卡托普利、福辛普利)、降脂药(他汀类药物、依折麦布、非诺贝特)、抗氧化剂(α-生育酚)、Ang II受体阻滞剂(缬沙坦、厄贝沙坦、奥美沙坦、替米沙坦),和降糖药物(罗格列酮和吡格列酮)代表了一些降低CRP水平的药物(图3)
图3:能够降低C反应蛋白水平的药物
结论
在Covid‐19过程中,SARS‐CoV‐2可改变肾素‐血管紧张素系统,诱导AngⅡ活性增加,从而诱导CRP产生,随后出现组织损伤,Covid‐19严重程度增加。使用通过减少CRP产生的药物代表了一种合理的治疗方法,应在对照临床试验中进行检验。
原文链接:https://pubmed.ncbi.nlm.nih.gov/34773448/
C‐reactive protein as an effector molecule in Covid‐19 pathogenesis


