漫威“金刚狼”或可成为现实!Nature子刊:“金属骨头”—钛合金,可加速骨骼再生
时间:2021-12-01 23:01:55 热度:37.1℃ 作者:网络
医用钛合金不仅无毒、质量轻、抗腐蚀,而且具有极好的生物相容性和与人体骨结合的天然能力,可用作植入人体的植入物等,是很理想的医用金属材料。
漫威宇宙的X战警系列电影,金刚狼的钛合金人骨大展神威,坚不可摧。如果我们在现实世界将医用钛合金,也同样换到身体里,或者说把自己的骨头换成钛合金骨头,那么我们是不是也会变得更加强大呢?
2021年11月25日,天津大学、河北工业大学、湖北大学等研究机构在Nature子刊《Nature Communication》发表了题为:Self-activating anti-infection implant的研究论文,表明经过HA/MoS2涂层改性的Ti6Al4V(Ti6)钛合金种植体,对金黄色葡萄球菌和大肠杆菌均表现出高效的抗菌作用,同时能通过促进间充质干细胞的成骨分化来加速骨再生。

在临床骨外科手术中,很难同时赋予植入体良好的成骨能力和抗菌活性。细菌感染和与宿主组织的骨整合不足延误了患者的恢复时间,增加了术后发病率。植入体成功的关键在于骨细胞在植入体上的快速成骨分化和同时防止细菌感染。
羟基磷灰石(HA)具有良好的骨传导性,在牙科和骨科种植体的骨整合中得到了广泛的应用。硫化钼(MoS2)除了具有良好的生物相容性外,该材料独特的物理和光电特性使其对革兰氏阳性菌和革兰氏阴性菌均具有优异的杀菌能力。
在此项研究中,研究人员通过采用激光熔覆和化学气相沉积(CVD)方法,将上述两种材料制备成HA/MoS2涂层改性的Ti6Al4V(Ti6)种植体。HA/MoS2涂层利用金黄色葡萄球菌和大肠杆菌代谢过程产生的能量,无需额外能量即可触发HA/MoS2-Ti6的抗菌活性。这是一个自我激活的抗感染过程,同时可通过上调Ca2+水平提高骨髓间充质干细胞的存活率,促进骨髓间充质干细胞的成骨分化。
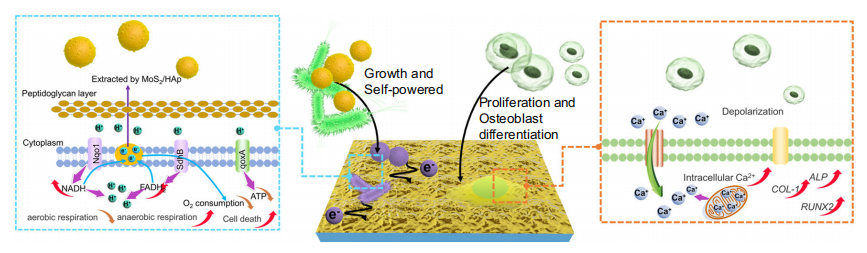
图注:HA/MoS2涂层可以防止细菌感染,同时促进骨组织再生
该项目的研究人员通过在不同基质上培养细菌,分析了HA/MoS2–Ti6与细菌之间的相互作用。相比之下,HA/MoS2–Ti6组只有少量菌落,表明其不仅具有良好的广谱抗菌性能,而且对多药耐药的甲氧西林金黄色葡萄球菌(MRSA)也有较强的抗菌能力。
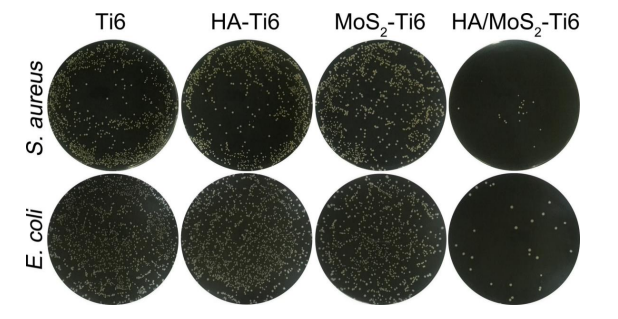
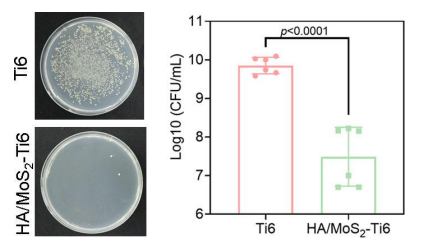
图注:HA/MoS2-Ti6种植体的抗菌活性
研究的另一部分是分析HA/MoS2–Ti6的成骨能力,研究了HA/MoS2–Ti6对干细胞潜能的影响。HA/MoS2–Ti6组的细胞内Ca2+水平远高于Ti6组。高水平的钙离子被转运到线粒体,调节线粒体代谢,引起线粒体膜的短暂去极化。这种来自内质网的钙离子波动对细胞增殖起着重要的生理作用,表明HA/MoS2-Ti6种植体在体外具有很强的成骨分化能力。研究者使用DAPI(4’,6-二氨基-2-苯基吲哚)和四甲基罗丹明(TRITC)偶联phalloidin(actin)来表征不同样品存在时,间质干细胞的形态。与Ti6组相比,培养1天、3天和7天后,HA/MoS2–Ti6组的细胞存活率显著提高,细胞活力明显增强。
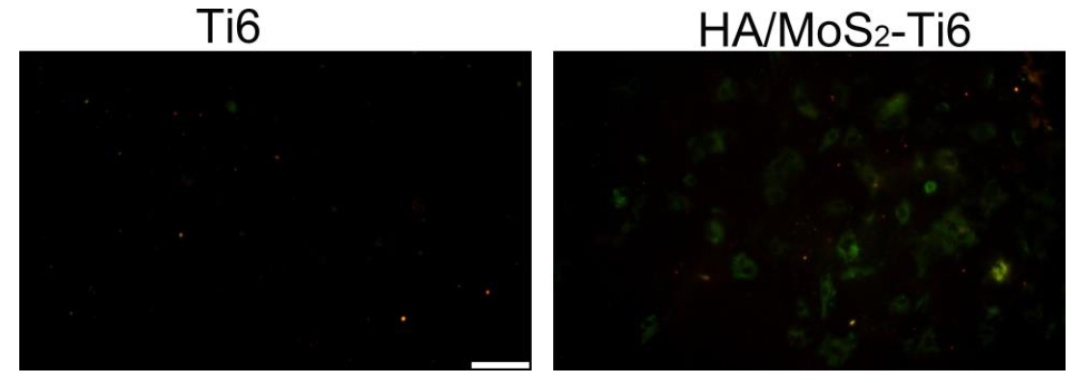
图注:荧光成像结果显示HA/MoS2–Ti6组的细胞内Ca2+水平远高于Ti6组
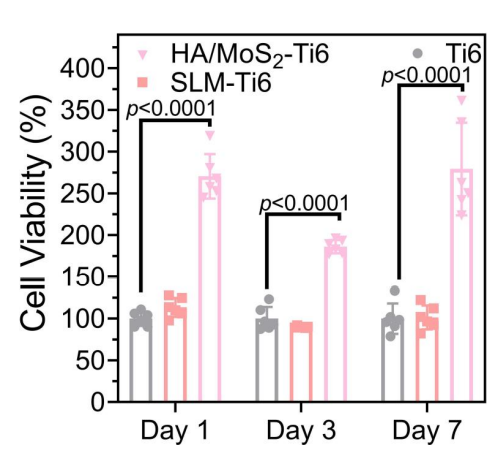
图注:在培养1天、3天和7天后,将间质干细胞与Ti6、SLM-Ti6和HA/MoS2-Ti6共培养,观察其细胞活力
根据上述结果,HA/MoS2–Ti6种植体在体外的抗菌和成骨性能非常优异,研究者因此选择对其进行体内研究。他们将HA/MoS2–Ti6植入体置入雄性大鼠的胫骨中,植入位置通过X射线图像显示(图中红色箭头)。植入14天后,通过苏木精-伊红(H&E)和Giemsa染色评估植入物周围骨组织中的炎症反应和残留细菌,14天后观察到HA/MoS2–Ti6组中的细菌很少,而Ti6组中的细菌较多,进一步证明了HA/MoS2–Ti6组在体内的高效抗菌效果。

图注:a、胫骨附近剃毛的照片。b、植入位置的照片。c、钛棒的X射线图像
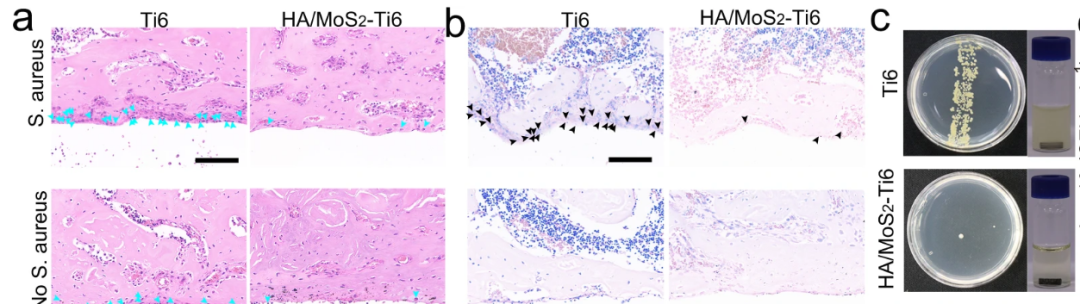
图注:HA/MoS2-Ti6种植体的体内抗菌效果
植入4周后,研究者通过微型计算机断层扫描(micro-CT)评估不同样本的骨再生能力,结果显示HA/MoS2-Ti6组的成骨能力优异。通过H&E染色检测心脏、肝脏、脾脏、肺和肾脏等主要器官的体内毒理学,未发现器官损伤迹象,表明制备材料没有明显的组织毒理学。以上结果表明,合成的HA/MoS2–Ti6不仅具有自抗菌性能,而且具有良好的骨传导性,这使得激光熔覆制备的HA/MoS2涂层成为同时解决细菌感染和人工种植体骨整合两大问题的有效策略。
综上所述,激光熔覆法制备的HA/MoS2涂层利用了骨髓间充质干细胞与细菌之间能量代谢的差异,在杀死病原菌的同时促进了钛种植体的骨再生。该研究有望提高骨科植入体的抗感染性能力和成骨能力,减少术后发病率,造福患者。
参考资料:
[1]Fu JN, Zhu WD, Liu XM, et al. Self-activating anti-infection implant [J]. Nature Communications 2021, 12, 6907-6920.


