Nature Communications:上科大仓勇团队揭示肿瘤进化中癌症逃脱免疫治疗的新机制
时间:2021-12-19 19:03:08 热度:37.1℃ 作者:网络
目前,包括PD-1抗体等免疫检查点抑制剂(immune checkpoint blockade)在内的癌症免疫治疗,主要是通过释放T细胞,发挥对肿瘤细胞的杀伤作用,从而提高癌症患者的生存前景。然而,大部分患者并不能对该疗法很好的响应并维持持久的疗效,主要是因为肿瘤在进化过程中累积了大量的基因突变,获得了遗传异质性(genetic heterogeneity),从而在免疫治疗过程中产生原发性和获得性耐药性。但是这些基因突变中存在大量的乘客突变(passenger mutation),这些突变对肿瘤生存和恶化没有影响。
传统研究主要通过对不同疗效的病人样本分类进行深度基因测序,常常受限于病人样本的数量,难以动态监控基因突变的变化,并且只能得到这些突变与癌症发生的相关性,而不能建立因果关系。因此,从肿瘤遗传异质性中区分出真正导致肿瘤免疫逃逸的驱动突变(driver mutation),从而寻找到解决免疫治疗耐药性的新策略仍然是一大难题。
近日,上海科技大学生命科学与技术学院仓勇团队与合作者在 Nature Communications 在线发表题为:Tumor evolution selectively inactivates the core microRNA machinery for immune evasion 的研究论文。
他们通过小鼠模型追踪不同的免疫压力选择下的肿瘤基因突变的动态变化,结合CRISPR文库筛选,发现肿瘤细胞在进化过程中选择性地使核心miRNA机器功能失活,从而逃脱免疫系统的杀伤和免疫治疗。

仓勇团队从肿瘤进化过程入手,揭示了全新的肿瘤免疫逃逸机制,提供了探索机制的新策略,为癌症免疫治疗的患者分群提供了新的理论依据。研究提示肿瘤内携带ANKRD52、AGO2等miRNA机器核心组分的基因突变的患者,可能不会很好地响应PD-1、PD-L1抗体治疗,为解决肿瘤免疫治疗耐药性提供了新的研究方向。
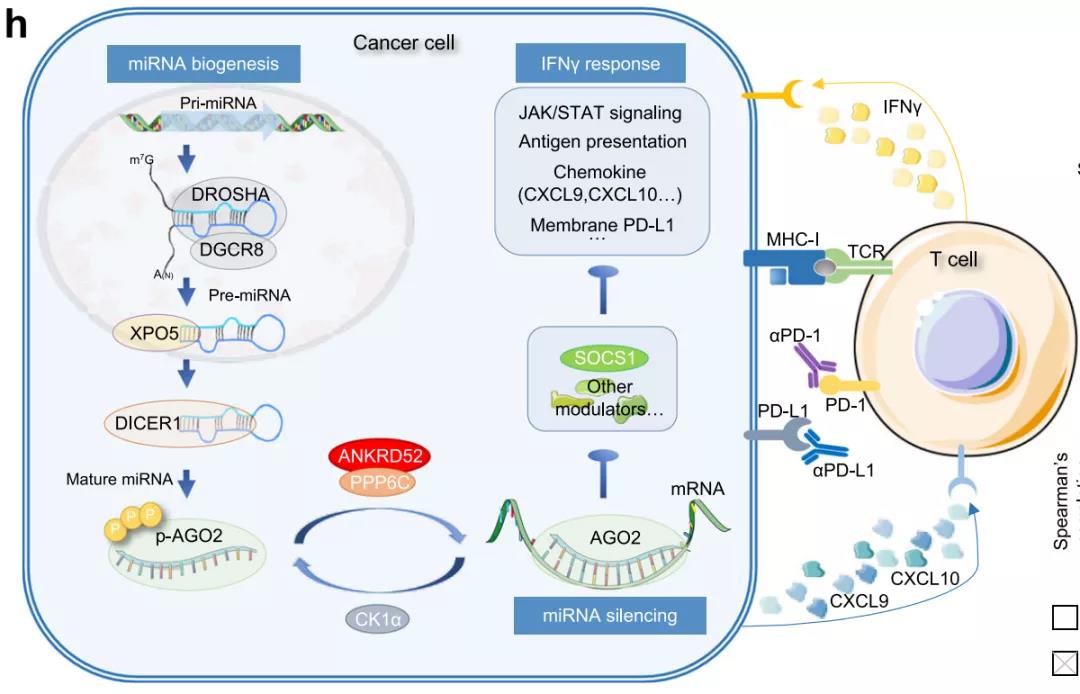
miRNA机器调控肿瘤免疫模型图:ANKRD52通过调控AGO2的去磷酸化,诱导miRNA结合SOCS1,进而促进肿瘤细胞分泌CXCL9和CXCL10趋化因子招募T细胞,并影响肿瘤细胞的抗原呈递和对T细胞分泌的IFNγ细胞因子的响应能力,从而调控T细胞对肿瘤细胞的识别和杀伤。
仓勇课题组博士后宋天瑜为本文的第一作者,浙江大学博士研究生龙敏和药明康德肿瘤免疫部赵海鑫为共同第一作者。仓勇教授为本文的通讯作者。该研究主要受到国家自然科学基金、上海市科学技术委员会、中国博士后科学基金和上海市超级博士后人才激励计划的支持。
原始出处:
Song, TY., Long, M., Zhao, HX. et al. Tumor evolution selectively inactivates the core microRNA machinery for immune evasion. Nat Commun 12, 7003 (2021).


