日常吃点抗氧化剂强身健体?强的更可能是癌细胞的体!
时间:2022-01-02 21:13:46 热度:37.1℃ 作者:网络
抗氧化补充剂是流行的健康促进剂,其中一些据说具有抗癌活性。关于抗氧化补充剂摄入的益处,不仅在健康个体中,而且在确诊癌症的患者中,存在长期争论。在正常生理条件下,各种细胞活动产生活性氧(ROS),而反活性抗氧化分子的存在作为电子供体来中和和抑制ROS的积累,确保基因组和其他细胞蛋白质结构的完整性。在癌细胞中,异常高增殖速率所带来的代谢活动增加不可避免地会增加细胞ROS的产生。为了承受这种异常高水平的ROS带来的潜在细胞毒性作用,癌细胞能够通过调节细胞抗氧化剂的产生来调节ROS水平,这使它们能够适应氧化应激,从而确保它们的可持续增殖。
 以前的一些研究表明,抗氧化补充剂可能具有抗肿瘤作用。例如,维生素C可以单独或与其他疗法联合发挥选择性抗肿瘤作用,而维生素D可以降低某些癌症的耐药性。此外,在干扰素-γ存在的情况下,维生素E可以通过降低程序性细胞死亡蛋白1 (PD-L1)表达来预防乳腺癌转移。另一方面,一些大规模的随机临床试验产生了争议的结果,这为我们提供了一些关于在癌症患者中使用抗氧化剂的不良影响的见解。N-乙酰半胱氨酸(NAC)和谷胱甘肽(GSH)是含硫醇基的水溶性抗氧化剂。先前的研究揭示了NAC或GSH在不同癌症类型中的致癌作用。然而,外源性补充NAC或GSH对肝癌的影响尚不清楚。
肝细胞癌(HCC)是全球第三大癌症相关死因。本研究旨在使用全面的体外和体内模型系统地研究抗氧化补充剂在HCC中的作用。本研究发现NAC和GSH促进了HCC的形成,促进了肿瘤生长,上调了干细胞基因的表达,并抵消了索拉非尼的治疗效果。此外,NAC和GSH调节了促进HCC形成和生长的共同生物学途径。此外,分别针对NAC和GSH代谢的抑制剂硫柳氮嗪( SSA)和丁硫氨酸硫(BSO)在体外和体内均抑制NAC和GSH诱导的促瘤作用,并伴有ROS水平显著升高。本研究提供了关于在癌症患者中使用外源性抗氧化补充剂的科学见解。
以前的一些研究表明,抗氧化补充剂可能具有抗肿瘤作用。例如,维生素C可以单独或与其他疗法联合发挥选择性抗肿瘤作用,而维生素D可以降低某些癌症的耐药性。此外,在干扰素-γ存在的情况下,维生素E可以通过降低程序性细胞死亡蛋白1 (PD-L1)表达来预防乳腺癌转移。另一方面,一些大规模的随机临床试验产生了争议的结果,这为我们提供了一些关于在癌症患者中使用抗氧化剂的不良影响的见解。N-乙酰半胱氨酸(NAC)和谷胱甘肽(GSH)是含硫醇基的水溶性抗氧化剂。先前的研究揭示了NAC或GSH在不同癌症类型中的致癌作用。然而,外源性补充NAC或GSH对肝癌的影响尚不清楚。
肝细胞癌(HCC)是全球第三大癌症相关死因。本研究旨在使用全面的体外和体内模型系统地研究抗氧化补充剂在HCC中的作用。本研究发现NAC和GSH促进了HCC的形成,促进了肿瘤生长,上调了干细胞基因的表达,并抵消了索拉非尼的治疗效果。此外,NAC和GSH调节了促进HCC形成和生长的共同生物学途径。此外,分别针对NAC和GSH代谢的抑制剂硫柳氮嗪( SSA)和丁硫氨酸硫(BSO)在体外和体内均抑制NAC和GSH诱导的促瘤作用,并伴有ROS水平显著升高。本研究提供了关于在癌症患者中使用外源性抗氧化补充剂的科学见解。
 1、NAC和GSH促进肝癌小鼠模型和异种肝癌模型的肿瘤形成和生长
为了研究外源性抗氧化剂对肿瘤形成的影响,我们使用化学致癌物二乙基亚硝胺(DEN)模型诱导C57BL / 6小鼠自发性HCC形成(图1)。然后用两种不同剂量口服 NAC 和 GSH(NAC 分别为 60 和 120 mg/kg/天,GSH 分别为 50 和 100 mg/kg/天)。这些剂量根据60公斤成人等效剂量估计,即NAC为600毫克/份/天(10毫克/千克/天),GSH为500毫克/份/天(8.3毫克/千克/天。这些剂量用于整个研究的所有体内实验。DEN注射后,所有小鼠在35周时发生多发性HCC(图1b)。在高剂量NAC和GSH处理的小鼠中观察到显着的体重减轻(附加文件1:图S1a),后者伴随着存活率的降低,低剂量GSH治疗不影响小鼠的生存(额外1:图S1b)。高剂量GSH治疗显着提高了肿瘤发生率(P <0.01),如肝脏中形成直径>1 mm的肿瘤数量增加较高(图1c)。
1、NAC和GSH促进肝癌小鼠模型和异种肝癌模型的肿瘤形成和生长
为了研究外源性抗氧化剂对肿瘤形成的影响,我们使用化学致癌物二乙基亚硝胺(DEN)模型诱导C57BL / 6小鼠自发性HCC形成(图1)。然后用两种不同剂量口服 NAC 和 GSH(NAC 分别为 60 和 120 mg/kg/天,GSH 分别为 50 和 100 mg/kg/天)。这些剂量根据60公斤成人等效剂量估计,即NAC为600毫克/份/天(10毫克/千克/天),GSH为500毫克/份/天(8.3毫克/千克/天。这些剂量用于整个研究的所有体内实验。DEN注射后,所有小鼠在35周时发生多发性HCC(图1b)。在高剂量NAC和GSH处理的小鼠中观察到显着的体重减轻(附加文件1:图S1a),后者伴随着存活率的降低,低剂量GSH治疗不影响小鼠的生存(额外1:图S1b)。高剂量GSH治疗显着提高了肿瘤发生率(P <0.01),如肝脏中形成直径>1 mm的肿瘤数量增加较高(图1c)。
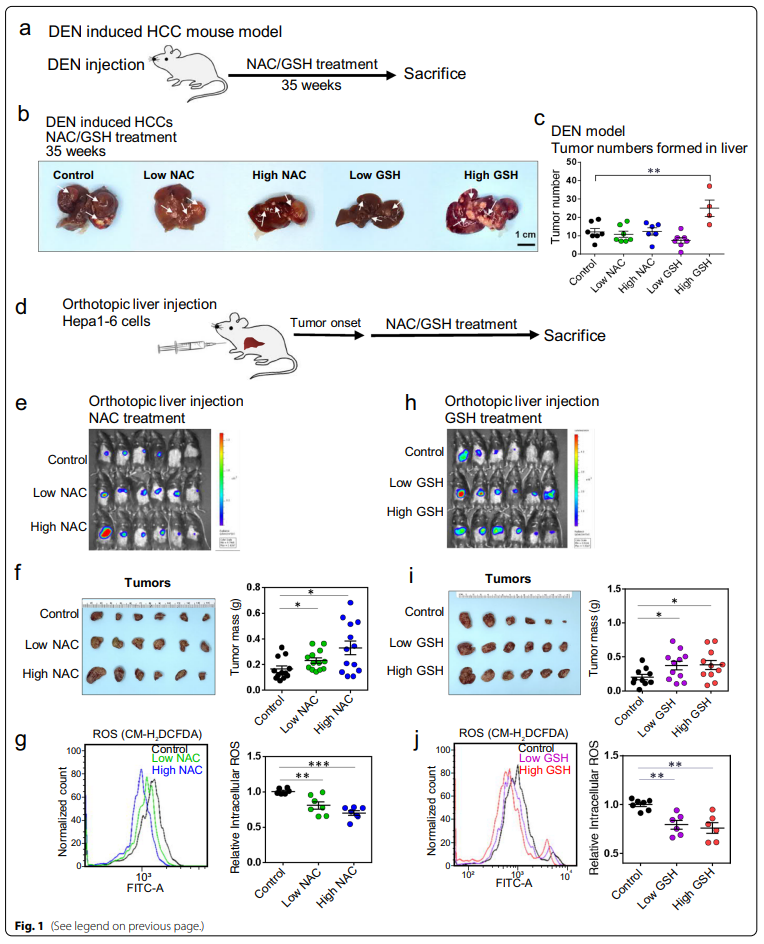
 为了扩展我们的研究,我们采用HDTVi模型,该模型由CRISPR / Cas9介导的内源性TP53的功能丧失基因组编辑和SB转座子驱动的C-Myc过表达在C57BL / 6小鼠中诱导的自发性HCC肿瘤(附加文件1:图S1c)。我们发现与对照组相比,NAC或GSH治疗小鼠的肿瘤发病率增加(附加文件1:图S1d),伴随着肿瘤内ROS水平的显着降低(附加文件1:图S1e)。
接下来,我们质疑外源性抗氧化剂是否促进了肝癌的生长。我们通过使用小鼠肿瘤异种移植模型,将荧光素酶标记的Hepa1-6(一种小鼠肝癌细胞系)原位注射到免疫功能正常的C57BL/6小鼠体内(图1d)。在低剂量和高剂量的NAC处理组中,肿瘤肿块显著增加(图1e, f),肿瘤内ROS水平下降(图1g)。同样,无论是低剂量还是高剂量GSH治疗,肿瘤肿块显著增加(图1i),ROS水平也显著降低(图1j)。我们的数据表明,NAC和GSH可以通过降低ROS水平来促进侵袭性肿瘤行为。
2、NAC和GSH在体外对人肝癌细胞表现出促癌作用,并脱敏NRF2/GCLC相关抗氧化产生通路
由于观察到抗氧化剂促进了小鼠自发性HCC和异种肝癌模型中的肿瘤发生和生长,我们希望证实这些促进作用是否也存在于体外和体内的人类HCC细胞中。为系统地研究抗氧化治疗在人HCC细胞中的功能影响,一组HCC细胞系,包括MHCC-97L,PLC / PRF / 5,Hep3B和HepG2,分别受到NAC和GSH的处理,然后测量其功能变化。一般来说,NAC和GSH中的一个或两个都会促进一种或多种表型改变,这取决于所检测的HCC细胞系。我们发现NAC或GSH促进MHCC-97L细胞和HepG2细胞的集落形成(附加文件1:图S2a),增加所有四个细胞系的细胞增殖速率(附加文件1:图S2b)和自我更新能力(图2a, b;附加文件1:S2c,d)在中,并且增强了MHCC-97L或Hep3B细胞的迁移能力(图2c-d)和侵袭能力(图2e - f)。为进一步研究抗氧化剂在人HCC中的促癌作用,我们使用MHCC-97L和Hep3B细胞进行后续实验。
为了扩展我们的研究,我们采用HDTVi模型,该模型由CRISPR / Cas9介导的内源性TP53的功能丧失基因组编辑和SB转座子驱动的C-Myc过表达在C57BL / 6小鼠中诱导的自发性HCC肿瘤(附加文件1:图S1c)。我们发现与对照组相比,NAC或GSH治疗小鼠的肿瘤发病率增加(附加文件1:图S1d),伴随着肿瘤内ROS水平的显着降低(附加文件1:图S1e)。
接下来,我们质疑外源性抗氧化剂是否促进了肝癌的生长。我们通过使用小鼠肿瘤异种移植模型,将荧光素酶标记的Hepa1-6(一种小鼠肝癌细胞系)原位注射到免疫功能正常的C57BL/6小鼠体内(图1d)。在低剂量和高剂量的NAC处理组中,肿瘤肿块显著增加(图1e, f),肿瘤内ROS水平下降(图1g)。同样,无论是低剂量还是高剂量GSH治疗,肿瘤肿块显著增加(图1i),ROS水平也显著降低(图1j)。我们的数据表明,NAC和GSH可以通过降低ROS水平来促进侵袭性肿瘤行为。
2、NAC和GSH在体外对人肝癌细胞表现出促癌作用,并脱敏NRF2/GCLC相关抗氧化产生通路
由于观察到抗氧化剂促进了小鼠自发性HCC和异种肝癌模型中的肿瘤发生和生长,我们希望证实这些促进作用是否也存在于体外和体内的人类HCC细胞中。为系统地研究抗氧化治疗在人HCC细胞中的功能影响,一组HCC细胞系,包括MHCC-97L,PLC / PRF / 5,Hep3B和HepG2,分别受到NAC和GSH的处理,然后测量其功能变化。一般来说,NAC和GSH中的一个或两个都会促进一种或多种表型改变,这取决于所检测的HCC细胞系。我们发现NAC或GSH促进MHCC-97L细胞和HepG2细胞的集落形成(附加文件1:图S2a),增加所有四个细胞系的细胞增殖速率(附加文件1:图S2b)和自我更新能力(图2a, b;附加文件1:S2c,d)在中,并且增强了MHCC-97L或Hep3B细胞的迁移能力(图2c-d)和侵袭能力(图2e - f)。为进一步研究抗氧化剂在人HCC中的促癌作用,我们使用MHCC-97L和Hep3B细胞进行后续实验。
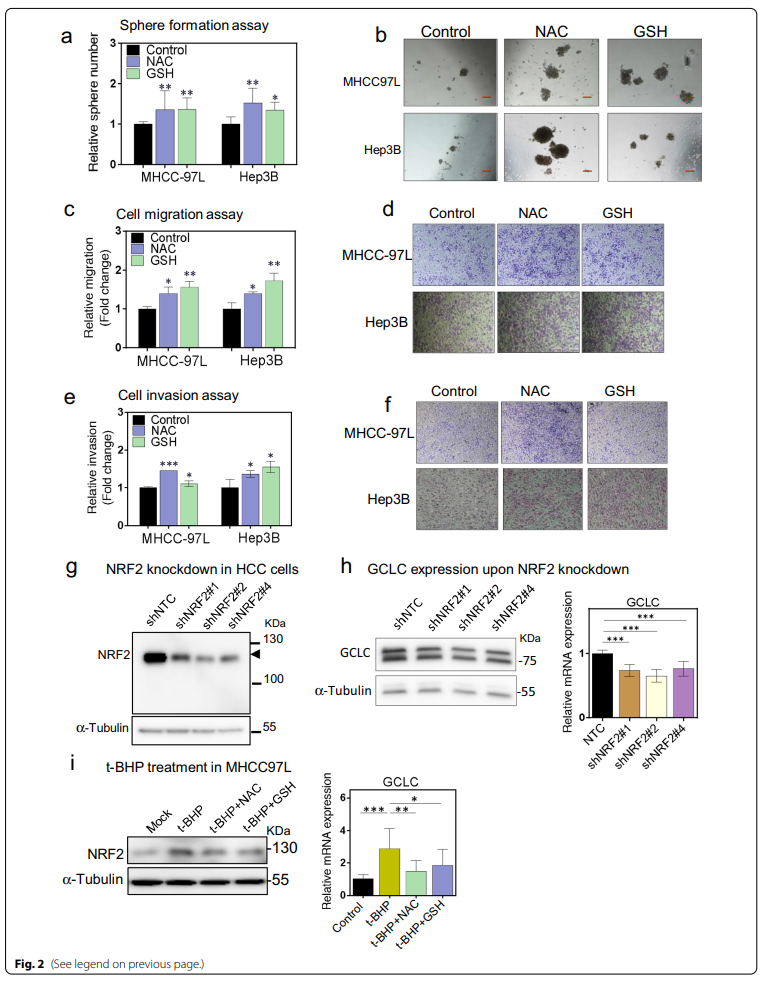
 由于NAC和GSH是含巯基(-SH)抗氧化剂,除了直接中和ROS外,它们还为内源性GSH合成提供前体,包括NRF2调控下的半胱氨酸、谷氨酰胺和甘氨酸,NRF2是细胞氧化应激的主要基因调控因子,谷氨酸-半胱氨酸连接酶催化亚基(GCLC),以及细胞GSH生物合成中的第一限速酶。我们发现,对HCC细胞进行NAC和GSH处理后,溶质载体家族7成员11 (SLC7A11)的表达显著增加(附加表1:图S2e)。GSH处理也显著增强了GCLC的表达(附加数据1:图S2e)。NRF2在MHCC-97L细胞中稳定敲除(图2g)可降低GCLC的表达(图2h)。使用ROS诱导剂叔丁基过氧化氢(t-BHP),激活并稳定NRF2,相应的GCLC表达显著上调(图2i)。然而,外源性补充NAC或GSH降低了NRF2和GCLC的表达(图2i),提示NRF2/GCLC相关的抗氧化产生途径可能脱敏。
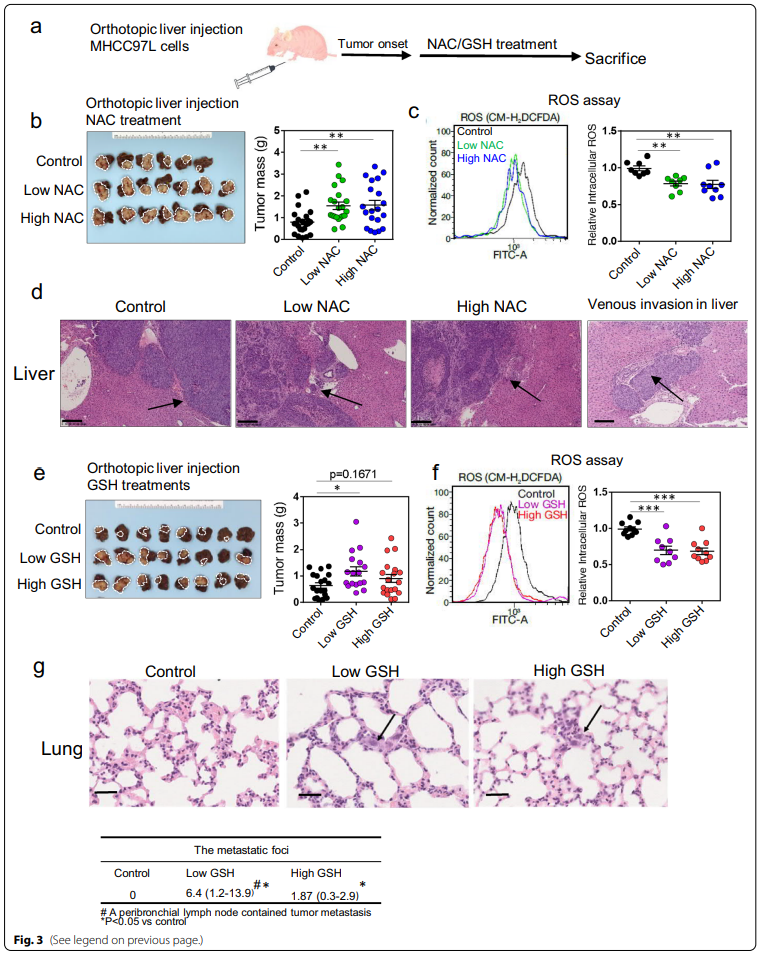
3、NAC和GSH可在体内促进人HCC细胞的生长和进展,并伴有细胞内ROS水平的衰减
为了评估NAC或GSH对体内人HCC细胞肿瘤生长的影响,将MHCC-97L细胞原位注射到肝脏中,然后口服两种剂量的NAC和GSH(图3a)。我们观察到两种剂量的NAC都增强了肿瘤生长,这反映在实验终点处肿瘤肿块的增加(图3b;附加文件1:图 S3a),并伴有肿瘤内ROS水平的显着降低(图3c)。组织学分析进一步显示,与对照组相比,nac处理组的肿瘤生长前沿更具侵袭性(图3d)。在低剂量NAC组和高剂量NAC组的两个肝脏中也观察到肿瘤静脉浸润灶(图3d),表明NAC治疗可能促进肿瘤侵袭性行为。然而,肺组织切片的转移灶定量显示,肺转移灶的数量没有显著差异(附加表1:图S3b)。
另一方面,低剂量和高剂量的GSH要么显着增强,要么显示出肿瘤生长增加的趋势(图13e;附加文件1:图 S3c),尽管低剂量和高剂量的GSH显着降低肿瘤中的ROS水平(图3f)。在低剂量和高剂量GSH治疗小鼠的肿瘤中观察到更多的异种移植瘤生长的不规则前缘(附加文件1::图S3d)。此外,与对照组相比,低剂量和高剂量GSH治疗组的肺部转移灶明显更多(P <0.05)(图3g)。这些数据表明,外源性抗氧化剂NAC和GSH可能通过降低细胞内ROS水平来潜在地促进HCC发生,生长和进展。
由于NAC和GSH是含巯基(-SH)抗氧化剂,除了直接中和ROS外,它们还为内源性GSH合成提供前体,包括NRF2调控下的半胱氨酸、谷氨酰胺和甘氨酸,NRF2是细胞氧化应激的主要基因调控因子,谷氨酸-半胱氨酸连接酶催化亚基(GCLC),以及细胞GSH生物合成中的第一限速酶。我们发现,对HCC细胞进行NAC和GSH处理后,溶质载体家族7成员11 (SLC7A11)的表达显著增加(附加表1:图S2e)。GSH处理也显著增强了GCLC的表达(附加数据1:图S2e)。NRF2在MHCC-97L细胞中稳定敲除(图2g)可降低GCLC的表达(图2h)。使用ROS诱导剂叔丁基过氧化氢(t-BHP),激活并稳定NRF2,相应的GCLC表达显著上调(图2i)。然而,外源性补充NAC或GSH降低了NRF2和GCLC的表达(图2i),提示NRF2/GCLC相关的抗氧化产生途径可能脱敏。
3、NAC和GSH可在体内促进人HCC细胞的生长和进展,并伴有细胞内ROS水平的衰减
为了评估NAC或GSH对体内人HCC细胞肿瘤生长的影响,将MHCC-97L细胞原位注射到肝脏中,然后口服两种剂量的NAC和GSH(图3a)。我们观察到两种剂量的NAC都增强了肿瘤生长,这反映在实验终点处肿瘤肿块的增加(图3b;附加文件1:图 S3a),并伴有肿瘤内ROS水平的显着降低(图3c)。组织学分析进一步显示,与对照组相比,nac处理组的肿瘤生长前沿更具侵袭性(图3d)。在低剂量NAC组和高剂量NAC组的两个肝脏中也观察到肿瘤静脉浸润灶(图3d),表明NAC治疗可能促进肿瘤侵袭性行为。然而,肺组织切片的转移灶定量显示,肺转移灶的数量没有显著差异(附加表1:图S3b)。
另一方面,低剂量和高剂量的GSH要么显着增强,要么显示出肿瘤生长增加的趋势(图13e;附加文件1:图 S3c),尽管低剂量和高剂量的GSH显着降低肿瘤中的ROS水平(图3f)。在低剂量和高剂量GSH治疗小鼠的肿瘤中观察到更多的异种移植瘤生长的不规则前缘(附加文件1::图S3d)。此外,与对照组相比,低剂量和高剂量GSH治疗组的肺部转移灶明显更多(P <0.05)(图3g)。这些数据表明,外源性抗氧化剂NAC和GSH可能通过降低细胞内ROS水平来潜在地促进HCC发生,生长和进展。
 4、抗氧化剂NAC和GSH促进人HCC细胞在体内的肿瘤形成
为了研究外源性抗氧化剂对人HCC细胞体内成瘤的影响,我们采用限制稀释试验,将人肝癌细胞MHCC-97L皮下注射到裸鼠体内,然后分别灌胃两种不同剂量的NAC和GSH(图4a)。NAC处理显著促进了MHCC-97L细胞的成瘤率,且呈剂量依赖性(图4b)。在存在低剂量和高剂量NAC的情况下,MHCC-97L的致瘤性频率的估计置信区间(CI)分别为7045和6367,而对照组为39907,表明NAC显著提高了肿瘤的形成频率(P=0.000276, P=0.000289)(图4c;附图1:图S3e)。同样,低剂量和高剂量GSH也显著增加了MHCC-97L细胞的成瘤频率(P = 0.0004和P<0.0001)(图4b-c;附图1:图S3e)。
4、抗氧化剂NAC和GSH促进人HCC细胞在体内的肿瘤形成
为了研究外源性抗氧化剂对人HCC细胞体内成瘤的影响,我们采用限制稀释试验,将人肝癌细胞MHCC-97L皮下注射到裸鼠体内,然后分别灌胃两种不同剂量的NAC和GSH(图4a)。NAC处理显著促进了MHCC-97L细胞的成瘤率,且呈剂量依赖性(图4b)。在存在低剂量和高剂量NAC的情况下,MHCC-97L的致瘤性频率的估计置信区间(CI)分别为7045和6367,而对照组为39907,表明NAC显著提高了肿瘤的形成频率(P=0.000276, P=0.000289)(图4c;附图1:图S3e)。同样,低剂量和高剂量GSH也显著增加了MHCC-97L细胞的成瘤频率(P = 0.0004和P<0.0001)(图4b-c;附图1:图S3e)。

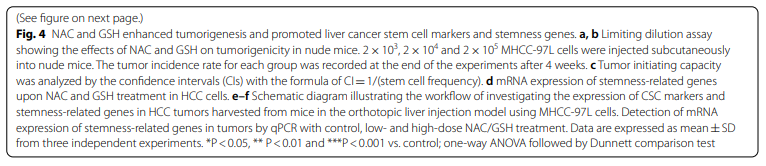 5、NAC和GSH可上调肝癌干细胞标志物和干细胞基因的表达
由于观察到NAC和GSH治疗显着增强了体外自我更新能力和体内致瘤性,因此我们质疑NAC和GSH是否能在体内和体外增强HCC的肿瘤干细胞特性。分别用NAC和GSH处理MHCC-97L和Hep3B细胞,检测肝癌干细胞(CSC)标记物和肿瘤干细胞相关基因表达的变化。NAC和GSH处理均显著增加了所有经过处理的HCC细胞株中干细胞相关基因SMO、NANOG和OCT-4的mRNA水平表达(图4d)。此外,一些干细胞相关基因(如CD13和C-MYC)在NAC处理的HCC细胞中上调,而CD24,CD47,EPCAM和NOTCH1在抗氧化处理的Hep3B细胞中显著上调(图4d)。
使用体内模型,我们还检测了在NAC和GSH治疗后,裸鼠MHCC-97L细胞来源的原位肝肿瘤中肝脏CSC标记物和干细胞相关基因的表达(图4e)。
低剂量NAC显着增加CD13表达(附加文件1:图S3f)。在小鼠中,高剂量NAC和高剂量GSH可显著上调CD44的mRNA表达(附加文件1:图S3g)。在小鼠肿瘤中,其他与干细胞相关的基因包括Nanog、c-Myc和Oct4在低剂量和高剂量NAC治疗后均显著上调(图4f)。同样,低剂量和高剂量的GSH处理也促进了干细胞相关的基因表达包括Nanog、c-Myc和Oct4、SMO和β-catenin(图4f)。然而,GSH对肝脏CSC标志物的表达无影响(附加文件1:图S3f)。总而言之,我们的数据表明,NAC和GSH可能在体外和体内增强HCC干细胞中发挥作用。
6、NAC和GSH在体外和体内抵消了索拉非尼在人HCC细胞中的肿瘤抑制作用
鉴于NAC和GSH可能增强HCC细胞的侵袭性,我们质疑外源性抗氧化剂是否会因此降低HCC细胞对索拉非尼治疗的反应性,索拉非尼治疗是晚期HCC患者的一线分子靶向药物之一。
与索拉非尼单独治疗相比,NAC或GSH与索拉非尼联合治疗可消除索拉非尼对MHCC-97L和Hep3B细胞增殖的抑制作用(图5a)。索拉非尼诱导的ROS水平升高(图5b)和细胞死亡(图5c)在MHCC-97L和/或Hep3B细胞中加入NAC和GSH后降低(图5a–c, 附加文件1:图S4a)。此外,流式细胞术细胞周期分析显示,NAC和GSH处理减少了索拉非尼诱导的MHCC-97L中G1期细胞周期停滞,并增加了G2/M期的细胞数量(附加表1:图S4b)。
5、NAC和GSH可上调肝癌干细胞标志物和干细胞基因的表达
由于观察到NAC和GSH治疗显着增强了体外自我更新能力和体内致瘤性,因此我们质疑NAC和GSH是否能在体内和体外增强HCC的肿瘤干细胞特性。分别用NAC和GSH处理MHCC-97L和Hep3B细胞,检测肝癌干细胞(CSC)标记物和肿瘤干细胞相关基因表达的变化。NAC和GSH处理均显著增加了所有经过处理的HCC细胞株中干细胞相关基因SMO、NANOG和OCT-4的mRNA水平表达(图4d)。此外,一些干细胞相关基因(如CD13和C-MYC)在NAC处理的HCC细胞中上调,而CD24,CD47,EPCAM和NOTCH1在抗氧化处理的Hep3B细胞中显著上调(图4d)。
使用体内模型,我们还检测了在NAC和GSH治疗后,裸鼠MHCC-97L细胞来源的原位肝肿瘤中肝脏CSC标记物和干细胞相关基因的表达(图4e)。
低剂量NAC显着增加CD13表达(附加文件1:图S3f)。在小鼠中,高剂量NAC和高剂量GSH可显著上调CD44的mRNA表达(附加文件1:图S3g)。在小鼠肿瘤中,其他与干细胞相关的基因包括Nanog、c-Myc和Oct4在低剂量和高剂量NAC治疗后均显著上调(图4f)。同样,低剂量和高剂量的GSH处理也促进了干细胞相关的基因表达包括Nanog、c-Myc和Oct4、SMO和β-catenin(图4f)。然而,GSH对肝脏CSC标志物的表达无影响(附加文件1:图S3f)。总而言之,我们的数据表明,NAC和GSH可能在体外和体内增强HCC干细胞中发挥作用。
6、NAC和GSH在体外和体内抵消了索拉非尼在人HCC细胞中的肿瘤抑制作用
鉴于NAC和GSH可能增强HCC细胞的侵袭性,我们质疑外源性抗氧化剂是否会因此降低HCC细胞对索拉非尼治疗的反应性,索拉非尼治疗是晚期HCC患者的一线分子靶向药物之一。
与索拉非尼单独治疗相比,NAC或GSH与索拉非尼联合治疗可消除索拉非尼对MHCC-97L和Hep3B细胞增殖的抑制作用(图5a)。索拉非尼诱导的ROS水平升高(图5b)和细胞死亡(图5c)在MHCC-97L和/或Hep3B细胞中加入NAC和GSH后降低(图5a–c, 附加文件1:图S4a)。此外,流式细胞术细胞周期分析显示,NAC和GSH处理减少了索拉非尼诱导的MHCC-97L中G1期细胞周期停滞,并增加了G2/M期的细胞数量(附加表1:图S4b)。
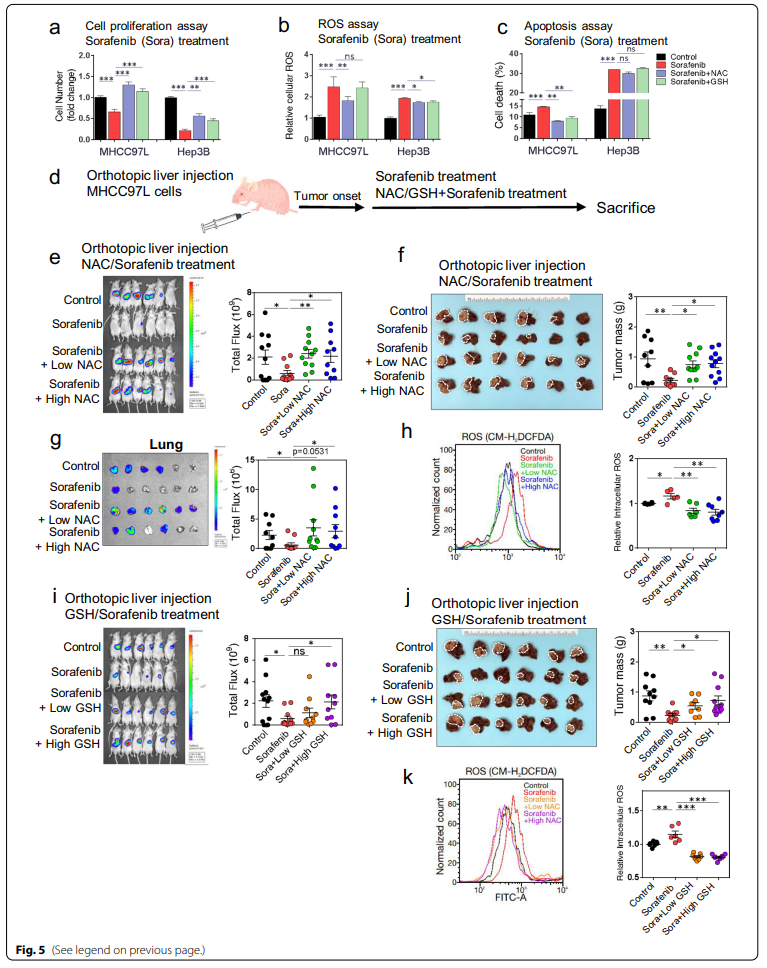
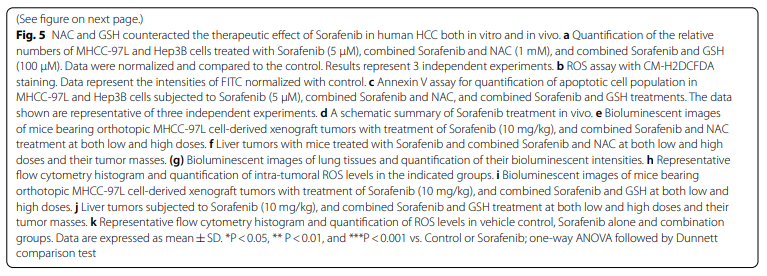 我们在裸鼠MHCC-97L细胞原位肝注射模型中进一步评估了NAC和GSH对索拉非尼体内治疗的影响(图5d)。10 mg/kg时,索拉非尼能有效抑制的肿瘤生长;有趣的是,低剂量和高剂量NAC的添加都能有效地消除这种生长抑制(图5E和附加文件1:图S4c-d),肿瘤肿块明显增多(图5f),肺转移灶明显增多(图5g;附加文件1:图S4d)。与我们的体外实验结果一致,联合治疗组的瘤内ROS水平明显低于索拉非尼单用组(图5h)。低剂量和高剂量的GSH治疗均表现出与索拉非尼介导的肿瘤抑制拮抗作用(图5i,j和附加文件1:图S4e)。然而,在索拉非尼单用组和GSH联合治疗组之间肺转移程度无差异(附加文件1:图S4f),尽管两种剂量的GSH均可显著降低肿瘤内ROS水平(图5k)。
7、NAC和GSH改变了影响代谢和表观遗传学的共同分子途径
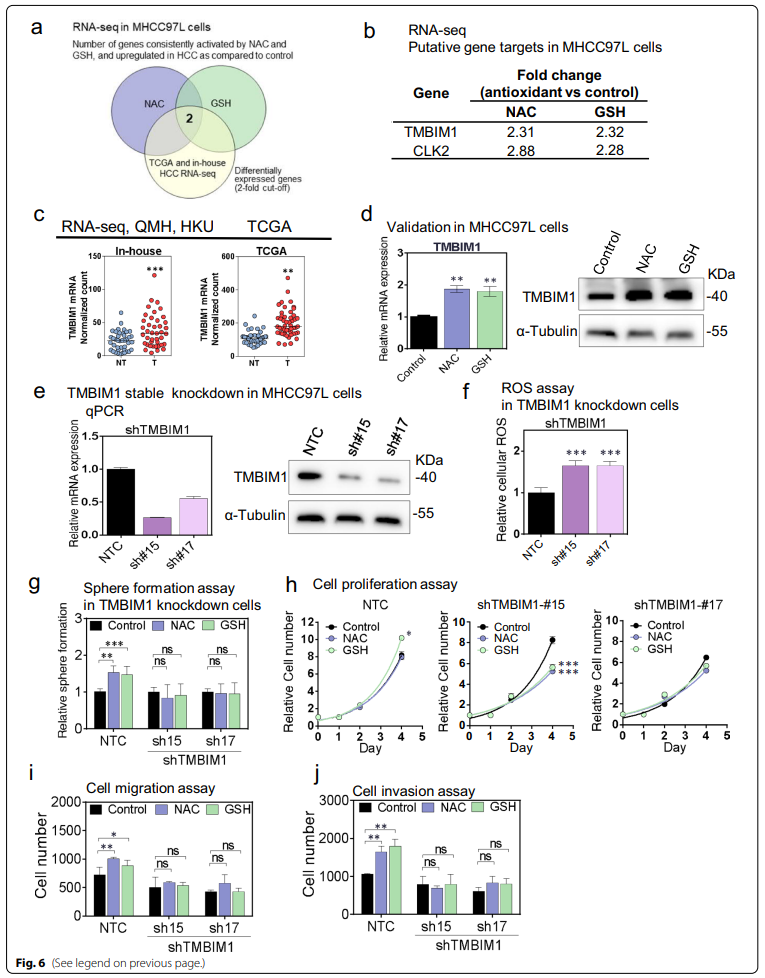
我们质疑它们的潜在行为是否通过共同的分子途径介导。为此,分别用NAC和GSH处理MHCC-97L细胞,然后进行全转录组测序(RNA-seq)。通过提取差异表达≥2倍的基因,在NAC和GSH处理下分别鉴定出155个和162个基因。
通过提取大于2倍的差异表达基因,在NAC和GSH处理下分别鉴定出155个和162个基因(附加文件1:图S5a)。我们将差异表达的基因进行基因集富集分析(GSEA),以寻找被抗氧化处理改变的潜在生物过程(附加文件1:图S5b)。NAC和GSH显著共上调的基因富集在碳水合物代谢过程和发声行为的负调控中,这与生物体的呼吸系统有关(附加文件1:图S5b)。此外,NAC处理还上调了几个细胞代谢过程中的基因,包括修饰的氨基酸代谢和S-腺苷同型半胱氨酸代谢(附加文件1:图S5b),它在蛋氨酸代谢期间提供同型半胱氨酸中发挥关键作用,并促进内源性GSH合成以对抗ROS。另一方面,NAC和GSH处理组共下调的基因主要与表观遗传改变有关,包括表观遗传基因表达,染色质组装和DNA沉默(附加文件1:图1S5c)。
8、TMBIM1在NAC和GSH处理后上调,敲低TMBIM1可以在体外中和抗氧化剂引起的致癌效应
在外源性抗氧化剂处理后的失调基因中,在NAC和GSH处理后,跨膜BAX抑制剂Motif Containing 1 (TMBIM1)和CDC Like Kinase 2 (CLK2) mRNA显著上调(图6a,b),这2个基因在41对临床HCC患者的TCGA数据库和我们内部的RNA-seq数据库中也都有显著过表达(图6c和附加表1:图S6a)。值得注意的是,目前还没有关于TMBIM1对癌症形成和生长影响的全面研究。此外,TMBIM1与癌症中抗氧化剂之间的关系尚不清楚;CLK2的癌基因激酶效应在其他类型的癌症中也有报道。本研究将重点放在TMBIM1的进一步研究上。首先,在MHCC97L细胞中,在mRNA和蛋白质水平上验证了NAC和GSH对TMBIM1的上调(图6d)。TMBIM1的稳定敲除显著增加了MHCC97L细胞内的ROS水平,提示TMBIM1过表达可以抑制肝癌中的氧化应激(图6e, f)。然后我们用外源抗氧化剂NAC和GSH处理TMBIM1敲除细胞。在TMBIM1敲除后,与shNTC相比,抗氧化剂对球形成(图6g)、细胞增殖(图6h)、迁移和侵袭(图6i, j)的促进影响分别被消除(附加1:图S6c-f)。我们的数据表明,TMBIM1可能是外源性抗氧化剂诱导的HCC恶化的潜在下游靶点。
我们在裸鼠MHCC-97L细胞原位肝注射模型中进一步评估了NAC和GSH对索拉非尼体内治疗的影响(图5d)。10 mg/kg时,索拉非尼能有效抑制的肿瘤生长;有趣的是,低剂量和高剂量NAC的添加都能有效地消除这种生长抑制(图5E和附加文件1:图S4c-d),肿瘤肿块明显增多(图5f),肺转移灶明显增多(图5g;附加文件1:图S4d)。与我们的体外实验结果一致,联合治疗组的瘤内ROS水平明显低于索拉非尼单用组(图5h)。低剂量和高剂量的GSH治疗均表现出与索拉非尼介导的肿瘤抑制拮抗作用(图5i,j和附加文件1:图S4e)。然而,在索拉非尼单用组和GSH联合治疗组之间肺转移程度无差异(附加文件1:图S4f),尽管两种剂量的GSH均可显著降低肿瘤内ROS水平(图5k)。
7、NAC和GSH改变了影响代谢和表观遗传学的共同分子途径
我们质疑它们的潜在行为是否通过共同的分子途径介导。为此,分别用NAC和GSH处理MHCC-97L细胞,然后进行全转录组测序(RNA-seq)。通过提取差异表达≥2倍的基因,在NAC和GSH处理下分别鉴定出155个和162个基因。
通过提取大于2倍的差异表达基因,在NAC和GSH处理下分别鉴定出155个和162个基因(附加文件1:图S5a)。我们将差异表达的基因进行基因集富集分析(GSEA),以寻找被抗氧化处理改变的潜在生物过程(附加文件1:图S5b)。NAC和GSH显著共上调的基因富集在碳水合物代谢过程和发声行为的负调控中,这与生物体的呼吸系统有关(附加文件1:图S5b)。此外,NAC处理还上调了几个细胞代谢过程中的基因,包括修饰的氨基酸代谢和S-腺苷同型半胱氨酸代谢(附加文件1:图S5b),它在蛋氨酸代谢期间提供同型半胱氨酸中发挥关键作用,并促进内源性GSH合成以对抗ROS。另一方面,NAC和GSH处理组共下调的基因主要与表观遗传改变有关,包括表观遗传基因表达,染色质组装和DNA沉默(附加文件1:图1S5c)。
8、TMBIM1在NAC和GSH处理后上调,敲低TMBIM1可以在体外中和抗氧化剂引起的致癌效应
在外源性抗氧化剂处理后的失调基因中,在NAC和GSH处理后,跨膜BAX抑制剂Motif Containing 1 (TMBIM1)和CDC Like Kinase 2 (CLK2) mRNA显著上调(图6a,b),这2个基因在41对临床HCC患者的TCGA数据库和我们内部的RNA-seq数据库中也都有显著过表达(图6c和附加表1:图S6a)。值得注意的是,目前还没有关于TMBIM1对癌症形成和生长影响的全面研究。此外,TMBIM1与癌症中抗氧化剂之间的关系尚不清楚;CLK2的癌基因激酶效应在其他类型的癌症中也有报道。本研究将重点放在TMBIM1的进一步研究上。首先,在MHCC97L细胞中,在mRNA和蛋白质水平上验证了NAC和GSH对TMBIM1的上调(图6d)。TMBIM1的稳定敲除显著增加了MHCC97L细胞内的ROS水平,提示TMBIM1过表达可以抑制肝癌中的氧化应激(图6e, f)。然后我们用外源抗氧化剂NAC和GSH处理TMBIM1敲除细胞。在TMBIM1敲除后,与shNTC相比,抗氧化剂对球形成(图6g)、细胞增殖(图6h)、迁移和侵袭(图6i, j)的促进影响分别被消除(附加1:图S6c-f)。我们的数据表明,TMBIM1可能是外源性抗氧化剂诱导的HCC恶化的潜在下游靶点。
 9、靶向GSH和NAC代谢的抑制剂可消除NAC和GSH的促癌作用
我们质疑靶向GSH合成或胱氨酸运输是否能够中和或逆转这些抗氧化剂驱动的促癌作用。为了耗尽细胞中的GSH,使用了GSH合成酶抑制剂Buthionine-sulfoximine(BSO)(图7a;附加文件1:图S7a),而柳氮磺胺吡啶(SSA)是胱氨酸 - 谷氨酸反转运蛋白xCT的亚基SLC7A11的抑制剂,用于阻断胱氨酸的吸收和进口(图7a;附图S7b)。
9、靶向GSH和NAC代谢的抑制剂可消除NAC和GSH的促癌作用
我们质疑靶向GSH合成或胱氨酸运输是否能够中和或逆转这些抗氧化剂驱动的促癌作用。为了耗尽细胞中的GSH,使用了GSH合成酶抑制剂Buthionine-sulfoximine(BSO)(图7a;附加文件1:图S7a),而柳氮磺胺吡啶(SSA)是胱氨酸 - 谷氨酸反转运蛋白xCT的亚基SLC7A11的抑制剂,用于阻断胱氨酸的吸收和进口(图7a;附图S7b)。
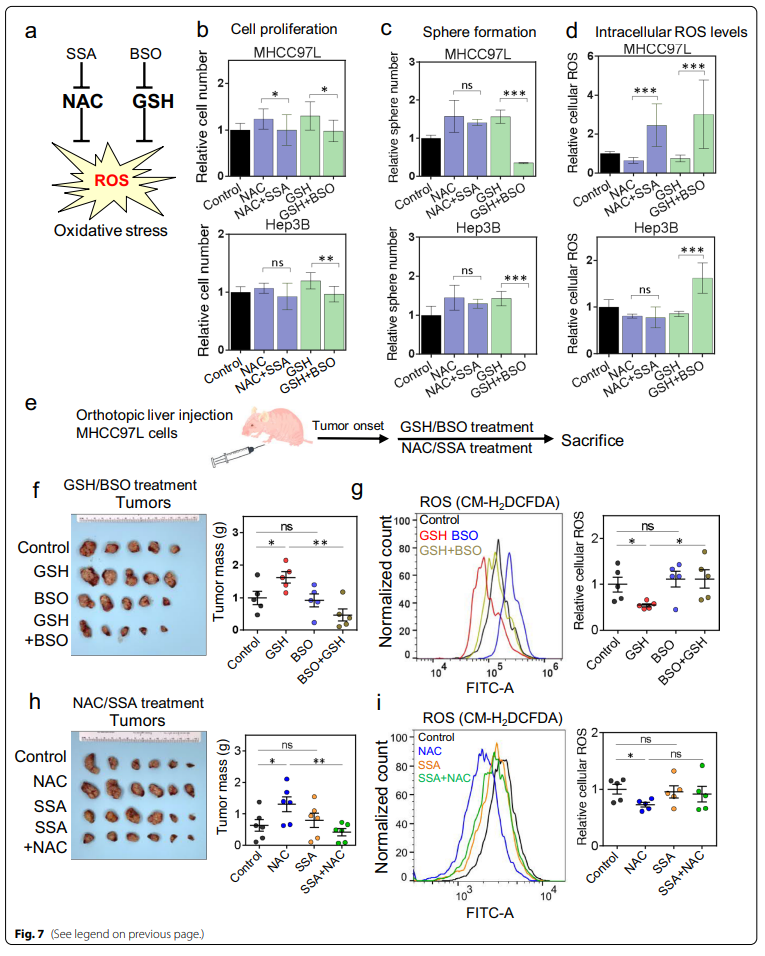
 单独或联合的SSA和BSO能够在MHCC-97L和Hep3B细胞中消除NAC或GSH处理所增强的细胞增殖(图7b和附加项1:图S7c)。此外,BSO而非SSA抑制了这些HCC细胞系的成球能力(附加文件1:图S7d)。有趣的是,在GSH存在下,单个或联合SSA和BSO治疗显着抑制了球形成能力(图7c)。正如预期,BSO、SSA或两者的添加均可增加HCC细胞内ROS水平(附加表1:图S7e)。值得注意的是,BSO和SSA废除了MHCC-97L细胞中GSH和NAC对ROS的还原(图7d),BSO逆转了Hep3B细胞中GSH的ROS减少作用(图7d)。
在体内小鼠模型中(图7e), BSO能够抑制GSH增强的肿瘤生长,而BSO本身并不能改变肿瘤生长(图17f 和附加文件1:图S7f)。给予GSH后,肿瘤内ROS水平显著降低,而BSO,无论是单独使用还是与GSH联合使用,都消除了这种降低ROS的作用(图7g)。BSO和BSO + GSH组的肺转移较少(附加文件1:图S7g)。同样,用NAC + SSA进行体内治疗显着消除了NAC在小鼠体内的促瘤作用,而SSA本身对肿瘤生长无抑制作用(图7h 和附加文件1:图S7h)。与NAC相比,NAC+SSA组合组肿瘤内ROS水平有升高趋势(图7i)。在NAC中加入SSA后,肺转移信号减弱,而肺转移的发生率没有改变(附加文件1:图S7i)。综上,NAC和GSH作为外源性抗氧化剂,通过降低细胞内ROS水平和脱敏NRF2 / GCLC相关的抗氧化剂生产途径,促进HCC的形成,增强肿瘤生长,并在体外和体内抵消索拉非尼的治疗效果。TMBIM1可能是外源抗氧化剂在HCC恶化中潜在下游靶点(图8)。
单独或联合的SSA和BSO能够在MHCC-97L和Hep3B细胞中消除NAC或GSH处理所增强的细胞增殖(图7b和附加项1:图S7c)。此外,BSO而非SSA抑制了这些HCC细胞系的成球能力(附加文件1:图S7d)。有趣的是,在GSH存在下,单个或联合SSA和BSO治疗显着抑制了球形成能力(图7c)。正如预期,BSO、SSA或两者的添加均可增加HCC细胞内ROS水平(附加表1:图S7e)。值得注意的是,BSO和SSA废除了MHCC-97L细胞中GSH和NAC对ROS的还原(图7d),BSO逆转了Hep3B细胞中GSH的ROS减少作用(图7d)。
在体内小鼠模型中(图7e), BSO能够抑制GSH增强的肿瘤生长,而BSO本身并不能改变肿瘤生长(图17f 和附加文件1:图S7f)。给予GSH后,肿瘤内ROS水平显著降低,而BSO,无论是单独使用还是与GSH联合使用,都消除了这种降低ROS的作用(图7g)。BSO和BSO + GSH组的肺转移较少(附加文件1:图S7g)。同样,用NAC + SSA进行体内治疗显着消除了NAC在小鼠体内的促瘤作用,而SSA本身对肿瘤生长无抑制作用(图7h 和附加文件1:图S7h)。与NAC相比,NAC+SSA组合组肿瘤内ROS水平有升高趋势(图7i)。在NAC中加入SSA后,肺转移信号减弱,而肺转移的发生率没有改变(附加文件1:图S7i)。综上,NAC和GSH作为外源性抗氧化剂,通过降低细胞内ROS水平和脱敏NRF2 / GCLC相关的抗氧化剂生产途径,促进HCC的形成,增强肿瘤生长,并在体外和体内抵消索拉非尼的治疗效果。TMBIM1可能是外源抗氧化剂在HCC恶化中潜在下游靶点(图8)。
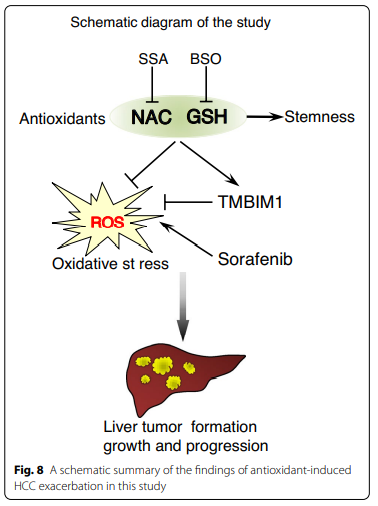 总的来说,本研究表明,外源性抗氧化剂NAC和GSH通过降低细胞内ROS水平和诱导TMBIM的表达,促进HCC的形成和肿瘤的生长,并抵消了索拉非尼的体内外治疗效果。靶向NAC和GSH代谢的抑制剂能逆转这些促癌效应。因此,我们的研究结果为肝癌患者摄入抗氧化剂补充剂提供了科学见解。
总的来说,本研究表明,外源性抗氧化剂NAC和GSH通过降低细胞内ROS水平和诱导TMBIM的表达,促进HCC的形成和肿瘤的生长,并抵消了索拉非尼的体内外治疗效果。靶向NAC和GSH代谢的抑制剂能逆转这些促癌效应。因此,我们的研究结果为肝癌患者摄入抗氧化剂补充剂提供了科学见解。
原文来源:
Zhang et al. Antioxidant supplements promote tumor formation and growth and confer drug resistance in hepatocellular carcinoma by reducing intracellular ROS and induction of TMBIM. Cell & Bioscience (2021) 11:217
https://doi.org/10.1186/s13578-021-00731-0


