基因工程NK细胞疗法获FDA快速通道资格,联合单抗治疗晚期胃癌
时间:2022-01-21 11:19:50 热度:37.1℃ 作者:网络
根据世界卫生组织国际癌症研究署(IARC)发布的2020年全球最新癌症负担数据,胃癌是年新增发病人数第五和年死亡人数第四的癌症。虽然胃癌的治疗效果和选择有所改善,但晚期胃癌仍然是死亡率最高的癌症之一,中位生存期仅为10-12个月,5年生存率为5%-20%。
2021年5月,FDA加速批准了派姆单抗与曲妥珠单抗和标准化疗联合用于局部晚期不可切除或转移性HER2阳性胃癌和胃食管结合部癌(G/GEJ)的一线治疗。然而,完全缓解率只有11.3%。
自然杀伤细胞(NK Cell),是机体重要的免疫细胞,它不同于T细胞和B细胞,无需预先致敏就能非特异性杀伤肿瘤细胞和病毒感染细胞。现在NK细胞正在成为肿瘤免疫治疗的热点,并在癌症治疗中取得了一定成效,有望弥补CAR-T细胞疗法的一些缺点。
2022年1月18日,美国 Cellularity 公司的NK细胞疗法CYNK-101获得了美国FDA的快速通道资格。
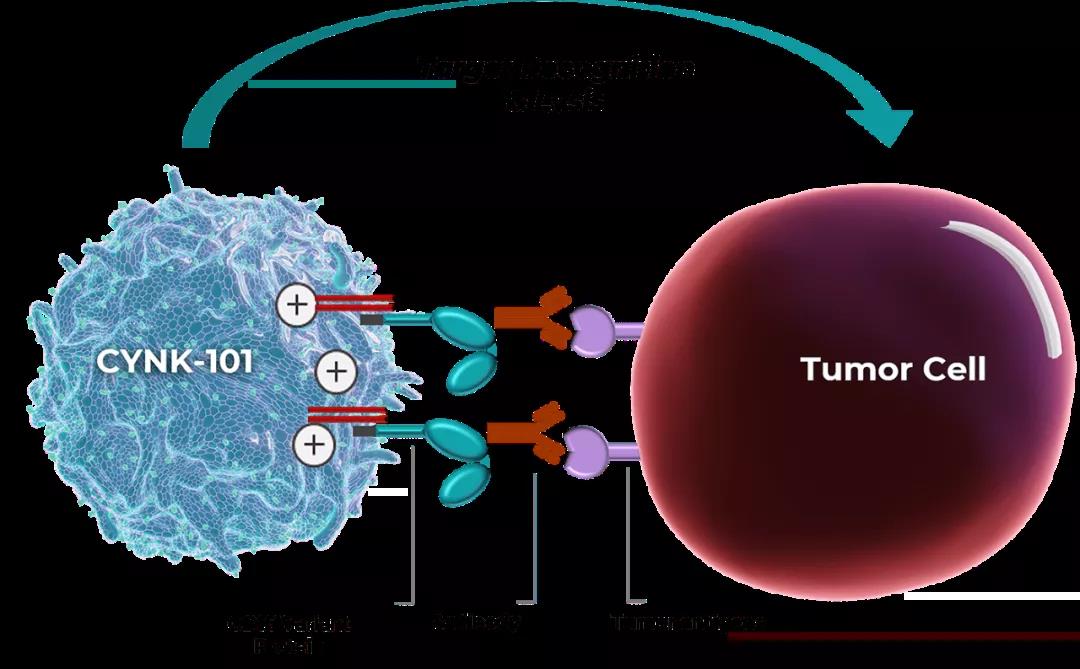
CYNK-101是 Celularity 公司开发的一款胎盘造血干细胞来源的NK细胞疗法,这些NK细胞经过了基因工程改造。目前,该疗法正在进行1/2a期临床试验,评估其与标准化疗和曲妥珠单抗和派姆单抗联合使用进行一线治疗晚期HER2/neu阳性胃癌和胃食管结合部癌(G/GEJ)的安全性和初步疗效。
Celularity 创始人、董事长兼CEO Robert Hariri 博士表示,非常高兴基因修饰的NK细胞疗法能够获得FDA的支持。CYNK-101疗法建立在公司独特的胎盘来源材料的基础上,与其他来源的NK细胞相比,胎盘来源的NK细胞具有自然增强的增殖潜力,这已经被证明是治疗时的持久性和功效潜力的决定因素。而且,还通过基因工程改造,增强其表面的CD16的表达,从而增强CYNK-101与其他单抗协同作用的能力。
据悉,这已经是最近一年时间以来 Celularity 公司第三个获得FDA快速通道资格的NK细胞疗法,前两个均为未经基因修饰的NK细胞,分别用于治疗急性髓细胞白血病和复发性多形性胶质母细胞瘤。

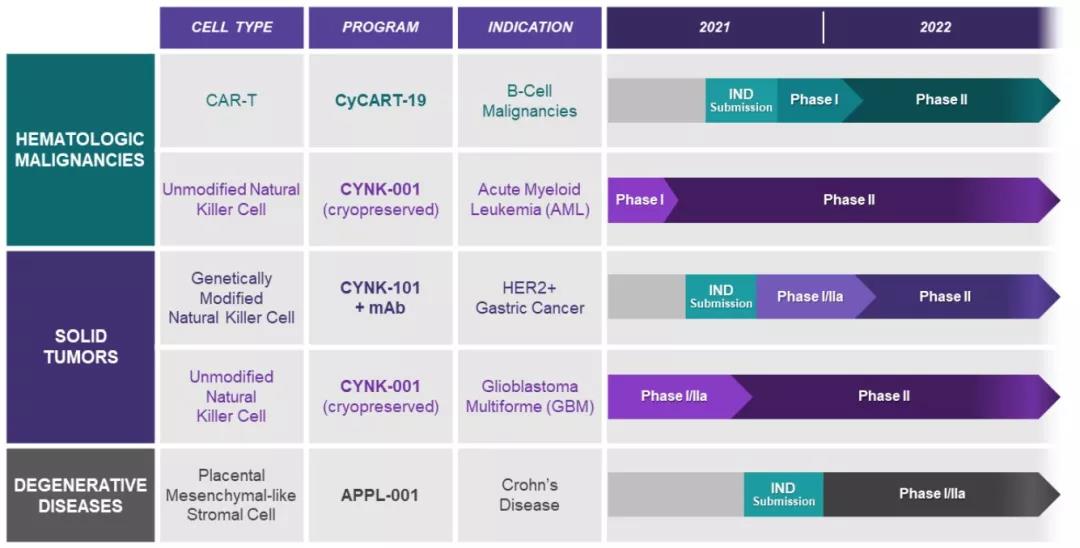
Celularity Inc.(纳斯达克代码:CELU),致力于开发同种异体冷冻保存的现货型胎盘来源的细胞疗法,包括未经修饰的NK细胞、基因修饰的NK细胞、CAR-T细胞及充质样贴壁基质细胞(ASC)。这些疗法治疗的疾病包括血液类癌症、实体瘤、传染病、退行性疾病等。
Celularity 的研发管线
关于快速通道:快速通道是FDA的一种特别审批通道,旨在促进和加快对治疗严重疾病并可能解决当前未满足的医疗需求的新药的审查,从而加快向患者提供重要新药的过程。对于获得快速通道资格的新药,FDA会在早期积极介入,加快研发过程,如果该新药达到某些标准,将可能获得优先审查资格。


